Теоретическое и экспериментальное обоснование использования редокс-системы Fe0-C для очистки карьерных вод от нитрат-ионов
- 1 — аспирант Пермский национальный исследовательский политехнический университет ▪ Orcid
- 2 — д-р техн. наук профессор Пермский национальный исследовательский политехнический университет ▪ Orcid
Аннотация
Карьерные сточные воды предприятий горнодобывающей промышленности при открытой добыче железной руды являются источником загрязнения поверхностных водоемов и подземных вод химическими соединениями, используемыми при ведении разработки, в том числе продуктами распада и неполного расходования нитрата аммония при взрывных работах на рудниках – нитратным, нитритным и аммонийным азотом. Такие особенности сточных вод горнодобывающих предприятий, как многотоннажность, дефицит органического вещества и скудность микробиома, необходимо учитывать при выборе способов обезвреживания. Для очистки сточных вод, загрязненных соединениями азота, используют биологические и физико-химические методы. Ряд методов экономически нецелесообразен в связи со значительными объемами образующихся стоков. Важной задачей является поиск экономически обоснованного и высокоэффективного способа очистки карьерных вод от соединений азота. В статье представлены результаты теоретических и экспериментальных исследований возможности применения проницаемого геохимического барьера на основе редокс-системы, состоящей из железного скрапа и углеродсодержащего материала (отсева производства активного угля марки БАУ) для очистки карьерных вод от нитрат-ионов. Термодинамический анализ позволил определить химизм процесса восстановления нитрат-ионов редокс-системой Fe0-C в нейтральной и слабощелочной среде, характерной для карьерных вод. Изучение кинетических закономерностей восстановления нитрат-ионов позволило установить, что скорость процесса описывается уравнением первого порядка. Установлено, что константа скорости восстановления нитрат-ионов возрастает с повышением температуры реакционной смеси: при 278 K – 0,0365 мин–1, 283 K – 0,0416 мин–1, 288 K – 0,0809 мин–1, 293 K – 0,0901 мин–1. Полученные данные позволят обосновать выбор конструкции реактивного барьера или реактора для проведения процесса очистки. Экспериментальные исследования по очистке реальных и модельных карьерных вод на лабораторной установке, имитирующей геохимический барьер, доказали высокую эффективность редукции нитрат-ионов (более 97 %). Очищенная вода отвечает требованиям к сбросу воды в водоемы рыбохозяйственного назначения.
Введение
Низкое качество водных ресурсов районов, примыкающих к местам разработок месторождений полезных ископаемых, является глобальной экологической проблемой [1, 2]. Неорганические соединения азота входят в перечень загрязняющих веществ, содержание которых в карьерных водах горнодобывающих предприятий превышает санитарные нормы [3], а выщелачивание их из эмульсий и суспензий, используемых в буровзрывных операциях, считается основной причиной поступления в стоки [4-6].
Высокое содержание неорганического азота в водоемах вызывает эвтрофикацию, быстрое накопление токсичных веществ, гибель гидробионтов [7]. Источники водоснабжения в зонах воздействия горнодобывающих предприятий, в частности грунтовые воды, могут быть ограниченно пригодны или непригодны для ирригационных и бытовых целей [8, 9]. Исследования оценки риска для здоровья людей показывают, что употребление воды, не соответствующей по содержанию нитрат-ионов санитарным нормам, создает высокие риски заболеваний [10], таких как метгемоглобинемия и нарушение выработки гормонов щитовидной железы [11]. Особенно подвержены опасному негативному воздействию нитрат-ионов дети [12, 13].
Негативное воздействие рудников на гидрологические объекты предлагается снижать биологическими и физико-химическими методами. К биологическим методам удаления неорганических соединений азота относятся методы микробной денитрификации [14], а также использование сконструированных водно-болотных угодий [15]. Безусловным преимуществом методов фиторемедиации карьерных вод являются низкие эксплуатационные затраты и функционирование на основе биотических механизмов, сочетающих ассимиляцию неорганического азота высшей водной растительностью [16] и механизмы нитрификации-денитрификации микроорганизмами [17]. Однако на эффективность очистки азотсодержащих сточных вод оказывают влияние сезонные колебания температур [18-20], а в экстремальных климатических условиях использование фиторемедиации может потребовать дополнительных мер по сохранению производительности очистных сооружений [21, 22], в связи с чем исследователи относят технологию очистки сточных вод с использованием сконструированных водно-болотных угодий к экстенсивным технологиям [23]. Исследования указывают на существенное влияние дефицита углерода как донора электронов на эффективность денитрификации стоков [24, 25].
Физико-химические методы, например мембранные технологии очистки сточных вод горнодобывающих предприятий от соединений азота, демонстрируют высокую эффективность [26, 27], однако применение данного метода к многотоннажным карьерным сточным водам горнорудных предприятий требует значительных капитальных и эксплуатационных затрат [28].
В настоящее время для очистки сточных вод, содержащих ионы-окислители, используется технология проницаемого реактивного барьера [29]. Технология реализуется в виде подповерхностно размещаемого материала, способного вступать в химические реакции с загрязняющими веществами, трансформируя их в менее токсичные формы [30]. Нульвалентное железо, проявляя свойства восстановителя, в настоящее время выступает основным материалом для обустройства проницаемых реактивных барьеров [31]. Его использование позволяет достигать высоких результатов по очистке территорий от широкого спектра загрязняющих веществ окислительного характера [32, 33], однако информация о механизмах трансформации нитрат-ионов при использовании реактивных материалов противоречива. Анализ научно-технической информации показал, что реакцию восстановления нитрат-ионов нульвалентным железом предлагается проводить в кислой среде [34], при этом основным продуктом восстановления нитрат-ионов в указанных условиях являются ионы аммония [35], содержание которых также строго регламентировано. Значение показателя рН карьерных вод составляет 6-8, и проведение процесса в кислой среде потребует значительных затрат на реагенты.
Ряд исследователей указывает на возможность образования газообразного азота в результате взаимодействия нитрат-ионов с материалом, содержащим Fe0 и Fe2+ [36].
Исследования, проведенные ранее [37], показали высокую эффективность реактивной системы, состоящей из нульвалентного железа и отходов производства активных углей, для очистки карьерных сточных вод от нитрат-ионов. При протекании электрохимических процессов образуется ряд восстановителей, взаимодействующих с нитрат-ионами. Анализ состава очищенных карьерных вод показал незначительное содержание ионов аммония и нитрит-ионов и позволил полагать, что основным продуктом восстановления нитрат-ионов является азот.
Установлено, что процессы, протекающие в редокс-системе Fe0-C при очистке нейтральных и слабощелочных карьерных вод от нитрат-ионов, а также их скорость значительно отличаются от данных, представленных в исследованиях по применению проницаемого реактивного барьера, содержащего нульвалентное железо, при очистке загрязненных стоков с низкими значениями рН. В связи с этим для установления механизма восстановления нитрат-ионов гальванопарой Fe0-C в растворах, близких к нейтральным и слабощелочным, возникла необходимость более подробного изучения процессов, протекающих в реакционной среде.
Целью представленной работы являлось теоретическое и экспериментальное обоснование использования редокс-системы, состоящей из смеси железной стружки и углеродсодержащего материала, для очистки карьерных вод от нитрат-ионов.
Методы
Исследования проводили как на реальных карьерных стоках, так и на растворах, которые готовили в лаборатории, моделируя химический состав карьерной воды. Химический состав карьерных вод горно-рудного предприятия представлен в табл.1 (по данным многолетних мониторинговых исследований).
Таблица 1
Химический состав карьерной воды горно-рудного предприятия
|
Компонент |
ПДКрх*, мг/дм3 |
Концентрация, мг/дм3 |
|
|
Максимальные значения |
Средние значения |
||
|
рН |
Фоновые значения |
8,1 |
7,6 |
|
Ион аммония |
0,5 (0,4 мгN/дм3) |
79,8 |
26,8 |
|
Марганец |
0,01 |
1,02 |
0,46 |
|
Нитрит-ион |
0,08 (0,02 мгN/дм3) |
4,38 |
1,71 |
|
Нитрат-ион |
40 (9 мгN/дм3) |
599,4 |
230,8 |
|
Сульфат-ион |
100 |
643,0 |
378,1 |
|
Хлорид-ион |
300,0 |
188,2 |
66,4 |
|
Железо общее |
0,1 |
1,8 |
0,5 |
|
Сухой остаток |
1000 |
1998 |
1919 |
*ПДКрх – нормативы предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного назначения, утвержденные Приказом Министерства сельского хозяйства РФ от 13 декабря 2016 г. № 552.
Для получения модельных растворов использовали реактивы квалификации «ЧДА» и водопроводную воду.
В исследовании процессов очистки карьерных вод от нитрат-ионов с использованием редокс-системы Fe0-C применялись железосодержащие отходы металлообрабатывающего производства – железный скрап (стружка) с размером частиц 3,5-4 мм и отходы производства активных углей марки БАУ (фракция 3-4 мм). Железная стружка очищалась от загрязнений и промывалась дистиллированной водой. Для активации процессов коррозии железа гальванопара предварительно обрабатывалась 0,1 н раствором соляной кислоты.
Эксперименты проводились в статическом и динамическом режимах.
В статическом режиме в реакционных сосудах исследовались кинетические закономерности процесса редукции нитрат-ионов. Модельные растворы карьерных вод объемом 1 дм3 с рН 7,0 при постоянном перемешивании обрабатывались гальванопарой Fe0-C при температурах 278, 283, 288 и 293 K. Масса гальванопары составляла 5 г, массовое соотношение Fe0-C 2:1. Для построения кинетической кривой определяли содержание нитрат-ионов в пробах через заданные промежутки времени – от 10 до 90 мин. Концентрация нитрат-ионов в растворах составляла 88,1±18,0 мгN/дм3.
В динамическом режиме на лабораторной установке, имитирующей работу геохимического барьера, исследовалась эффективность очистки карьерных вод. Установка состояла из модельного фильтра объемом 0,5 дм3, содержащего смесь железного скрапа, отсева активного угля и песка (объем загрузки Fe0-C составлял 0,43 дм3), высота слоя – 14 см. Массовое соотношение Fe0-C составляло 2:1. Через фильтр c постоянной скоростью пропускалась карьерная или модельная вода с исходной концентрацией нитрат-ионов от 81,8±16,0 до 137,2±27,0 мгN/дм3, рН 7,0-7,6, температурой T = 293 К. Фильтрат отбирался порциями по 1,5-2 дм3, в которых определяли нитрат-, нитрит-ионы и ионы аммония.
Массовая концентрация нитрат-ионов в исходных и очищенных пробах определялась фотометрическим методом с салициловой кислотой (ПНД Ф 14.1:2:4.4-95). Содержание ионов аммония определялось согласно методике выполнения количественного химического анализа с реактивом Несслера (ПНД Ф 14.1:2:3.1-95). Содержание нитрит-ионов контролировалось фотометрическим методом с реактивом Грисса (ПНД Ф 14.1:2:3:4.3-95). Фотометрические определения выполнялись с использованием спектрофотометра Ecoview-1200.
Работа лабораторной установки сопровождалась образованием мелкокристаллического осадка, состав которого был проанализирован методом рентгенофазового анализа с использованием рентгеновского дифрактометра Shimadzu XRD-7000. Обработка рентгенограмм производилась с использованием программного обеспечения XRD 5.21.
Обсуждение результатов
Электрохимический метод очистки карьерных вод от соединений азота (нитрат- и нитрит-ионов) основан на взаимодействии компонентов гальванической пары (редокс-системы) – материалов, обладающих разным электрохимическим потенциалом. Нульвалентное железо, величина стандартного электродного потенциала E0 которого равна −0,44 B, в системе выполняет роль анода, окисляется и подвергается гидролизу согласно уравнениям реакций:
Углерод, величина стандартного электродного потенциала которого равна +0,475 B, в исследуемой системе выполняет функции катодных участков. На катодных участках протекают процессы восстановления водорода из воды или кислорода, растворенного в воде, в соответствии с реакциями:
Для теоретического обоснования наиболее вероятных реакций восстановления нитрат-ионов в редокс-системе Fe0-C был выполнен термодинамический анализ процессов и определены величины стандартной свободной энергии Гиббса ∆G298 и константы равновесия Kp окислительно-восстановительных реакций, являющиеся критериями направленности и глубины протекания самопроизвольных процессов.
Изменение стандартной энергии Гиббса окислительно-восстановительной реакции определяется согласно формуле:
где n – число электронов, принимающих участие в окислительно-восстановительной реакции;F – постоянная Фарадея; E0 – значение электродвижущей силы (ЭДС) реакции, определяемой как разница стандартных электродных потенциалов окислителя и восстановителя.
Стандартная энергия Гиббса лежит в основе расчета констант равновесия реакции при любой температуре согласно формуле ΔG0T=-RTlnKP:
Результаты термодинамического анализа возможных реакций восстановления нитрат-ионов гальванопарой Fe0-C представлены в табл.2.
Анализ полученных данных показал, что в редокс-системе Fe0-C восстановление нитрат-ионов возможно с образованием ряда продуктов, формирование которых зависит от рН среды и природы восстановителя (Fe0, Fe2+, Fe(OH)2, H2). Возможно протекание процессов восстановления:
- нитрат-ионов до нитрит-ионов в диапазоне рН среды от нейтральной (реакции 1-6) до щелочной (реакция 8);
- нитрат-ионов до ионов аммония в нейтральной среде (реакции 9, 11);
- нитрат-ионов до оксида азота (II) в нейтральной (реакции 7, 10) и кислой (реакция 13) среде;
- нитрат-ионов до газообразного азота в кислой (реакции 12, 15, 16, 18) и в нейтральной (реакции 14, 17, 19) среде.
Таблица 2
Термодинамический анализ реакций восстановления нитрат-ионов гальванопарой Fe0-C (стандартные условия)
|
№ п/п |
Уравнение реакции |
ΔG298, Дж |
Kp |
|
1 |
|
−81832 |
1014 |
|
2 |
|
−86850 |
1015 |
|
3 |
|
−90845 |
1016 |
|
4 |
|
−91038 |
1016 |
|
5 |
|
−110010 |
1019 |
|
6 |
|
−118058 |
1021 |
|
7 |
|
−158646 |
1028 |
|
8 |
|
−171191 |
1030 |
|
9 |
|
−263020 |
1046 |
|
10 |
|
−331217 |
1058 |
|
11 |
|
−339680 |
1060 |
|
12 |
|
−458375 |
1080 |
|
13 |
|
−810600 |
10142 |
|
14 |
|
−1380046 |
10242 |
|
15 |
|
−1596110 |
10280 |
|
16 |
|
−1621200 |
10285 |
|
17 |
|
−1697531 |
10298 |
|
18 |
|
−1777240 |
10312 |
|
19 |
|
−1853572 |
10326 |
Как видно из представленных данных, продукты восстановления нитрат-ионов зависят от рН среды. При этом в широком диапазоне рН реакции, протекающие с образованием газообразных продуктов, включая азот, термодинамически наиболее вероятны.
Формирование устойчивых форм соединений железа и азота может быть графически отображено в виде диаграммы зависимости рН среды и величины окислительно-восстановительного потенциала системы Eh (диаграммы Пурбе). На рис.1 представлена диаграмма Eh-pH для системы Fe-N-H2O, построенная на основании справочных данных о величинах электродных потенциалов и pH гидратообразования (серым прямоугольником выделен изучаемый диапазон рН).
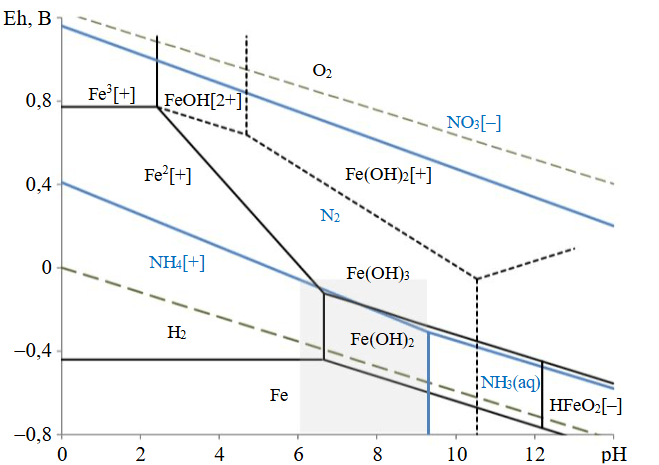
Рис.1. Диаграмма Eh-pH для системы Fe-N-H2O, стандартные условия (гидратированная форма окислов)
Процессы окисления железа в интервале рН 6-9 приводят к образованию ионов Fe2+, Fe(OH)2+, а также гидроксидов железа (II) и (III). При этом продуктами восстановления нитрат-ионов являются азот и ионы аммония, что подтверждается результатами термодинамических расчетов (табл.2).
Авторами [38] изучено совместное извлечение нитрат-ионов и ионов железа (III) материалом, полученным на основе сталеплавильного шлака. Со ссылками на исследования Д.Льюиса, О.Е.Звягинцева и Ю.С.Лопатто, Т.Спиро, С.Аллертона и Дж.Реннера показана возможность образования ряда полигидроксокомплексов железа (III), имеющих цепочечную и сферическую структуры, а также указано, что процесс поликонденсации биядерных гидроксоаквакомплексов Fe3+ сопровождается связыванием нитрат-ионов в структуры типа [Fe4O3(OH)5]NO3.
Экономическая целесообразность использования редокс-системы Fe0-C для очистки многотоннажных карьерных сточных вод от нитрат-ионов определяется скоростью протекания электрохимической реакции.
В этой связи были изучены кинетические закономерности процесса восстановления нитрат-ионов гальванопарой Fe0-C. В исследовании использованы модельные растворы карьерных вод с концентрацией нитрат-ионов 88,1±18,0 мгN/дм3. Зависимость изменения концентрации нитрат-ионов от времени контакта определялась при температурах 278, 283, 288 и 293 K (5-20 °С).
Для определения порядка реакции кинетические кривые построены в координатах lnC0/С нитрат-ионов от времени, и установлено, что они с высокой степенью аппроксимации могут быть описаны уравнением первого порядка:
где ν – скорость реакции; t– время контакта; k– константа скорости химической реакции.
На основании полученных зависимостей определены величины констант скорости электрохимического восстановления нитрат-ионов гальванопарой Fe0-C при температурах 278, 283, 288 и 293 K. Результаты представлены на рис.2.
Константа скорости электрохимического восстановления нитрат-ионов при повышении температуры проведения процесса возрастает: k= 0,0365 мин–1 при Т = 278 K, k= 0,0416 мин–1 при 283 K, k= 0,0809 мин–1 при 288 K, k= 0,0901 мин–1 при 293 K.
Сравнение полученных данных с известной научно-технической информацией показало, что скорость восстановления ионов NO3– редокс-системой Fe0-C выше, чем в исследованиях по использованию макроразмерных частиц нульвалентного железа, где при исходной концентрации нитрат-ионов 50 мг/дм3 и дозе железа 100 г/дм3 при pH 2,5 константа скорости k = 0,0052 мин–1 [39]. Константа скорости в исследуемой системе Fe0-C выше в сравнении с данными редукции нитрат-ионов с использованием порошкообразного железа, где при pH 2,5 и 6,7 и дозе Fe0 10 г/дм3 k равна 0,016 и 0,0043 мин–1 соответственно.
На основании результатов кинетического анализа по уравнению Аррениуса рассчитано значение энергии активации EA реакции восстановления нитрат-ионов редокс-системой Fe0-C:
где R – универсальная газовая постоянная; k1 – константа скорости реакции при температуре T1; k2 – константа скорости реакции при температуре T2,
Установлено, что значение энергии активации EA реакции восстановления нитрат-ионов редокс-системой Fe0-C равно 53 кДж/моль и находится в кинетической области; химическая реакция является лимитирующей стадией в процессе восстановления нитрат-ионов изучаемой редокс-системой.
Результаты кинетического анализа могут быть использованы для расчета времени контакта сточной воды с гальванопарой Fe0-C, необходимого для изменения концентрации нитрат-ионов в карьерной воде до ПДК и в дальнейшем позволят обосновать выбор конструкции реактивного барьера или реактора для проведения процесса очистки.
В практике очистки многотоннажных сточных вод наиболее целесообразно проводить процесс в динамическом режиме.
Для экспериментального обоснования использования редокс-системы Fe0-C для очистки карьерных вод от нитрат-ионов в проницаемом редокс-барьере были проведены исследования на модельной установке с использованием реальной и модельной сточных вод с рН 7,0-7,6 и концентрацией нитрат-ионов от 81,8±16,0 до 137,2±27,0 мгN/дм3. Скорость подачи воды в установку соответствовала времени контакта, необходимому для протекания электрохимической реакции в соответствии с результатами кинетического анализа. Результаты исследований представлены в табл.3.
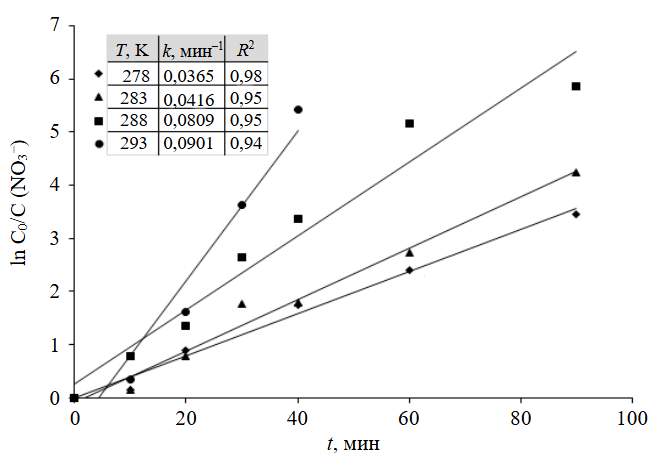
Рис.2. Кривые зависимости lnC0/С нитрат-ионов от времени реакции С0(NO3–) = 88,1±18,0 мгN/дм3; СFe-C = 5 г/дм3; рН 7,0; частота перемешиваний 250 об/мин; R2 – величина достоверности аппроксимации
Таблица 3
Результаты исследований редукции нитрат-ионов гальванопарой Fe0-C в динамическом режиме (T = 293 K)
|
Объем пропущенного раствора в серии, колоночные объемы |
Суммарный объем пропущенного раствора, колоночные объемы |
Концентрация нитрат-ионов до очистки, мгN/дм3 |
Концентрация загрязняющих веществ после редокс-системы, мгN/дм3 |
Степень очистки от нитрат-ионов, % |
||
|
NO3– |
NO2– |
NH4+ |
||||
|
77 |
77 |
81,8±16,0 |
0,4±0,1 |
0,12±0,02 |
8,9±1,9 |
99,5 |
|
25 |
102 |
125,9±25,0 |
2,7±0,5 |
0,19±0,03 |
13,2±2,8 |
97,9 |
|
127 |
229 |
105,4±21,0 |
1,2±0,2 |
н.п.о* |
8,4±1,8 |
98,9 |
|
95 |
324 |
95,4±19,0 |
2,6±0,5 |
0,24±0,03 |
2,8±0,6 |
97,3 |
|
53 |
377 |
137,2±27,0 |
2,9±0,6 |
0,50±0,07 |
1,8±0,4 |
97,9 |
*н.п.о – ниже предела обнаружения.
Полученные данные свидетельствуют о том, что при прохождении через систему более 377 колоночных объемов, что соответствует более 160 дм3, эффективность очистки по нитрат-иону составляла не менее 97 % и содержание NO3– в фильтрате было значительно ниже ПДКрх (40 мг/дм3 или 9 мгN/дм3). Визуальная оценка состояния редокс-системы показала, что железная стружка была окислена менее чем на треть.
После прохождения растворов через установку наблюдалось повышение значения рН до 7,9-8,2, что обусловлено процессами кислородной и водородной деполяризации, протекающими на катодных участках гальванопары, сопровождающимися накоплением гидроксо-групп в прикатодном пространстве.
Расчет материального баланса процесса очистки карьерных вод по азоту показывает, что основная часть нитрат-ионов восстанавливается до газообразных соединений, что согласуется с термодинамическими расчетами, а также данными, представленными в литературе [36, 40].
Для обоснования механизма процессов, протекающих в исследуемой редокс-системе, был проведен анализ образующихся при окислении железа твердых фаз. Результаты рентгенофазового анализа образца формирующейся твердой фазы представлены на рис.3.
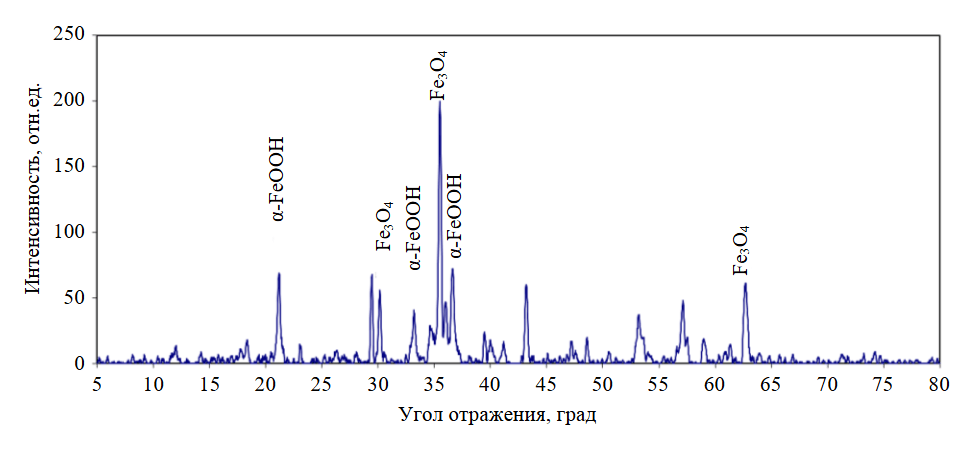
Рис.3. Дифрактограмма образца твердой фазы, образующейся при восстановлении нитрат-ионов гальванопарой Fe0-C
В образце идентифицированы гетит α-FeOOH (межплоскостные расстояния, Å: 4,18095 (21,2°); 2,69207 (33,23°); 2,44935 (36,7°) и магнетит Fe3O4 (межплоскостные расстояния, Å: 2,95759 (30,2°); 2,5239 (35,5°); 2,09152 (43,2°); 1,47991 (62,7°).
Полученные данные согласуются с результатами термодинамического анализа процессов, протекающих в рассматриваемой системе, и указывают на протекание реакций в слабощелочной среде. Также на дифрактограмме (рис.3) присутствуют пики кальцита CaCO3 (межплоскостные расстояния, Å: 3,02751 (29,5°); 1,90917 (47,6°); 1,87149 (48,6°), который может образовываться при очистке карьерных вод, содержащих гидрокарбонат-ионы.
Полученные данные в целом согласуются с исследованиями в области геохимического моделирования проницаемых реактивных барьеров [41, 42].
Заключение
Обзор практики очистки сточных вод горно-рудных предприятий показал, что поиск эффективной и экономически целесообразной технологии очистки многотоннажных карьерных стоков от соединений азота является в настоящее время актуальной задачей.
В представленном исследовании показана возможность очистки нейтральных и слабощелочных карьерных вод от нитрат-ионов гальванопарой Fe0-C. На основании проведенного термодинамического анализа процессов восстановления нитрат-ионов редокс-системой Fe0-C установлены наиболее вероятные реакции и основные продукты восстановления. Показано, что в нейтральной среде возможно протекание реакций с образованием ионов аммония и газообразного азота, при этом реакции, протекающие с образованием газообразного азота, термодинамически наиболее вероятны.
Экспериментальные данные показывают высокую эффективность применения редокс-системы, состоящей из железного скрапа и углеродного материала, для снижения содержания нитрат-ионов в карьерных сточных водах. Эффективность обеспечивается наличием в редокс-системе ряда сильных восстановителей − нульвалентного железа, ионов железа (II), водорода, образующегося на катодных участках гальванопары, а также гидроксида железа (II).
Осадок, образующийся при работе редокс-системы, представляет смесь термодинамически устойчивых фаз кислородсодержащих соединений железа – гетита и магнетита.
Изучение кинетических закономерностей восстановления нитрат-ионов редокс-системой Fe0-C позволило определить порядок и константу скорости электрохимической реакции при температурах 278, 283, 288 и 293 К. Скорость процесса описывается уравнением первого порядка, константа скорости k возрастает при повышении температуры реакционной смеси: k= 0,0365 мин–1 при T = 278 K, k= 0,0416 мин–1 при 283 K, k= 0,0809 мин–1 при 288 K, k= 0,0901 мин–1 при 293 K. Значение энергии активации EA процесса восстановления нитрат-ионов редокс-системой Fe0-C находится в кинетической области и равно 53 кДж/моль.
Полученные в представленной работе результаты могут быть использованы при разработке технических решений для очистки карьерных сточных вод горно-рудных предприятий.
Литература
- Abascal E., Gómez-Coma L., Ortiz I., Ortiz A. Global diagnosis of nitrate pollution in groundwater and review of removal technologies // Science of the Total Environment. 2022. Vol. 810. № 152233. DOI: 10.1016/j.scitotenv.2021.152233
- Garcia-Zavala C., Ordens C.M., Pagliero L. et al. An approach for prioritising environmental, social and governance (ESG) water-related risks for the mining industry: The case of Chile // The Extractive Industries and Society. 2023. Vol. 14. № 101259. DOI: 10.1016/j.exis.2023.101259
- Jie Hu, Xing Chen, Yeyu Chen et al. Nitrate sources and transformations in surface water of a mining area due to intensive mining activities: Emphasis on effects on distinct subsidence waters // Journal of Environmental Management. 2021. Vol. 298. № 113451. DOI: 10.1016/j.jenvman.2021.113451
- Lai F., Beylot A., Navarro R. et al. The environmental performance of mining operations: Comparison of alternative mining solutions in a life cycle perspective // Journal of Cleaner Production. 2021. Vol. 315. № 128030. DOI: 10.1016/j.jclepro.2021.128030
- Oluwoye I., Dlugogorski B.Z., Gore J. et al. Atmospheric emission of NOx from mining explosives: A critical review // Atmospheric Environment. 2017. Vol. 167. P. 81-96. DOI: 10.1016/j.atmosenv.2017.08.006
- Ferreira H., Mariangela Garcia Praça Leite. A Life Cycle Assessment study of iron ore mining // Journal of Cleaner Production. 2015. Vol. 108. Part A. P. 1081-1091. DOI: 10.1016/j.jclepro.2015.05.140
- Akinnawo S.O. Eutrophication: Causes, consequences, physical, chemical and biological techniques for mitigation strategies // Environmental Challenges. 2023. Vol. 12. № 100733. DOI: 10.1016/j.envc.2023.100733
- Kazapoe R.W., Addai M.O., Amuah E.E.Y., Dankwa P. Characterization of groundwater in southwest Ghana: Implications for sustainable agriculture and safe water supply in a mining-dominated zone // Environmental and Sustainability Indicators. 2024. Vol. 22. № 100341. DOI: 10.1016/j.indic.2024.100341
- Gbedzi D.D., Ofosu E.A., Mortey E.M. et al. Impact of mining on land use land cover change and water quality in the Asutifi North District of Ghana, West Africa // Environmental Challenges. 2022. Vol. 6. № 100441. DOI: 10.1016/j.envc.2022.100441
- Sunitha V., Sudharshan Reddy Y., Suvarna B., Muralidhara Reddy B. Human health risk assessment (HHRA) of fluoride and nitrate using pollution index of groundwater (PIG) in and around hard rock terrain of Cuddapah, A.P. South India // Environmental Chemistry and Ecotoxicology. 2022. Vol. 4. P. 113-123. DOI: 10.1016/j.enceco.2021.12.002
- Lei King, Qiang Wang, Lili Xia et al. Environmental exposure to perchlorate, nitrate and thiocyanate, and thyroid function in Chinese adults: A community-based cross-sectional study // Environment International. 2023. Vol. 171. № 107713. DOI: 10.1016/j.envint.2022.107713
- Kom K.P., Gurugnanam B., Bairavi S. Non-carcinogenic health risk assessment of nitrate and fluoride contamination in the groundwater of Noyyal basin, India // Geodesy and Geodynamics. 2022. Vol. 13. Iss. 6. P. 619-631. DOI: 10.1016/j.geog.2022.04.003
- Stayner L.T., Almberg K., Jones R. et al. Atrazine and nitrate in drinking water and the risk of preterm delivery and low birth weight in four Midwestern states // Environmental Research. 2017. Vol. 152. P. 294-303. DOI: 10.1016/j.envres.2016.10.022
- Hao Su, Yukun Deng, Jiejun Zhao et al. Excellent, steady and economical nitrogen removal in highly variable mining wastewater via three-stage partial-denitrification/partial-nitrification/anammox system: A pilot-scale demonstration // Journal of Water Process Engineering. 2023. Vol. 54. № 103896. DOI: 10.1016/j.jwpe.2023.103896
- Пашкевич М.А., Коротаева А.Э. Оценка эффективности процесса фитоэкстракции при очистке карьерных сточных вод // Горный информационно-аналитический бюллетень. 2022. № 6-1. С. 349-360. DOI: 10.25018/0236_1493_2022_61_0_349
- Ting W.H.T., Tan I.A.W., Salleh S.F., Wahab N.A. Ammoniacal nitrogen removal by Eichhornia crassipes-based phytoremediation: process optimization using response surface methodology // Applied Water Science. 2020. Vol. 10. Iss. 3. № 80. DOI: 10.1007/s13201-020-1163-x
- Rampuria A., Gupta A.B., Brighu U. Nitrogen transformation processes and mass balance in deep constructed wetlands treating sewage, exploring the anammox contribution // Bioresource Technology. 2020. Vol. 314. № 123737. DOI: 10.1016/j.biortech.2020.123737
- Mietto A., Politeo M., Breschigliaro S., Borin M. Temperature influence on nitrogen removal in a hybrid constructed wetland system in Northern Italy // Ecological Engineering. 2015. Vol. 75. P. 291-302. DOI: 10.1016/j.ecoleng.2014.11.027
- Hube S., Zaqout T., Ögmundarson Ó. et al. Constructed wetlands with recycled concrete for wastewater treatment in cold climate: Performance and life cycle assessment // Science of the Total Environment. 2023. Vol. 904. № 166778. DOI: 10.1016/j.scitotenv.2023.166778
- Ying-hua Li, Hai-bo Li, Xin-yang Xu et al. Fate of nitrogen in subsurface infiltration system for treating secondary effluent // Water Science and Engineering. 2017. Vol. 10. Iss. 3. P. 217-224. DOI: 10.1016/j.wse.2017.10.002
- Xuli Zhu, Liang Jiao, Xuan Wu et al. Ecosystem health assessment and comparison of natural and constructed wetlands in the arid zone of northwest China // Ecological Indicators. 2023. Vol. 154. № 110576. DOI: 10.1016/j.ecolind.2023.110576
- Mo Wang, Dong Qing Zhang, Jian Wen Dong, Soon Keat Tan. Constructed wetlands for wastewater treatment in cold climate – A review // Journal of Environmental Sciences. 2017. Vol. 57. P. 293-311. DOI: 10.1016/j.jes.2016.12.019
- de la Varga D., Soto M., Arias C.A. et al. Constructed Wetlands for Industrial Wastewater Treatment and Removal of Nutrients // Technologies for the Treatment and Recovery of Nutrients from Industrial Wastewater. IGI Global, 2017. P. 202-230. DOI: 10.4018/978-1-5225-1037-6.ch008
- Guerrero-Brotons M., Álvarez-Rogel J., Arce M.I., Gómez R. Addressing the C/N imbalance in the treatment of irrigated agricultural water by using a hybrid constructed wetland at field-scale // Journal of Environmental Management. 2023. Vol. 348. № 119329. DOI: 10.1016/j.jenvman.2023.119329
- Hellman M., Hubalek V., Juhanson J. et al. Substrate type determines microbial activity and community composition in bioreactors for nitrate removal by denitrification at low temperature // Science of the Total Environment. 2021. Vol. 755. Part 1. № 143023. DOI: 10.1016/j.scitotenv.2020.143023
- Goyburo-Chávez C., Mendez-Ruiz J.I., Jiménez-Oyola S. et al. Pilot-scale reverse osmosis treatment of gold cyanidation effluent for the removal of cyanide, heavy metal(loid)s, and ionic species // Case Studies in Chemical and Environmental Engineering. 2024. Vol. 9. № 100688. DOI: 10.1016/j.cscee.2024.100688
- Samaei S.M., Gato-Trinidad S., Altaee A. Performance evaluation of reverse osmosis process in the post-treatment of mining wastewaters: Case study of Costerfield mining operations, Victoria, Australia // Journal of Water Process Engineering. 2020. Vol. 34. № 101116. DOI: 10.1016/j.jwpe.2019.101116
- Grossi L.B., Magalhães N.C., Araújo B.M. et al. Water conservation in mining industry by integrating pressure-oriented membrane processes for nitrogen-contaminated wastewater treatment: Bench and pilot-scale studies // Journal of Environmental Chemical Engineering. 2021. Vol. 9. Iss. 1. № 104779. DOI: 10.1016/j.jece.2020.104779
- Bing Wang, Chunyang Gao, Xingchun Li et al. Remediation of groundwater pollution by in situ reactive zone: A review // Process Safety and Environmental Protection. 2022. Vol. 168. P. 858-871. DOI: 10.1016/j.psep.2022.10.046
- Sakr M., El Agamawi H., Klammler H., Mohamed M.M. A review on the use of permeable reactive barriers as an effective technique for groundwater remediation // Groundwater for Sustainable Development. 2023. Vol. 21. № 100914. DOI: 10.1016/j.gsd.2023.100914
- Yangmin Ren, Mingcan Cui, Yongyue Zhou et al. Zero-valent iron based materials selection for permeable reactive barrier using machine learning // Journal of Hazardous Materials. 2023. Vol. 453. № 131349. DOI: 10.1016/j.jhazmat.2023.131349
- Singh R., Chakma S., Birke V. Performance of field-scale permeable reactive barriers: An overview on potentials and possible implications for in-situ groundwater remediation applications // Science of the Total Environment. 2023. Vol. 858. Part 1. № 158838. DOI: 10.1016/j.scitotenv.2022.158838
- Kumarasinghe U., Kawamoto K., Saito T. et al. Evaluation of applicability of filling materials in permeable reactive barrier (PRB) system to remediate groundwater contaminated with Cd and Pb at open solid waste dump sites // Process Safety and Environmental Protection. 2018. Vol. 120. P. 118-127. DOI: 10.1016/j.psep.2018.09.003
- Suzuki T., Moribe M., Oyama Y., Niinae M. Mechanism of nitrate reduction by zero-valent iron: Equilibrium and kinetics studies // Chemical Engineering Journal. 2012. Vol. 183. P. 271-277. DOI: 10.1016/j.cej.2011.12.074
- Yiping Zhang, Douglas G.B., Long Pu et al. Zero-valent iron-facilitated reduction of nitrate: Chemical kinetics and reaction pathways // Science of the Total Environment. 2017. Vol. 598. P. 1140-1150. DOI: 10.1016/j.scitotenv.2017.04.071
- Marcos-Hernández M., Cerrón-Calle G.A., Ge Y. et al. Effect of surface functionalization of Fe3O4 nano-enabled electrodes on the electrochemical reduction of nitrate // Separation and Purification Technology. 2022. Vol. 282. Part A. № 119771. DOI: 10.1016/j.seppur.2021.119771
- Глушанкова И.С., Бессонова Е.Н., Блинов С.М. и др. Очистка карьерных вод горнорудных предприятий от азотсодержащих соединений с использованием редокс-барьеров // Горный информационно-аналитический бюллетень (научно-технический журнал). 2021. № 10. С. 58-68. DOI: 10.25018/0236_1493_2021_10_0_58
- Панасюгин А.С., Теран А.И., Григорьев С.В. и др. Совместное извлечение нитрат-ионов и ионов железа фильтрующим материалом, полученным на основе сталеплавильного шлака // Литье и металлургия. 2018. № 4 (93). С. 32-37. DOI: 10.21122/1683-6065-2018-4-32-37
- Jinghui Zhang, Zhiwei Hao, Zhen Zhang et al. Kinetics of nitrate reductive denitrification by nanoscale zero-valent iron // Process Safety and Environmental Protection. 2010. Vol. 88. Iss. 6. P. 439-445. DOI: 10.1016/j.psep.2010.06.002
- Fang Zhao, Jia Xin, Mengjiao Yuan et al. A critical review of existing mechanisms and strategies to enhance N2 selectivity in groundwater nitrate reduction // Water Research. 2022. Vol. 209. № 117889. DOI: 10.1016/j.watres.2021.117889
- Zhenwei Liu, Shangshang Dong, Di Zou et al. Electrochemically mediated nitrate reduction on nanoconfined zerovalent iron: Properties and mechanism // Water Research. 2020. Vol. 173. № 115596. DOI: 10.1016/j.watres.2020.115596
- Bartzas G., Komnitsas K. Solid phase studies and geochemical modelling of low-cost permeable reactive barriers // Journal of Hazardous Materials. 2010. Vol. 183. Iss. 1-3. P. 301-308. DOI: 10.1016/j.jhazmat.2010.07.024
