Применение модели UNIFAC в расчете физико-химических свойств экотоксикантов для технологических и экоаналитических целей
- 1 — д-р хим. наук научный руководитель проекта аппарата управления научного центра «Оценка техногенной трансформации экосистем» Санкт-Петербургский горный университет ▪ Orcid
- 2 — аспирант Санкт-Петербургский горный университет ▪ Orcid
Аннотация
Современный вектор развития экологического мониторинга ведет к развитию аналитических методов качественного и количественного анализа различных экотоксикантов. Многие исследования сталкиваются с отсутствием информации об изомерах и гомологах уже изученных соединений. Данную проблему не всегда можно решить экспериментально из-за сложности выделения или синтеза некоторых соединений, частично поможет использование групповых теорий растворов, с их помощью для экотоксикантов рассчитывают растворимость в воде или коэффициент распределения между двумя несмешивающимися растворителями. Эти параметры имеют важное значение в аналитических и экологических задачах. Коэффициент распределения в системе октанол – вода связан с возможностью накапливания различных соединений в живых организмах, коэффициент распределения в системе гексан – ацетонитрил может быть использован в газово-хроматографическом анализе. Растворимость в воде тесно связана с накоплением экотоксикантов в водоемах, а также их возможностью к переносу. В данной работе представлены возможности модели UNIFAC для решения физико-химических задач на примере расчета свойств реальных экотоксикантов по доступным термодинамическим данным. Все полученные расчетные значения были сравнены с определенными экспериментально. В случае производных пирена данные по растворимости были получены впервые, с использованием корреляционной групповой модели для расчета теплоты и температуры плавления.
Введение
Определение физико-химических свойств экотоксикантов представляет собой важную задачу с точки зрения экологии и физической химии. К числу подобных свойств можно отнести коэффициент распределения вещества между двумя несмешивающимися растворителями, растворимость в воде, коэффициент распределения октанол – вода. Информация о коэффициентах распределения в двухфазных системах растворителей может использоваться при пробоподготовке для экстракции и последующего анализа токсичных соединений [1, 2]. Коэффициент распределения октанол – вода имеет особое значение, так как его связывают со способностью веществ проникать сквозь органические мембраны [3]. Растворимость в воде тесно связана со способностью вещества накапливаться в водоемах, а также проникать в грунтовые воды [4]. Все эти физико-химические свойства изучены только для небольшого перечня экотоксикантов, так как некоторые вещества либо крайне трудно выделить в чистом виде, либо они еще не были синтезированы. Имеется большое число изомеров и гомологов для экотоксикантов, которые также являются токсичными [5, 6]. Актуальной проблемой является разработка методов предсказания физико-химических свойств отдельных соединений, исходя из их предполагаемой структуры.
Наиболее распространенными методами предсказания свойств химических соединений являются методы группового подхода. В них молекулы разбиваются на отдельные фрагменты, чаще всего функциональные группы. Наиболее активно используемой моделью, реализующей данный подход, является модель UNIFAC [7]. Она позволяет рассчитывать коэффициенты активности отдельных компонентов в составе сложной смеси за счет их разбиения на отдельные фрагменты. Для органических молекул такой подход является эффективным в силу того, что они построены из ограниченного набора функциональных групп. Набор из групп CH3, CH2, СН, С и OH позволяет сконструировать любой алкан, циклоалкан или алифатический спирт, включая многоатомный. Например, н-гексан (СН3-(СН2)4-СН3) состоит из двух групп СН3 и четырех групп СН2. Этанол содержит одну группу СН3, одну СН2 и одну ОН. Добавляя группу для простых эфиров (С-О-С) и для сложных (СООС), получаем возможность строить молекулы не только простых и сложных эфиров, но и гидроксиэфиров. Для рассмотрения аминов вводится группа NH2, а для ароматических соединений вводятся две группы ароматического углерода – АСН – ароматический углерод с атомом водорода и АС – ароматический углерод без атома водорода.
Некоторые вещества (CH3OH, H2O, CH3CN) выделяются в отдельные группы. Обычно это родоначальники гомологических рядов или вещества, которые по своим свойствам резко отличаются от свойств типичных органических веществ. Возможность расчета коэффициентов активности компонентов в составе смеси позволяет рассчитывать большое количество физико-химических свойств, используя уравнения химической термодинамики. Используя закон Рауля, можно описать равновесие жидкость – пар, которое применяется при моделировании ректификации, перегонки и испарения [8, 9]. Уравнение Шредера позволяет описывать растворимость в смешанных растворителях [10]. В модели UNIFAC коэффициент активности разбивается на две составляющие:
где γ – коэффициент активности; γcomb – комбинаторный вклад в коэффициент активности; lnγres – остаточный вклад в коэффициент активности.
Комбинаторный вклад учитывает разницу в форме молекул. Остаточный вклад связан с энергетическими взаимодействиями между молекулами в растворе. Явное присутствие комбинаторного вклада позволяет описывать свойства растворов полимеров и макромолекул [11]. На практике все необходимые для модели параметры определяются путем регрессии экспериментальных данных по равновесию жидкость – пар, жидкость – жидкость и растворимости. Такой подход к описанию свойств многокомпонентных систем можно эффективно использовать в задачах экологического мониторинга и химического анализа, далее покажем это на примере расчета растворимости и коэффициентов распределения.
Методы
Хроматографический анализ
Хроматографические измерения проводились на хромато-масс-спектрометре Shimadzu GC-QP2010SE, оборудованном колонкой RTX-5MS (30 м×0,25 мм×0,25 мкм) фирмы Restek. Хроматограф работал в режиме постоянной скорости потока (1,03 мл/мин). В качестве газа-носителя выступал гелий. Температура испарителя 250 °С. Объем вводимой пробы 1 мкл, сброс 20:1. Программа печи состояла из начальной изотермы 50 °С (в течение 10 мин), затем температура повышалась до 290 °С со скоростью 10 °С/мин и удерживалась в течение 10 мин. Температура ионного источника масс-детектора равнялась 200 °С, температура интерфейса 290 °С. Диапазон сканирования масс был выбран 45-500 m/z с длительностью съемки 0,3 с.
Расчет растворимости по модели UNIFAC
Если постепенно изменять мольную долю компонента в растворе от нуля до единицы, то можно найти точку равенства обеих частей (если она вообще существует). Плавному изменению состава растворителя будет отвечать плавное изменение мольной доли асфальтена. Таким образом можно построить изотерму растворимости с использованием уравнения Шредера:
где ΔHf – теплота плавления вещества; T – температура системы; Tf – температура плавления вещества; R – универсальная газовая постоянная; ха – мольная доля.
Расчет компонента асфальтена в одном растворителе проводился методом дихотомии (делением отрезка пополам). В каждой расчетной точке вычислялся коэффициент активности асфальтена по модели UNIFAC, после чего рассчитывалась ошибка по формуле (2). Расчет продолжался до тех пор, пока ошибка не становилась меньше 10–20. При расчете растворимости в двух растворителях в качестве первой точки принималась растворимость в одной из двухфазных систем (при отсутствии третьего компонента). Затем происходило движение вдоль линии растворимости при помощи метода доверительного интервала. Точность расчетов контролировалась при помощи ошибки расчета.
Обсуждение результатов
Групповой подход при расчете коэффициентов распределения для экоаналитических целей
В газовом хромато-масс-спектрометрическом (GCMS) анализе часто встречаются ситуации, когда некоторые аналиты отсутствуют в базах данных, что либо полностью исключает их идентификацию, либо приводит к ошибочной идентификации. Особенно остро эта проблема стоит в аналитических исследованиях [12, 13] и при разработке современных технологий [14-16]. В этом случае для множества известных экотоксикантов можно предложить несколько гомологов или изомеров, которые будут обладать не менее токсичными свойствами, но при этом отсутствовать в базах данных. Например, в базе данных масс-спектров NIST MS 2018 отсутствуют масс-спектры любых тетраметилпиренов C20H18, хотя всего веществ с такой брутто-формулой в базе имеется 16. Эти 16 спектров вполне могут стать источником ложной идентификации, если в анализируемой пробе имеется именно тетраметилпирен. При этом есть исследования токсичности пирена [17], а токсичность его гомологов не изучалась. Если в качестве примера взять крайне токсичный 2,3,7,8-тетрахлородибензодиоксин [18], то для него нет масс-спектров даже монометилпроизводного при наличии всего двух других веществ с той же брутто-формулой. Из-за недостатка информации любые исследования токсичности подобных гомологов и изомеров столкнутся со сложностью их идентификации в сложных матрицах [19]. По этой причине остро стоит вопрос идентификации неизученных соединений, а также повышения достоверности идентификации уже изученных.
На практике можно использовать дополнительные идентификационные признаки, помимо масс-спектра. При идентификации на капиллярных колонках используются индексы удерживания [20], позволяющие из перечня веществ с похожими масс-спектрами исключить недостоверные для данного времени выхода варианты идентификации. Можно варьировать энергию ионизации (в масс-спектрометрии электронного удара варьируют энергию электронов в ионном источнике). Иногда это позволяет надежно определить брутто-формулу и даже сделать обоснованные предположения о структуре аналита [21]. Но это значительно усложняет анализ и плохо работает с веществами со слабой интенсивностью молекулярного иона в спектре.
Еще в середине 1960-х годов в качестве дополнительного структурно-зависимого параметра для уточнения строения молекул при газово-хроматографическом (ГХ) анализе было предложено использовать коэффициент распределения Kр вещества между двумя несмешивающимися фазами [22]. Такой коэффициент (концентрационная константа распределения) есть отношение равновесных концентраций вещества, распределенного между двумя жидкими фазами. В качестве примеров таких фаз можно указать на системы растворителей вода – октанол, гексан – этиленгликоль. При распределении полярные вещества будут преимущественно концентрироваться в более полярном растворителе, а неполярные в менее полярном. Если взять смесь метанола и гептана и распределить их между этиленгликолем и гексаном, то в этиленгликоле соберется метанол, а в гексане – гептан. Если выполнить ГХ-анализ каждой фазы отдельно, то при равных объемах, вводимых в испаритель хроматографа проб, коэффициент распределения метанола можно рассчитать как отношение площадей пиков метанола в гексановой и этиленгликолевой фазах:
где Sгексан – площадь пика компонента в гексановой фазе; Sэг – площадь пика компонента в этиленгликолевой фазе.
С одной стороны, это усложняет анализ, так как теперь необходимо получать две хроматограммы вместо одной. Однако это позволяет решить несколько проблем. Во-первых, каждая из двух хроматограмм получается проще за счет того, что не все компоненты пробы оказываются в исследуемой фазе. Во-вторых, сравнивая рассчитанный коэффициент распределения неизвестного аналита с известными значениями, можно использовать его как дополнительный идентификационный признак. Так как коэффициент распределения не зависит линейно от индекса удерживания (который также рассчитывается из хроматограммы), в результате имеются два независимых идентификационных признака. В случае использования масс-спектрометрического детектора возможно определить три независимых идентификационных признака для каждого аналита. Данная методология успешно применялась до начала 1990 г. [23]. За это время был предложен ряд важных усовершенствований. Был расширен перечень используемых систем растворителей. В первую очередь это связано с использованием системы гексан – ацетонитрил, которая начала активно применяться в анализе эфирных масел и нефтепродуктов [24]. В работе [25] был предложен метод измерения величины Kр с использованием внутреннего стандарта. В качестве стандарта брали вещество с известным коэффициентом распределения. Тогда формула (3) для пары растворителей гексан – этиленгликоль преобразуется к виду
где Kст – коэффициент распределения стандарта; – площадь пика стандарта в гексановой фазе; – площадь пика стандарта в этиленгликолевой фазе.
Данная модификация позволяет избежать ошибок, связанных с неточным дозированием пробы в испаритель хроматографа. Также появились эмпирические формулы для расчета Kр веществ по их известным физико-химическим свойствам, таким как молекулярная масса, температура кипения, количество атомов углерода в молекуле [26]. Наиболее активно используемой в аналитической практике является модель LSER [27, 28], которая позволяет с достаточно высокой точностью рассчитывать коэффициенты распределения в заранее изученных системах растворителей. Это позволило применять указанный метод не только для подтверждения результатов идентификации, но и для проверки предположений о структуре молекул аналита. Однако, намного эффективнее оказался подход, когда хромато-распределительный метод соединили с групповыми теориями растворов [29], что обусловлено возможностью работы с системами растворителей переменного состава. Групповые теории растворов позволяют оценивать коэффициенты распределения для неизученных соединений.
Расчет коэффициентов активности групп, а затем и отдельных молекул, достаточно сложен, но его результат может быть легко применен к расчету величины Kp. Для примера рассмотрим систему из фаз α и β. Для двухфазного равновесия активности любого компонента i, распределенного между фазами, равны друг другу. Термодинамическая активность ai равна произведению коэффициента активности γi на мольную долю компонента xi при условии нормировки на чистое вещество. Под нормировкой понимают выбор состава, при котором коэффициент активности принимается равным единице. Теперь можно записать условие термодинамического равновесия фаз:
где α и β – принадлежность характеристик к фазам α и β.
После преобразований получаем:
Величина Kx есть отношение мольных долей компонента в сосуществующих фазах и отличается от величины Kp только простым множителем, равным отношению молярных объемов тех же фаз,
где Vα и Vβ – молярные объемы фаз α и β.
Используя уравнения (5)-(7) для любой органической молекулы, которую можно построить из известных групп с известными параметрами, можно рассчитать коэффициент распределения. Затем расчетное значение можно сравнить с измеренным и проверить предположения о структуре аналита. Оказывается, коэффициент распределения является весьма чувствительным к структуре параметром. Так для 3-карена и α-терпинена (общая формула C10H16, оба являются компонентами эфирного масла хвойных растений) индексы удерживания Ковача равны 1011 и 1018 [30]. Масс-спектр этих веществ состоит из ионных серий с основными массами 41-43; 77-79; 93; 121 и 136. В условиях рутинного ГХ-МС-анализа на 30-метровой колонке разнице индексов удерживания 100 единиц отвечает 1-2 мин времени, т.е. разница во времени выхода этих веществ составляет от 3 до 6 с. Этого недостаточно для надежного различения веществ. Однако ситуация меняется при учете коэффициентов распределения. Для системы гексан – ацетонитрил величины Kр равны 6,7 и 4,3 для 3-карена и α-терпинена соответственно [23]. Расчеты по UNIFAC дают значения 7,5 и 4,4, что крайне близко к экспериментальным значениям. Важно отметить, что при любом наборе данных коэффициент распределения для 3-карена в 1,55-1,7 раза выше, чем для α-терпинена. Это вполне доступная для измерения разница и, следовательно, вещества можно различить.
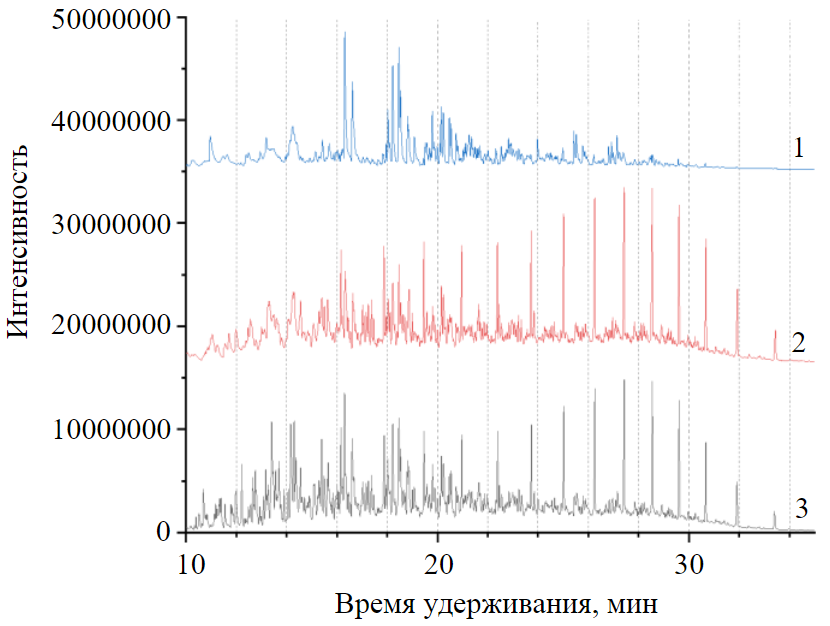
Рис.1. Общий вид хроматограмм равновесных растворов дизельного топлива в ацетонитриле (1); гексане (2) и исходного дизельного топлива (3). Хроматограммы смещены друг от друга на константу без искажения высот пиков
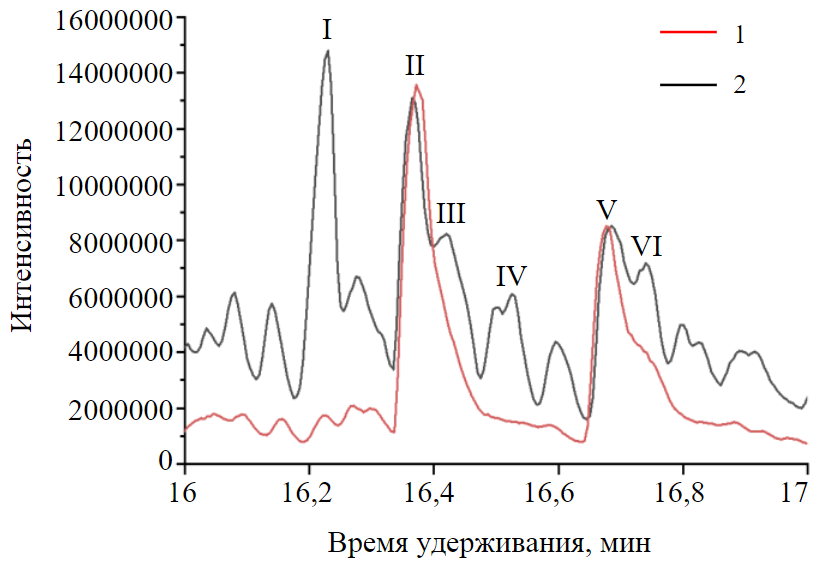
Рис.2. Участок хроматограмм, представленных на рис.1, в интервале времени выхода 16-17 мин 1 – гексановый экстракт; 2 – ацетонитриловый экстракт
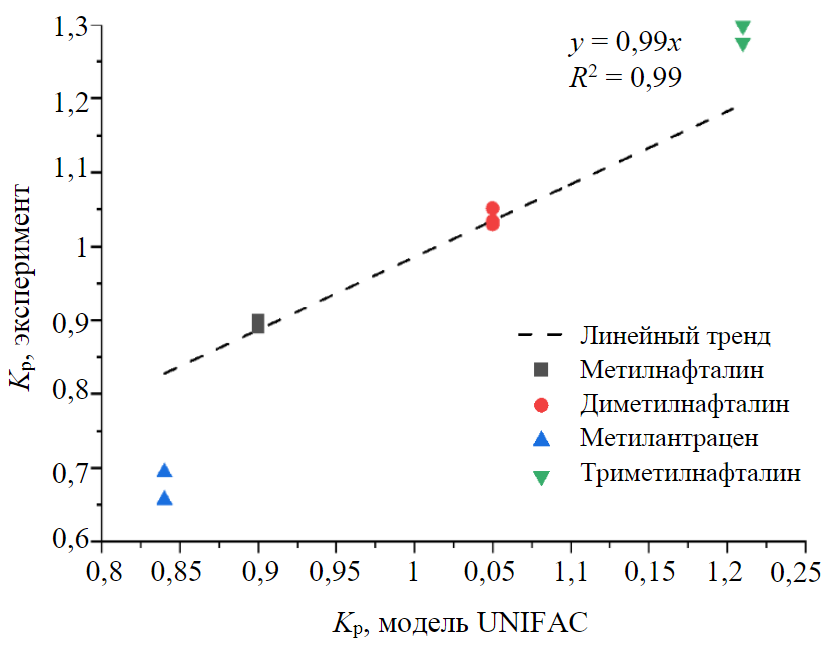
Рис.3. Расчетные и экспериментальные значения коэффициентов распределения некоторых компонентов дизельного топлива
Одним из примеров использования данного подхода является идентификация полиароматических соединений в среднедистиллятных нефтепродуктах. На рис.1 проиллюстрированы возможности хромато-распределительного метода. В качестве объекта был взят образец коммерческого дизельного топлива. Шесть самых больших пиков в центре хроматограммы (1) – это моно-, ди- и триметилнафталины. Большие пики в правой части хроматограммы (2) гексановой фазы – это н-алканы С14-С22. Если бы межфазного распределения не было, то наблюдалась бы хроматограмма (3), полученная суммированием линий 1 и 2 (исходное топливо). Видно, что в этом случае многие пики просто перекрывали бы друг друга.
На рис.2 показан участок хроматограммы гексановой и ацетонитрильной фаз. На хроматограмме ацетонитрильного экстракта можно обнаружить два больших пика, в то время как в гексановой фазе их находится больше. Пик I представляет собой н-алкан, пики III и IV являются алканами изомерного строения, пики II и V – это изомеры метилнафталина, пик VI – алкилпроизводное бензола с длинным радикалом. Здесь можно отчетливо проследить тенденцию неароматических соединений концентрироваться в гексановой фазе, что позволяет анализировать их отдельно и рассчитывать коэффициент распределения в качестве дополнительного идентификационного признака. Помимо идентификации ароматических соединений, данный подход может быть полезен и в изучении других компонентов топлив [31].
На рис.3 показана степень корреляции между расчетными и экспериментальными значениями коэффициентов распределения метилнафталинов и антрацена. Можно видеть, что модельные расчеты хорошо коррелируют с экспериментальными данными. Это позволяет использовать рассчитанные по модели UNIFAC коэффициенты распределения в качестве дополнительного идентификационного признака. Подобным образом удается идентифицировать различные полиароматические и гетероциклические соединения: метилпроизводные нафталина, антрацена, флуорена, бифенила, тетрагидронафталина, дибензотиофена, дибензофурана, карбазола [29].
Групповой подход при расчете растворимости экотоксикантов в воде и углеводородах
Если в масс-спектрометрии использование коэффициентов распределения носит вспомогательный характер, то при моделировании природных и технологических процессов эти величины входят в перечень основных. Одним из важнейших показателей любого экотоксиканта является его растворимость в воде. Однако, если вещество отсутствует в базе данных и не выделено в виде чистого соединения, то единственным способом оценки растворимости является ее расчет. Даже при наличии данных растворимости есть вероятность экспериментальной ошибки, вызванной тем, что растворимость многих экотоксикантов в воде очень низкая (10-100 мкг/л). Модель UNIFAC позволяет рассчитать растворимость таких веществ, для этого необходимо учесть эффекты плавления исследуемого вещества. Практически такой учет производится с использованием уравнения Шредера. Поскольку температуры плавления многих важных экотоксикантов намного выше 0 °С, при расчете их растворимости в воде надо учитывать только теплоту и температуру плавления экотоксиканта. Согласно уравнению Шредера в этом случае рассчитанная по модели UNIFAC активность экотоксиканта в растворе, находящемся в равновесии с твердым экотоксикантом, связана с теплотой и температурой плавления вещества следующей формулой:
Видно, что правая часть формулы (8) не зависит от состава раствора. Это значит, что ее можно рассматривать как постоянный множитель при расчете полного коэффициента активности экотоксиканта:
При подобном расчете растворимости основной сложностью может являться отсутствие информации о теплоте и температуре плавления экотоксиканта. Однако возможно рассчитать эти величины с использованием методов группового вклада [32]. В таких методах некоторое физическое свойство вещества оценивается как линейная комбинация вкладов отдельных молекулярных групп. Например, для теплоты плавления уравнение будет выглядеть следующим образом:
где Ni, Mj, Oi – количества групп первого, второго и третьего порядка в молекуле; Hfus,1, Hfus,2, Hfus,3 – вклад каждой группы в теплоту плавления; Hfus,0 – константное значение.
Группы первого порядка представляют собой простейшие функциональные группы. Например, метильная (CH3), гидроксо (ОН) или ароматическая с водородом (АСН). Группы второго и третьего порядков являются комбинациями простых групп, их учет необходим для коррекции получаемых значений с учетом взаимного влияния близкорасположенных групп или формы молекулы. Молекула пирена в таком расчете будет состоять из 16 групп первого порядка (6 AC и 10 ACH) и 4-х групп третьего порядка (два сопряжения ароматических колец по типу феналена и два сопряжения ароматических колец по типу фенантрена). Рассчитанное таким образом значение составляет 421 К, что крайне близко к экспериментально определенному значению 424 К [33].
В табл.1 представлены результаты расчетов растворимости нескольких важных экотоксикантов и их гомологов. Можно видеть, что расхождения расчетных значений с экспериментальными составляют один порядок. В случае метил- и этилпирена значения были получены с использованием расчетной теплоты плавления. Хотя расхождение в один порядок и является значительным для аналитической практики, в случае оценки растворимости подобной точности будет достаточно. При работе с неизученными веществами подобный прикидочный расчет является по сути единственным методом определения растворимости экотоксикантов в смешанных системах растворителей.
Таблица 1
Примеры расчета растворимости экотоксиканов по модели UNIFAC (уравнение (8)
|
Вещество |
Формула |
Равновесная мольная доля |
Теплота плавления, Дж/моль |
Растворимость, мг/л |
Экспериментальная растворимость, мг/л |
|
ДДТ, 1,1,1-трихлор-2,2-бис(4-хлорфенил)этан |
C14H9Cl5 |
9,60·10–9 |
26280 [34] |
1,9·10–1 |
2,5·10–2 [35] |
|
ДДЭ, 1,1-дихлор-2,2-бис(п-хлорфенил)этилен |
C14H8Cl4 |
1,00·10–7 |
23550 [36] |
1,8 |
1,2·10–1 [35] |
|
Гексахлорэтан |
C2Cl6 |
3,10·10–6 |
9750 [33] |
4,1·101 |
1,1·102 [37] |
|
Гексахлоран |
C6H6Cl6 |
3,1·10–8 |
25930 [38] |
5,0·10–1 |
7,3 [39] |
|
Бензпирен |
C20H12 |
4,70·10–11 |
14700 [34] |
6,6·10–4 |
3,8·10–3 [37] |
|
Пирен |
C16H10 |
2,50·10–9 |
16700 [33] |
2,8·10–2 |
1,3·10–1 [37] |
|
Метилпирен |
C17H12 |
1,60·10–9 |
18283* |
1,9·101 |
Нет данных |
|
Этилпирен |
C18H14 |
1,30·10–9 |
17922* |
1,7·101 |
Нет данных |
*Значения получены по формуле (10).
Групповые модели растворов применяются для решения экологических и технологических задач при расчете диаграмм растворимости углеводородных смесей. Сам по себе такой расчет являлся бы стандартной физико-химической задачей, если бы исследователи располагали исчерпывающими данными о физико-химических свойствах компонентов. Но на практике исследователи сталкиваются с недостатком информации о рассматриваемой системе [40]. При приготовлении топлива для судовых двигателей часто в него вводят добавку мазута или другие остаточные продукты глубокой переработки нефти (гудрон, висбрекинг-остаток). Поскольку растворимость высокомолекулярных нелетучих продуктов в топливах на основе н-алканов невелика, то для ее увеличения в топливо приходится добавлять дизельную фракцию с высоким содержанием ароматических соединений. Полученное топливо должно обладать стабильностью и при этом удовлетворять ряду экологических и экономических требований [41]. Среди экологических требований одним из важнейших является низкое содержание серы в топливе (менее 0,5 мас.% по требованиям Международной морской организации). Эту величину легко рассчитать, если известны содержание серы в остаточном продукте (содержание серы в исходных летучих дизельных фракциях намного ниже и им обычно можно пренебречь) и концентрация остаточного продукта. Растворимость в смеси алканов и замещенных аренов зависит от их соотношения и ее нужно определять экспериментально. Ситуация осложняется тем, что такие растворы обычно имеют темный цвет и со временем могут давать осадки. По этой причине расчет растворимости подобных соединений представляет собой важную экологическую задачу, которую также можно решить при помощи групповых моделей.
Молекулярный и групповой состав алканово-ареновой смеси можно установить по данным ГХ-МС-анализа. Если известен групповой и молекулярный состав остаточного продукта, то можно рассчитать его растворимость по формуле Шредера. Проблема в том, что остаточные продукты тоже многокомпонентны и в их составе принято выделять четыре основных класса соединений: парафины, ароматические соединения, смолы и асфальтены. В основе этой классификации лежит SARA-анализ. Он представляет собой процедуру последовательного выделения четырех перечисленных фракций при помощи набора растворителей. В осадок из остаточного топлива первыми выпадают асфальтены, следовательно, остальные компоненты только вносят вклад в изменение состава растворителя. Чтобы корректно учесть эти изменения, было предложено использовать средние молекулярные массы каждой из перечисленных групп и результаты спектроскопии инфракрасной (ИК) и ядерного магнитного резонанса (ЯМР). Молекулярная масса при этом может определяться методом криоскопии или по давлению паров растворителя.
На этапе выбора растворителя для криоскопии расчеты по модели UNIFAC весьма полезны. Модель UNIFAC позволяет выбрать такой растворитель, раствор вещества в котором будет близок к идеальному, для асфальтенов это оказался бензол. Помимо средней молекулярной массы, для расчетов нужен элементный состав (или эквивалентная ему средняя брутто-формула моделируемого соединения), а также спектры ИК или ЯМР, которые позволяют установить состав функциональных групп, имеющихся в соединении. На основе этих данных можно получить групповой состав средней молекулы асфальтена или углеводородной смеси. В качестве примера в табл.2 представлен групповой состав асфальтенов различного состава в диапазоне молекулярных масс 617-1574 г/моль. Расчет группового состава проводился исходя из того, что в молекуле асфальтена присутствуют только группы AC, ACH, CH2 и CH3. Таким образом, если брутто-формула асфальтена имела вид CNHM, то количество групп рассчитывалось при помощи системы уравнений
где N(AC), N(ACH) и N(CH2) – количество групп UNIFAC, входящих в состав одной молекулы асфальтена (количество групп СН3 принято равным единице); k – отношение количества групп АСН к количеству групп АС.
Таблица 2
Данные о составе и молекулярной массе различных асфальтенов [42]
|
Параметр |
Образец 1 |
Образец 2 |
Образец 3 |
|
Mw, г/моль |
617 |
1135 |
1574 |
|
C, мас.% |
89,18 |
86,14 |
87,65 |
|
H, мас.% |
5,68 |
6,39 |
6,5 |
|
S, мас.% |
2,45 |
5,5 |
3,22 |
|
AC |
20,9 |
33,1 |
46,5 |
|
ACH |
15,9 |
25,3 |
35,6 |
|
CH2 |
8,1 |
22,1 |
31,9 |
|
CH3 |
1 |
1 |
1 |
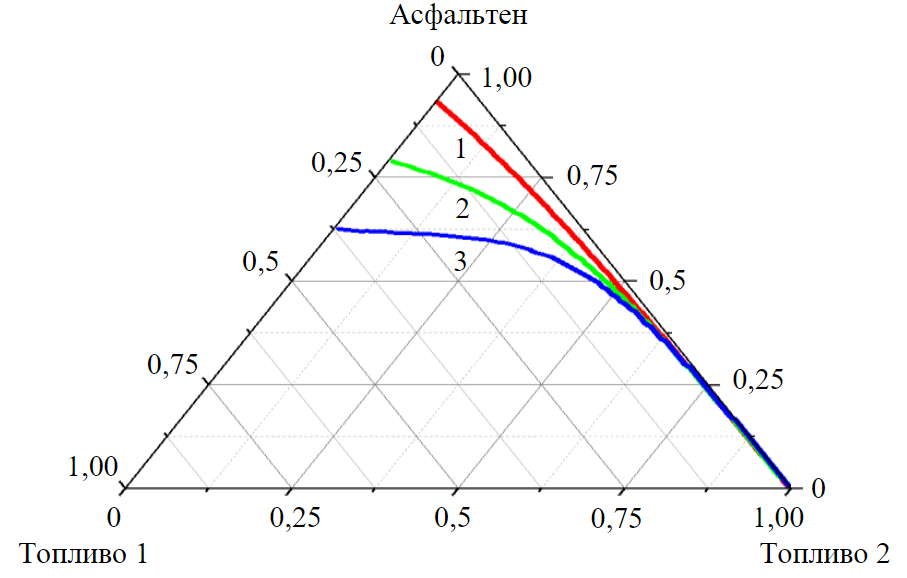
Рис.4. Расчетные изотермы растворимости асфальтенов (1-3) из табл.2 при температуре 373 К
Параметр k можно оценить по данным ЯМР-спектроскопии или взять за образец одно из известных полиароматических соединений. Так, для бензпирена k = 11/8 = 1,375. Такие расчеты можно проводить даже с неокругленными до целых чисел N и M и не округлять полученные значения N(AC) и пр. В качестве иллюстрации данного метода на рис.4 представлены изотермы растворимости асфальтенов с характеристиками из табл.2 в смесях двух дизельных фракций. Фракция 1 состоит преимущественно из алканов и изоалканов (98 мас.%), а фракция 2 из ароматических соединений (75 мас.%). Как можно заметить по результатам расчета, асфальтены лучше растворяются в высокоароматизированных фракциях, также с ростом молекулярной массы растворимость в алкановых фракциях значительно снижается.
Заключение
Приведенные примеры не исчерпывают область применения групповых теорий растворов для решения технологических и экоаналитических задач. Эффективность такого применения зависит от доступности и надежности физико-химических характеристик исследуемых веществ. Эти характеристики можно определять как экспериментально, так и используя различные корреляционные зависимости. В данной работе было продемонстрировано, что модель UNIFAC может давать удовлетворительные результаты при расчете растворимости экотоксикантов в воде, а также использоваться в оценке коэффициентов распределения в двухфазных системах.
Литература
- Пономарева М.А., Черемисина О.В., Машукова Ю.А., Лукьянцева Е.С. Повышение эффективности извлечения РЗМ из технологических растворов в процессе переработки апатитового сырья // Записки Горного института. 2021. Т. 252. С. 917-926. DOI: 10.31897/PMI.2021.6.13
- Судариков С.М., Юнгмейстер Д.А., Королев Р.И., Петров В.А. О возможности уменьшения техногенной нагрузки на придонные биоценозы при добыче твердых полезных ископаемых с использованием технических средств различной модификации // Записки Горного института. 2022. Т. 253. С. 82-96. DOI: 10.31897/PMI.2022.14
- Cumming H., Rücker C. Octanol-Water Partition Coefficient Measurement by a Simple 1H NMR Method // ACS Omega. 2017. Vol. 2. № 9. P. 6244-6249. DOI: 10.1021/acsomega.7b01102
- Roy D.N., Goswami R., Pal A. The insect repellents: A silent environmental chemical toxicant to the health // Environmental Toxicology and Pharmacology. 2017. Vol. 50. P. 91-102. DOI: 10.1016/j.etap.2017.01.019
- Gonçalves N.P.F., Vargaet Z., Nicol E. et al. Comparison of Advanced Oxidation Processes for the Degradation of Maprotiline in Water-Kinetics, Degradation Products and Potential Ecotoxicity // Catalysts. 2021. Vol. 11. Iss. 2. № 240. DOI: 10.3390/CATAL11020240
- Пашкевич М.А., Харько П.А. Применение композитной смеси для очистки кислых дренажных вод хвостового хозяйства от металлов // Обогащение руд. 2022. № 4. С. 40-47. DOI: 10.17580/or.2022.04.07
- Fredenslund A., Jones R.L., Prausnitz J.M. Group‐contribution estimation of activity coefficients in nonideal liquid mixtures // AIChE Journal. 1975. Vol. 21. № 6. P. 1086-1099. DOI: 10.1002/aic.690210607
- Rodriguez-Donis I., Gerbaud V., Joulia X. Thermodynamic Insights on the Feasibility of Homogeneous Batch Extractive Distillation. 4. Azeotropic Mixtures with Intermediate Boiling Entrainer // Industrial & Engineering Chemistry Research. 2012. Vol. 51. № 18. P. 6489-6501. DOI: 10.1021/ie2019432
- Seyf J.Y., Shojaeian A. Vapor-liquid (azeotropic systems) and liquid-liquid equilibrium calculations using UNIFAC and NRTL-SAC activity coefficient models // Fluid Phase Equilibria. 2019. Vol. 494. P. 33-44. DOI: 10.1016/J.FLUID.2019.04.029
- Coto B., Suárez I., Tenorio M.J., Huerga I. Extraction of aromatic and polyaromatic compounds with NMP: experimental and model description // Fluid Phase Equilibria. 2022. Vol. 554. № 113293. DOI: 10.1016/J.FLUID.2021.113293
- Pazuki G., Seyfi Kakhki S. A hybrid GMDH neural network to investigate partition coefficients of Penicillin G Acylase in polymer-salt aqueous two-phase systems // Journal of Molecular Liquids. 2013. Vol. 188. P. 131-135. DOI: 10.1016/j.molliq.2013.10.001
- Raupov I., Burkhanov R., Lutfullin A. et al. Experience in the Application of Hydrocarbon Optical Studies in Oil Field Development // Energies. 2022. Vol. 15. Iss. 10. № 3626. DOI: 10.3390/EN15103626
- Халифа А.А., Бажин В.Ю., Устинова Я.В., Шалаби М.Э. Изучение особенностей кинетики процесса получения окатышей из красного шлама в потоке водорода // Записки Горного института. 2022. Т. 254. С. 261-270. DOI: 10.31897/PMI.2022.18
- Kudinova A.A., Poltoratckaya M.E., Gabdulkhakov R.R. et al. Parameters influence establishment of the petroleum coke genesis on the structure and properties of a highly porous carbon material obtained by activation of KOH // Journal of Porous Materials. 2022. Vol. 29. Iss. 5. P. 1599-1616. DOI: 10.1007/S10934-022-01287-1
- Leusheva E., Alikhanov N., Morenov V. Barite-Free Muds for Drilling-in the Formations with Abnormally High Pressure // Fluids. 2022. Vol. 7. Iss. 8. № 268. DOI: 10.3390/FLUIDS7080268
- Sergeev V.V. Cheremisina O.V., Fedorov A.T. et al. Interaction Features of Sodium Oleate and Oxyethylated Phosphoric Acid Esters with the Apatite Surface // ACS Omega. 2022. Vol. 7. Iss. 3. P. 3016-3023. DOI: 10.1021/acsomega.1c06047
- Bielská L., Kah M., Sigmund G. et al. Bioavailability and toxicity of pyrene in soils upon biochar and compost addition // Science of The Total Environment. 2017. Vol. 595. P. 132-140. DOI: 10.1016/J.SCITOTENV.2017.03.230
- Mehrle P.M., Buckler D.R., Little E.E. et al. Toxicity and bioconcentration of 2,3,7,8-tetrachlorodibenzodioxin and 2,3,7,8-tetrachlorodibenzofuran in rainbow trout // Environmental Toxicology and Chemistry. 1988. Vol. 7. Iss. 1. P. 47-62. DOI: 10.1002/ETC.5620070108
- Пашкевич М.А., Быкова М.В. Методология термодесорбционной очистки локальных загрязнений почв от нефтепродуктов на объектах минерально-сырьевого комплекса // Записки Горного института. 2022. Т. 253. С. 49-60. DOI: 10.31897/PMI.2022.6
- Xiaoli Wei, Imhoi Koo, Seongho Kim, Xiang Zhang. Compound identification in GC-MS by simultaneously evaluating the mass spectrum and retention index // The Analyst. 2014. Vol. 139. Iss. 10. P. 2507-2514. DOI: 10.1039/C3AN02171H
- Alam M.S., Stark C., Harrison R.M. Using Variable Ionization Energy Time-of-Flight Mass Spectrometry with Comprehensive GC×GC to Identify Isomeric Species // Analytical Chemistry. 2016. Vol. 88. Iss. 8. P. 4211-4220. DOI: 10.1021/acs.analchem.5b03122
- Bowman M.C., Beroza M. Identification of Compounds by Extraction p-Values Using Gas Chromatography // Analytical Chemistry. 1966. Vol. 38. Iss. 11. P. 1544-1549. DOI: 10.1021/ac60243a022
- Isidorov V.A., Zenkevich I.G., Dubis E.N. et al. Group identification of essential oils components using partition coefficients in a hexane-acetonitrile system // Journal of Chromatography A. 1998. Vol. 814. Iss. 1-2. P. 253-260. DOI: 10.1016/S0021-9673(98)00398-7
- Tkachenko K.G., Zenkevich I.G. The Essential Oil of the Flowers of Heracleum antasiaticum Manden. Grown in Russia // Journal of Essential Oil Research. 1993. Vol. 5. Iss. 2. P. 227-228. DOI: 10.1080/10412905.1993.9698208
- Berezkin V.G., Pankov A.G., Loshchilova V.D. Combined partition-chromatographic methods // Chromatographia. 1976. Vol. 9. Iss. 10. P. 490-496. DOI: 10.1007/BF02282661
- Isidorov V.A., Kotowska U., Vinogorova V.T. GC Identification of Organic Compounds Based on Partition Coefficients of Their TMS Derivatives in a Hexane-Acetonitrile System and Retention Indices // Analytical Sciences. 2005. Vol. 21. Iss. 12. P. 1483-1489. DOI: 10.2116/analsci.21.1483
- Poole C.F. Partition constant database for totally organic biphasic systems // Journal of Chromatography A. 2017. Vol. 1527. P. 18-32. DOI: 10.1016/j.chroma.2017.10.061
- Poole C.F., Karunasekara T., Ariyasena T.C. Totally organic biphasic solvent systems for extraction and descriptor determinations // Journal of Separation Science. 2013. Vol. 36. Iss. 1. P. 96-109. DOI: 10.1002/jssc.201200709
- Efimov I., Povarov V.G., Rudko V.A. Comparison of UNIFAC and LSER Models for Calculating Partition Coefficients in the Hexane-Acetonitrile System Using Middle Distillate Petroleum Products as an Example // Industrial & Engineering Chemistry Research. 2022. Vol. 61. Iss. 27. P. 9575-9585. DOI: 10.1021/acs.iecr.2c01093
- Adams R.P., González-Elizondo M.S., González-Elizondo M., Slinkman E. DNA fingerprinting and terpenoid analysis of Juniperus blancoi var. huehuentensis (Cupressaceae), a new subalpine variety from Durango, Mexico // Biochemical Systematics and Ecology. 2006. Vol. 34. Iss. 3. P. 205-211. DOI: 10.1016/J.BSE.2005.11.004
- Rekhletskaya E.S., Ershov M.A., Savelenko V.D. et al. Unraveling the Superior Role of Characterizing Methyl Ester of Isohexene as an Innovative High-Octane Gasoline Mixing Component // Energy & Fuels. 2022. Vol. 36. Iss. 19. P. 11829-11838. DOI: 10.1021/acs.energyfuels.2c01973
- Marrero J., Gani R. Group-contribution based estimation of pure component properties // Fluid Phase Equilibria. 2001. Vol. 183-184. P. 183-208. DOI: 10.1016/S0378-3812(01)00431-9
- Domalski E.S., Hearing E.D. Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III // Journal of Physical and Chemical Reference Data. 1996. Vol. 25. Iss. 1. P. 1-525. DOI: 10.1063/1.555985
- Acree W.E. Thermodynamic properties of organic compounds: enthalpy of fusion and melting point temperature compilation // Thermochimica Acta. 1991. Vol. 189. Iss. 1. P. 37-56. DOI: 10.1016/0040-6031(91)87098-H
- Toxicological Profiles. ATSDR. URL: https://www.atsdr.cdc.gov/toxprofiledocs/index.html (дата обращения 02.11.2022).
- Donnelly J.R., Drewes L.A., Johnson R.L. et al. Purity and heat of fusion data for environmental standards as determined by differential scanning calorimetry // Thermochimica Acta. 1990. Vol. 167. Iss. 2. P. 155-187. DOI: 10.1016/0040-6031(90)80476-F
- IUPAC-NIST Solubility Database, Version 1.1. URL: https://srdata.nist.gov/solubility/ (дата обращения 30.05.2022). DOI: 10.18434/T4QC79
- Sabbah R., Xu Wu An. Enthalpies de fusion et de sublimation de l’isomère γ d’hexachlorocyclohexane // Thermochimica Acta. 1991. Vol. 178. P. 339-341. DOI: 10.1016/0040-6031(91)80326-E
- Richardson L.T., Miller D.M. Fungitoxicity of Chlorinated Hydrocarbon Insecticides in Relation to Water Solubility and Vapor Pressure // Canadian Journal of Botany. 1960. Vol. 38. № 2. P. 163-175. DOI: 10.1139/b60-015
- Рогачев М.К., Александров А.Н. Обоснование комплексной технологии предупреждения образования асфальтосмолопарафиновых отложений при добыче высокопарафинистой нефти погружными электроцентробежными насосами из многопластовых залежей // Записки Горного института. 2021. Т. 250. С. 596-605. DOI: 10.31897/PMI.2021.4.13
- Gabdulkhakov R.R., Rudko V.A., Pyagay I.N. Methods for modifying needle coke raw materials by introducing additives of various origin (review) // Fuel. 2022. Vol. 310. Part A. № 122265. DOI: 10.1016/J.FUEL.2021.122265
- Gauthier T., Danial-Fortain P., Merdrignac I. et al. Studies on the evolution of asphaltene structure during hydroconversion of petroleum residues // Catalysis Today. 2008. Vol. 130. Iss. 2-4. P. 429-438. DOI: 10.1016/j.cattod.2007.10.005
