Оценка возможности использования отходов железо-магниевого производства для очистки сточных вод от тяжелых металлов (Cd2+, Zn2+, Co2+, Cu2+)
- 1 — канд. техн. наук заведующий лабораторией Институт горного дела УрО РАН ▪ Orcid
- 2 — научный сотрудник Институт горного дела УрО РАН ▪ Orcid
- 3 — младший научный сотрудник Институт горного дела УрО РАН ▪ Orcid
- 4 — младший научный сотрудник Институт горного дела УрО РАН ▪ Orcid
Аннотация
Рассмотрены актуальные проблемы, связанные с очисткой сточных промышленных вод от ионов тяжелых металлов. В связи с развитием промышленности возрастает количество образующихся сточных вод и риски попадания в поверхностные и подземные воды тяжелых металлов, которые, накапливаясь в водных объектах, становятся агрессивными загрязнителями окружающей среды, влияя на организм животных и человека. Для оценки возможности извлечения ионов металлов (Cd2+, Zn2+, Co2+, Cu2+) из сточных промышленных вод и дальнейшей их доочистки проведены исследования по перераспределению тяжелых металлов в системе «сточные воды – отходы» с использованием отходов железо-магниевого производства. Образцы исследуемых отходов массой 0,1; 0,2; 0,5; 1; 1,5; 2 г взяты для объема сточных вод 50 мл на каждую навеску. Время контакта варьировалось от 5 до 180 мин, фракция отходов – 1 мм. Процесс взаимодействия показал, что отходы эффективно удаляют ионы металлов (Cd2+, Zn2+, Co2+, Cu2+) из промышленных сточных вод. Эффективность удаления загрязнителя из раствора зависит от массы навески отходов, начальной концентрации ионов металлов и времени контакта.
Введение
С развитием промышленности растет актуальность решения проблем предотвращения загрязнения токсичными элементами окружающей среды. По данным Минприроды РФ, в 2021 г. на 15 % увеличилось количество случаев экстремально высокого уровня загрязнения (ЭВЗ) и на 12 % высокого уровня загрязнения (ВЗ) поверхностных пресных вод РФ по сравнению с 2020 г. Суммарное количество случаев ВЗ и ЭВЗ достигло максимума за период 2012-2021 гг., отклонение годового значения показателя от среднего за 10 лет составило 14 %*. Источники поступления загрязняющих веществ в водные объекты – сточные воды, образующиеся в результате сбросов промышленных предприятий, и объекты размещения отходов (ОРО) [1-4].
Долгие годы индустриального развития Уральского региона горнодобывающая промышленность Свердловской обл. остается одной из главных составляющих экономики, развитие которой сопровождается крупномасштабным загрязнением окружающей среды и накоплением техногенных отходов. Особую опасность представляют ОРО добычи и обогащения цветных металлов, в которых металлы находятся в сульфидной форме, с формированием процесса сернокислотного выщелачивания: отвалы забалансовых руд; продукты обогащения; отходы металлургического передела [5].
Одним из примеров района, испытывающего значительное техногенное воздействие, является группа Кабанских медно- и серноколчеданных месторождений. Территориально отработанное месторождение располагается на восточном склоне Среднего Урала, примерно в 15 км от водораздельного хребта. Расстояние до административного центра Уральского федерального округа и Свердловской обл. (Екатеринбурга) составляет 190 км. Примерная площадь нарушенной территории более 80 га, из них 11 га приходится на водные объекты.
Месторождение отрабатывалось открытым способом, оставив после завершения работ нерекультивированные отвалы вскрышных пород и две карьерные выемки, заполненные кислыми водами, на которые влияют подотвальные стоки, имеющие pH 2,33-3,10, содержание цинка 50,12 мг/л, кобальта – 1,73 мг/л, кадмия – 0,20 мг/л, меди – 78,10 мг/л (табл.1).
Таблица 1
Элементный состав исследуемых материалов (валовое содержание)
|
Химический |
Отходы железо-магниевого |
ПДК/ОДК, мг/кг* |
Химический |
Подотвальные воды |
ПДК, мг/л** |
|
|
Cu |
41,25±1,14 |
3/132 |
Cu2+ |
78,10±2,94 |
0,001 |
|
|
Mg |
175000,00±3498,32 |
– |
Mg2+ |
322,50±5,98 |
40 |
|
|
Fe |
52000,00±1984,29 |
– |
Fe3+ |
147,71±3,94 |
0,1 |
|
|
Zn |
77,70±1,84 |
23/220 |
Zn2+ |
50,12±1,14 |
0,01 |
|
|
Cd |
< 1 |
/2 |
Cd2+ |
0,20±0,01 |
0,005 |
|
|
Co |
119,75± 1,41 |
5/ |
Co2+ |
1,73±0,01 |
0,01 |
|
|
Ni |
3083,00±48,13 |
4/80 |
Ni2+ |
0,23±0,01 |
0,01 |
|
|
Ca |
43211,00±581,45 |
– |
Ca2+ |
33,20±0,99 |
180 |
|
|
K |
30140,00±787,40 |
– |
K+ |
5,26±0,96 |
50 |
|
* СанПиН 1.2.3685-21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания».
** Приказ Минсельхоза России от 13.12.2016 № 552 (ред. от 10.03.2020) «Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения».
Цинк играет важную роль в протекании различных биохимических реакций, метаболизме белков и нуклеиновых кислот, является кофактором большой группы ферментов. Суточный порог токсичности для человека около 600 мг [3]. Кадмий токсичен [3], раздражает дыхательные пути, его длительное воздействие может вызвать тяжелую дисфункцию почек, репродуктивной системы, печени, головного мозга и центральной нервной системы [4, 6]. Физиологическая роль кадмия изучена недостаточно [3]. Медь и кобальт в высоких концентрациях тоже токсичны и приводят к неблагоприятным последствиям для здоровья [3, 7].
Нейтрализация высоких концентраций тяжелых металлов может быть достигнута с помощью различных физических, химических и биологических процессов [8]. Распространенными методами удаления ионов металлов из раствора сточных вод являются осаждение, коагуляция, ионный обмен и адсорбция. Методы, связанные с осаждением и коагуляцией, приводят к образованию большого количества осадка [9]. Ионный обмен является дорогостоящим и требует предварительной очистки сточных вод, так как матрицы ионных обменников могут засорятся в процессе эксплуатации различными веществами, находящимися в сточных водах [9]. Поэтому для экологической реабилитации техногенно загрязненных экосистем необходима оценка эффективности применения недорогих материалов для очистки сточных вод от тяжелых металлов [10-12]. Экономический интерес вызывают материалы, широко распространенные в районе расположения источника образования промышленных сточных вод. Таким образом, вопросы изучения процессов, определяющих накопление и миграцию тяжелых металлов в техногенно загрязненных экосистемах (особенно в районах функционирования промышленных предприятий), внедрение приемов детоксикации водных ресурсов, основанных на использовании материалов, в составе которых присутствуют отходы производства, представляют собой интенсивно развивающуюся область исследований [13, 14].
Эффективность использования отходов производств в целях удаления металлов из растворов сточных вод изучается многими исследователями [15, 16]. В статье [15] обоснована возможность использования магнезиально-силикатного реагента на основе серпентинитомагнезита – вскрышной породы Халиловского месторождения магнезита для эффективной многоступенчатой очистки сточных вод. Термоактивированные серпентиновые минералы могут быть использованы для нейтрализации и очистки техногенных растворов, что способствует осаждению железа, алюминия, меди и никеля. Для меди, цинка и никеля наблюдается процесс адсорбции на поверхности реагента и соосаждения.
В исследовании [16] модифицирован остаточный проволочный шлам щелочного выщелачивания (AWRS) путем термической обработки, чтобы получить недорогой и высокоэффективный материал для удаления Cu2+ и Ni2+ из сточных вод. Результаты показали, что AWRS, прокаленный при 700 °C, демонстрировал максимальную способность к удалению Cu2+ и Ni2+. Принимая во внимания низкую стоимость и высокую эффективность AWRS, разработанный авторами сорбент является перспективным для удаления Cu2+ и Ni2+ из раствора сточных промышленных вод.
Методы
В рамках исследований поставлены эксперименты, направленные на изучение селективного удаления Cd2+, Zn2+, Cu2+, Co2+ из модельного раствора материалом, представляющим собой неиспользованные ресурсы в виде отходов железо-магниевого производства, которые образуются в больших количествах и представляют собой пастообразное вещество красно-коричневого цвета (табл.1). По результатам экспериментов проанализировано влияние массы навески отходов, начальной концентрации ионов металлов и времени контакта на удаление ионов металлов из раствора промышленных сточных вод отходами железо-магниевого производства. В качестве модельного раствора выбраны сточные воды, отобранные летом 2021 г. в рамках полевых исследований в границах отработанного Кабанского месторождения (табл.1).
Эксперименты по перераспределению металлов в системе «сточные воды – отходы»
Отобранные пробы отходов железо-магниевого производства усреднены путем квартования и измельчены до фракции 1 мм с помощью лабораторных сит и фарфоровой ступки с пестиком. Для сушки проб использовался сушильный шкаф (ШС-80-01-СПУ, ООО «ПриборУфа», Россия). Навески образцов упакованы в синтетическую ткань (перфорация 0,025 мм).
Образцы сточных промышленных вод отобраны в промытые дистиллированной водой пяти-литровые бутылки из полиэтилена. Пробы отфильтровали с помощью фильтров «синяя лента» и хранили в холодильнике в течение 24 ч. Подготовка образцов сточных вод к элементному анализу выполнена согласно методике NPDES (Waste Water) [17].
Озоление отходов проводили в микроволновой системе MARS 5 Digestion Microwave System (CEM Corporation, США) согласно методике EPA 3052 [17]. К навеске образца 0,5 г приливали 9 мл HNO3 и 3 мл HF, смесь перемешивали, давали отстоятся в течение 15 мин и закрывали сосуды. Использовались рекомендованные производителем сосуды [17] EasyPrep. Время набора температуры до 180 °С составляло 6 мин, время поддержания температуры – 10 мин, мощность – 1800 Вт [17]. На выходе при разбавлении до 50 мл получался прозрачный образец без цвета и частиц.
Концентрации ионов металлов в сточных водах, минерализованных пробах и полученных фильтратах определяли атомно-абсорбционной спектроскопией (ААС) в воздушно-ацетиленовом пламени (Varian AA 240 FS, Varian Australia Pty Ltd, Австралия). Использовали длины волн, нм: Cd 228,8; Zn 213,9; Co 240,7; Mg 202,6; Cu 324,7; Fe 248,3; Ni 232,0. Пределы обнаружения элементов в растворе, мкг/л: Cd 1,5; Zn 1,6; Cu 1,2; Mg 0,3; Fe 7,3; Ni 5,8; K 0,8; Ca 0,4.
Навески образцов (0,1; 0,2; 0,5; 1; 1,5; 2 г) взвешены, помещены в конические пробирки типа «фалькон». К ним приливали сточные промышленные воды объемом 50 мл. Далее пробы перемешивали (99 об/мин) в течение 120 мин при помощи ротационного смесителя ELMI RM-1L (ELMI LTD, Латвия). Полученные растворы отфильтрованы с помощью фильтров «синяя лента». К навескам образцов по 0,2 г приливали сточные промышленные воды объемом 50 мл, пробы перемешивали от 5 до 180 мин. Полученные растворы фильтровали с помощью фильтров «синяя лента».
Для построения изотерм и определения влияния начальной концентрации ионов металлов Cd2+, Zn2+, Cu2+, Co2+ в растворе на эффективность процесса очистки сточных вод приготовили растворы с концентрациями: 10; 30; 50; 100; 300; 500; 1000 мг/л. Растворы приготовлены из реактивов квалификации «о.с.ч.» и ГСО (государственные стандартные образцы, исходная концетрация от 1 до 10 г/л). Взаимодействие проходило при времени контакта 120 мин, навеске образцов 0,2 г, 50 мл раствора, при комнатной температуре и рН 2,3-2,5, регулирующейся с помощью NaOH и HNO3. Для определения pH и температуры использовали Hanna HI 99121 (Hanna Instruments, Германия), pH водной вытяжки определяли при соотношении массы навески и дистиллированной воды между ними 1:5 (ГОСТ 26423-85).
Статическая обменная емкость отходов qe (мг/г) и степень извлечения загрязнителя из растворов рассчитаны по следующим уравнениям:
где Сисх – исходная концентрация ионов меди в растворе, мг/л; Сравн – равновесная (остаточная) концентрация ионов меди в фильтрате, устанавливающаяся в воде после перемешивания воды и субстрата, мг/л; g – масса сухой навески субстрата, г; V – объем приливаемого к отходам модельного раствора, л.
Результаты расчета показателей степени извлечения загрязнителей из раствора приведены в табл.2.
Таблица 2
Результаты химического анализа полученных фильтратов (50 мл, время контакта 120 мин)
|
Навеска, г |
Содержание химических элементов в фильтрате, мг/л |
pH |
||||
|
Cd2+ |
Zn2+ |
Co2+ |
Mg2+ |
Cu2+ |
||
|
0,1 |
0,20±0,006 |
42,11±1,34 |
1,15±0,10 |
429,80±8,91 |
36,83±1,29 |
4,06±0,01 |
|
0,2 |
0,019±0,005 |
10,24±0,94 |
0,90±0,09 |
642,60±13,04 |
5,98±0,81 |
4,52±0,01 |
|
0,5 |
0,001±0,0007 |
0,12±0,011 |
< 0,005 |
849,60±14,01 |
0,09±0,005 |
5,87±0,01 |
|
1 |
< 0,0015 |
0,10±0,009 |
< 0,005 |
1176,20±22,01 |
0,08±0,04 |
6,76±0,01 |
|
1,5 |
0,005±0,002 |
0,09±0,003 |
< 0,005 |
1539,27±19,23 |
0,08±0,003 |
7,37±0,01 |
|
2 |
0,008±0,002 |
0,10±0,001 |
< 0,005 |
2153,00±34,41 |
0,08±0,004 |
8,01±0,01 |
Обсуждение результатов
Для обоснования возможности использования в качестве материала для удаления металлов из раствора сточных вод отходами железо-магниевого производства изучены факторы, влияющие на взаимодействия: начальная концентрация; время контакта; дозировка отходов; pH водной среды [18-20].
Согласно результатам элементного анализа, в составе отходов железо-магниевого производства содержатся значительные концентрации исследуемых ионов, мг/кг: Cu 41,25; Mg 175000,00; Zn 77,70; Co 119,75. Сточные промышленные воды имеют кислую среду (pH 2,33) и высокую минерализацию. Содержание исследуемых ионов металлов, мг/л: Cu 78,10; Zn 50,12; Co 1,73; Cd 0,20 (см. табл.1).
Начальная концентрация ионов металлов Ce (мг/л) является важным фактором, который контролирует перенос ионов металлов из водного раствора в отходы [21]. Ее влияние исследовано в диапазоне 10-1000 мг/л для Cd2+, Zn2+, Co2+, Cu2+ при рН 2,3-2,5 (рис.1). В качестве имитирующего загрязнение сточных вод использовался модельный раствор, приготовленный из ГСО и реактивов.
Количество извлеченных ионов металлов qe увеличивается за счет повышения начальной концентрации ионов металлов с 10 до 500 мг/л. Дальнейшее увеличение концентрации металлов в растворе до 1000 мг/л не повышает эффективность извлечения (рис.1). Таким образом, результаты, показывающие линейную зависимость на начальном этапе, можно объяснить наличием доступных активных центров, т.е. участков поверхности отходов железо-магниевого производства, способных взаимодействовать с исследуемыми ионами металлов либо конкурировать за определенное количество их начальной концентрации. Далее количество активных центров снижается, поэтому увеличение концентрации ионов металлов в растворе более 1000 мг/л приведет к насыщению участков отходов и не повысит эффективность очистки [9, 18, 19]. Это обуславливает необходимость проведения исследований по оценке возможности селективного удаления исследуемых элементов в части формирования каскада биологических прудов с учетом вещественного состава ложа и состава фильтрационной дамбы чувствительных к каждому химическому элементу.
Изучение влияния характеристик взаимодействия на удаление металлов из раствора сточных промышленных вод
Время наступления равновесия является важным параметром при проведении исследований по очистке сточных вод [22, 23]. Максимальное возможное поглощение ионов Cd2+, Zn2+, Co2+, Cu2+ отходом железо-магниевого производства в зависимости от времени контакта изучено, чтобы определить время наступления равновесия. Влияние времени контакта на очистку сточных вод исследовали с использованием постоянной концентрации раствора (табл.3) с различными интервалами времени в диапазоне 5-180 мин при комнатной температуре. Элементный состав фильтратов, полученных в результате взаимодействия отходов железо-магниевого производства со сточными водами, приведен в табл.3.
Таблица 3
Результаты химического анализа полученных фильтратов (50 мл, навеска 0,2 г)
|
Время |
Содержание химических элементов в фильтрате, мг/л |
pH |
||||||
|
Cd2+ |
Zn2+ |
Co2+ |
Mg2+ |
Cu2+ |
Fe3+ |
Ni2+ |
||
|
5 |
0,19±0,001 |
43,01±1,09 |
1,06±0,003 |
530,88±14,03 |
43,19±1,32 |
1,55±0,030 |
0,23±0,011 |
4,05±0,012 |
|
10 |
0,18±0,001 |
39,48±0,98 |
1,03±0,003 |
539,84±13,12 |
19,18±1,01 |
0,03±0,003 |
0,22±0,010 |
4,10±0,014 |
|
15 |
0,17±0,001 |
38,48±0,67 |
1,03±0,003 |
558,40±12,05 |
17,85±0,78 |
0,09±0,002 |
0,21±0,009 |
4,33±0,011 |
|
30 |
0,18±0,001 |
37,52±0,70 |
1,03±0,003 |
604,24±15,09 |
16,85±0,81 |
< 0,0073 |
0,13±0,014 |
4,78±0,015 |
|
60 |
0,04±0,007 |
10,62±0,79 |
1,02±0,004 |
1076,88±21,87 |
6,74±0,77 |
< 0,0073 |
0,05±0,001 |
4,89±0,011 |
|
120 |
0,03±0,007 |
9,61±0,91 |
1,03±0,001 |
979,04±4,94 |
5,25±0,76 |
< 0,0073 |
< 0,0058 |
4,99±0,014 |
|
180 |
0,03±0,007 |
9,05±0,68 |
1,03±0,001 |
980,00±5,19 |
5,20±0,86 |
< 0,0073 |
< 0,0058 |
5,01±0,012 |
С целью оценки возможности вторичного загрязнения в результате взаимодействия отходов железо-магниевого производства с модельным раствором сточных промышленных вод полученные фильтраты также проанализировали на Fe3+ и Ni2+ (табл.3).
Просматривается динамика снижения концентрации исследуемых элементов в зависимости от времени контакта и возможное отсутствие вторичного загрязнения при условии использования отходов железо-магниевого производства. Значения ионов железа и никеля в полученных фильтратах не превышают исходные. На рис.2 показано влияние времени контакта на степень удаления из фильтратов ионов Cd2+, Zn2+, Co2+, Cu2+ с использованием отхода железо-магниевого производства.
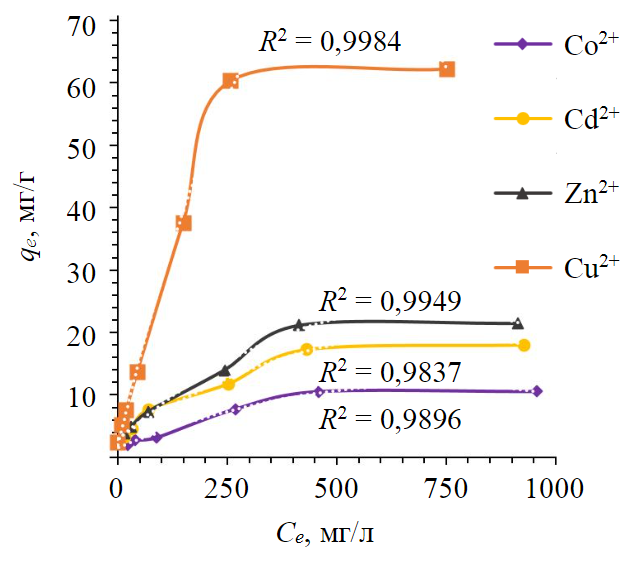
Рис.1. Влияние начальной концентрации ионов металлов в растворе на процесс очистки сточных вод отходами железо-магниевого производства
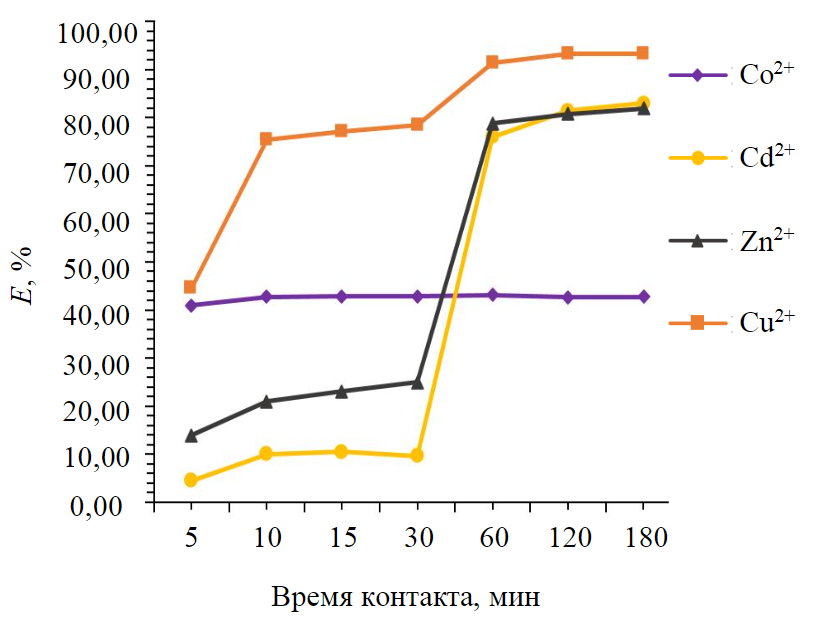
Рис.2. Влияние времени контакта на степень извлечения ионов металлов из раствора
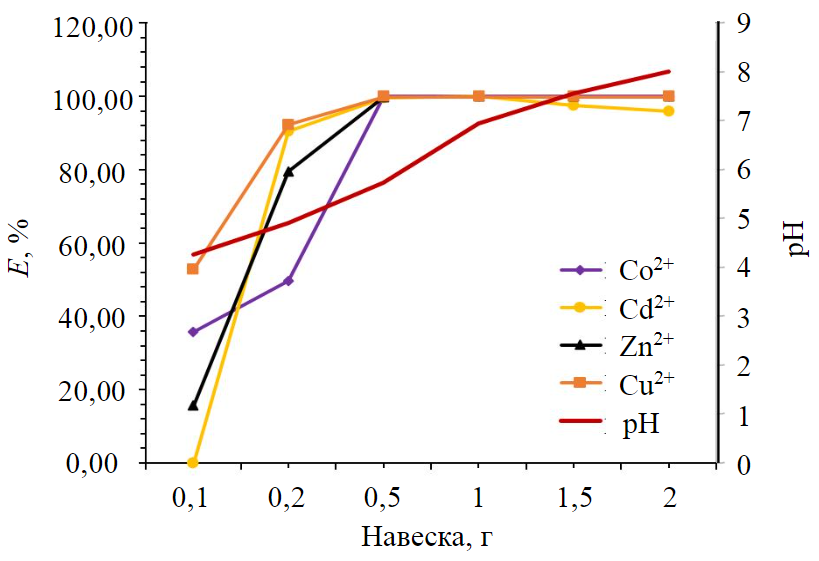
Рис.3. Влияние дозировки отходов и pH фильтратов на степень извлечения ионов из раствора
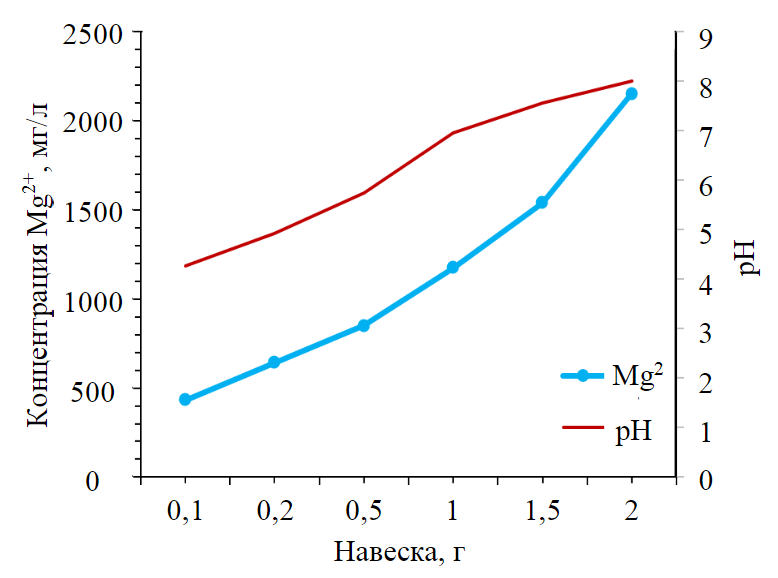
Рис.4. Изменение рН фильтратов относительно концентрации Mg2+ в растворе
Удаление исследуемых элементов из растворов возрастает после 30 мин взаимодействия с отходом и достигает равновесия на 120 мин. Исключение составляет Co2+ – степень извлечения для данного элемента варьируется от 40,89 до 42,72 % и практически не изменяется относительно заданного промежутка времени. Эффективность начального удаления для меди, цинка и кадмия может быть связана с наличием большого количества доступных свободных мест на поверхности отхода. По мере увеличения времени контакта число активных центров уменьшается, а дальнейшее увеличение не приводит к значительным изменениям процесса очистки [18, 19] (см. табл.2).
pH среды [24, 25] влияет как на химический состав раствора, так и на эффективность процесса очистки [26, 27]. Не менее важным параметром для извлечения металлов из раствора является и дозировка исследуемого материала [28-30]. Влияние дозы отходов на процесс очистки необходимо оптимизировать [31-33], поскольку масса отходов влияет на способность материала извлекать загрязнители из раствора при заданной начальной концентрации отходов в условиях эксплуатации [34-36]. Процесс извлечения ионов из раствора изучали, варьируя массу отходов от 0,1 до 2 г в 50 мл раствора с постоянной концентрацией (см. табл.1), постоянной скоростью перемешивания (99 об/мин) в течение 120 мин при комнатной температуре. Влияние навески отходов на удаление ионов тяжелых металлов из сточных вод показано на рис.3.
Процент удаления ионов металлов из раствора увеличивается с одновременным повышением дозировки отходов (рис.3). Минимальные значения показателя Е зафиксированы при дозировке отходов 0,1 г и составляют, %: для Cd2+ 0; Zn2+ 15,78; Cu2+ 52,78; Co2+ 35,83; при повышении дозировки до 0,5 г этот показатель увеличивается, %: Cd2+ 99,5; Zn2+ 99,74; Cu2+ 99,88; Co2+ 100 и достигает равновесия. Таким образом, на графиках (рис.2, 3) прослеживается тенденция увеличения процента удаления ионов тяжелых металлов из сточных вод. На рис.4 показано влияние pH на концентрацию ионов магния в фильтрате в зависимости от массы навески исследуемого материала.
Показатель pH увеличивается в зависимости от массы навески испытуемого материала: чем больше навеска, тем больше pH фильтратов (см. табл.2). Это связано с тем, что отходы железо-магниевого производства имеют щелочной pH 8,7, так как содержат большое количество магния (рис.4), чем разбавляют кислые подотвальные воды, имеющие начальный pH 2,33.
Результаты элементного анализа отходов железо-магниевого производства после взаимодействия с модельным раствором сточных промышленных вод приведены в табл.4. Данные показывают количество извлеченных исследуемых ионов металлов отходами производства из раствора на сухой вес. Согласно полученным результатам, количество обнаруженных ионов металлов в отходах увеличивается со временем; максимальные значения фиксируются при времени контакта 120 мин, далее наблюдается уменьшение значений ионов металлов в отходах (табл.4). Данные показывают, что в составе образцов отходов железо-магниевого производства после взаимодействия со сточными промышленными водами при увеличении времени контакта с 5 до 120 мин обнаруживается Cd, Zn, Fe и Cu в больших концентрациях, чем в исходных образцах. Также фиксируется значительное снижение Mg в составе отходов.
Таблица 4
Результаты элементного анализа отходов после взаимодействия со сточным водами (валовое содержание)
|
Время |
Содержание химических элементов в отходах, мг/кг |
|||||
|
Cd |
Zn |
Co |
Mg |
Cu |
Fe |
|
|
5 |
1,20±0,03 |
120,54±1,23 |
100,00±1,75 |
10021,32±1948,24 |
351,21±25,04 |
61819,25±2948,47 |
|
10 |
1,25±0,03 |
127,50±1,41 |
131,75±2,37 |
16822,50±2821,52 |
407,75±21,48 |
73386,34±3645,75 |
|
15 |
2,21±0,09 |
615,54±29,47 |
135,11±2,04 |
28983,21±3948,63 |
885,37±36,94 |
64528,73±3562,74 |
|
30 |
3,00±0,14 |
844,04±41,22 |
140,25±3,17 |
32430,64±4958,01 |
3354,01±138,04 |
68945,50±3465,39 |
|
60 |
3,75±0,02 |
1035,09±28,98 |
169,24±4,08 |
27562,21±4756,06 |
4137,50±241,10 |
69746,25±2547,05 |
|
120 |
3,78±0,16 |
1041,66±21,84 |
154,32±5,19 |
24842,30±2484,05 |
3775,32±194,90 |
61207,93±2567,93 |
|
180 |
3,54±0,17 |
663,99±17,38 |
96,22±2,28 |
17594,54±1875,75 |
1499,55±53,10 |
62641,50±2857,05 |
Заключение
Приведены исследования по перераспределению тяжелых металлов в системе «сточные воды – отходы» с использованием отходов железо-магниевого производства. Выбор обусловлен их доступностью, так как это производственные отходы, которые образуются в больших количествах и являются потенциально дешевыми материалами для очистки сточных вод. Предприятие, в рамках производственного процесса которого образуются отходы, территориально расположено недалеко от объекта (отработанного Кабанского месторождения), негативно воздействующего на окружающую среду, что способствует снижению затрат на природоохранные мероприятия и уменьшению отходов, подлежащих к размещению на ОРО.
Процесс очистки показал, что отходы эффективно удаляют ионы металлов (Cd2+, Zn2+, Co2+, Cu2+) из промышленных сточных вод. Эффективность удаления зависит от массы навески отходов, времени контакта, начальной концентрации ионов металлов в растворе и pH, и возрастает с увеличением дозировки. Наиболее эффективные показатели очистки сточных вод от ионов исследуемых металлов с помощью отходов железо-магниевого производства: время контакта 120-180 мин; дозировка 4-10 г/л; начальная концентрация ионов металлов (Cd2+, Zn2+, Co2+, Cu2+) в растворе не более 500 мг/л.
Полученные данные свидетельствуют о возможности использования отходов железо-магниевого производства для снижения металлической агрессивности сточных вод и имеют повышенный интерес при разработке мероприятий по очистке сточных вод, в части формирования каскада биологических прудов с учетом вещественного состава ложа и фильтрационной дамбы чувствительных к каждому химическому элементу. Таким образом, дальнейшие исследования по поиску возможности вовлечения в хозяйственный оборот производственных отходов в природоохранных целях перспективны.
* О состоянии и об охране окружающей среды Российской Федерации в 2021 году. Государственный доклад. М.: Мин-природы России; МГУ имени М.В.Ломоносова, 2022. 684 с.
Литература
- Пашкевич М.А., Матвеева В.А., Данилов А.С. Исследование миграции загрязняющих веществ с территорий техногенных массивов Кольского полуострова // Горный журнал. 2019. № 1. С. 17-21. DOI: 10.17580/gzh.2019.01.04
- Jiaping Paul Chen, Lawrence K. Wang, Mu-Hao S. Wang et al. Remediation of Heavy Metals in the Environment.1st Edition. Boca Raton: CRC Press, 2016. 540 p. DOI: 10.1201/9781315374536
- Габараева З.Г., Макиева Д.Ч. Действие тяжелых металлов на организм человека // Образование и право. 2020. № 11. С. 302-304. DOI: 10.24411/2076-1503-2020-11146
- Zhushan Fu, Shuhua Xi. The effects of heavy metals on human metabolism // Toxicology Mechanisms and Methods. 2020. Vol. 30. Iss. 3. P. 167-176. DOI: 10.1080/15376516.2019.1701594
- Антонинова Н.Ю., Рыбникова Л.С., Славиковская Ю.О., Шубина Л.А. Эколого-экономические аспекты выбора направлений реабилитации территорий размещения промышленных отходов горно-металлургического комплекса // Горная промышленность. 2022. № S1. С. 71-77. DOI: 10.30686/1609-9192-2022-1S-71-77
- Genchi G., Sinicropi M.S., Lauria G. et al. The Effects of Cadmium Toxicity // International Journal of Environmental Research and Public Health. 2020. Vol. 17. Iss. 11. № 3782. DOI: 10.3390/ijerph17113782
- Manisalidis I., Stavropoulou E., Stavropoulos A., Bezirtzoglou E. Environmental and Health Impacts of Air Pollution: a Review // Frontiers in Public Health. 2020. Vol. 8. DOI: 10.3389/fpubh.2020.00014
- Собенин А.В., Антонинова Н.Ю., Усманов А.И., Шепель К.В. Оценка влияния вещественного состава ложа биологических прудков на очистку сточных вод предприятий горнометаллургического комплекса // Горный информационно-аналитический бюллетень. 2021. № 5-2. С. 273-282. DOI: 10.25018/0236_1493_2021_52_0_273
- Chowdhury I.R., Chowdhury S., Mazumder M.A.J. et al. Removal of lead ions (Pb2+) from water and wastewater: a review on the low-cost adsorbents // Applied Water Science. 2022. Vol. 12. Iss. 8. № 185. DOI: 10.1007/s13201-022-01703-6
- Sadeghalvad B., Ahali Z., Azadmehr A. Modification of Natural Zeolite by Carboxylate Compounds and Minerals for Removal of Zinc Ions from Wastewater: Equilibrium and Kinetic Studies // Arabian Journal for Science and Engineering. 2016. Vol. 41. Iss. 7. P. 2501-2513. DOI: 10.1007/s13369-015-2003-4
- Solache-Ríos M., Olguín M.T., Martínez-Miranda V. et al. Removal Behavior of Cobalt from Aqueous Solutions by a Sodium-Modified Zeolitic Tuff // Water, Air, & Soil Pollution. 2015. Vol. 226. Iss. 12. № 420. DOI: 10.1007/s11270-015-2688-8
- Singh S.A., Shukla S.R. Adsorptive removal of cobalt ions on raw and alkali-treated lemon peels // International Journal of Environmental Science and Technology. 2016. Vol. 13. Iss. 1. P. 165-178. DOI: 10.1007/s13762-015-0801-6
- Kharko P.A., Matveeva V.A. Bottom sediments in a river under acid and alkaline wastewater discharge // Ecological Engineering and Environmental Technology. 2021. Vol. 22. Iss. 3. P. 35-41. DOI: 10.12912/27197050/134870
- Пашкевич М.А., Харько П.А. Применение композитной смеси для очистки кислых дренажных вод хвостового хозяйства от металлов // Обогащение руд. 2022. № 4. С. 40-47. DOI: 10.17580/or.2022.04.07
- Кременецкая И.П., Иванов Т.К., Гуревич Б.И. и др. Раздельное осаждение металлов из высококонцентрированных растворов гранулированным магнезиально-силикатным реагентом // Вестник МГТУ. 2021. Т. 24. № 1. С. 118-130. DOI: 10.21443/1560-9278-2021-24-1-118-130
- Ming Kong, Longmian Wang, Jianying Chao et al. Removal of Cu2+ and Ni2+ from Wastewater by Using Modified Alkali-Leaching Residual Wire Sludge as Low-Cost Adsorbent // Water, Air, & Soil Pollution. 2019. Vol. 230. Iss. 3. № 65. DOI: 10.1007/s11270-018-4071-z
- MARS 6. Microwave Acid Digestion. Method Note Compendiumod. URL: http://cem.com/media/contenttype/media/lite-rature/MetNote_MARS6_Compendium.pdf (дата обращения 09.09.2022).
- Faisal A.A.H., Nassir Z.S., Rashid H.M. et al. Neural network for modeling the capture of lead and cadmium ions from wastewater using date palm stones // International Journal of Environmental Science and Technology. 2022. Vol. 19. Iss. 11. P. 10563-10576. DOI: 10.1007/s13762-021-03883-1
- Saranya S., Gandhi A.D., Suriyakala G. et al. A biotechnological approach of Pb (II) sequestration from synthetic wastewater using floral wastes // SN Applied Sciences. 2020. Vol. 2. Iss. 8. № 1357. DOI: 10.1007/s42452-020-3172-7
- Barragán-Peña P., Macedo-Miranda M.G., Olguin M.T. Cadmium removal from wastewater in a fixed-bed column system with modified-natural clinoptilolite-rich tuff // Chemical Papers. 2021. Vol. 75. Iss. 2. P. 485-491. DOI: 10.1007/s11696-020-01314-y
- El-Shazly E.A.A., Dakroury G.A., Someda H.H. Kinetic and isotherm studies for the sorption of 134Cs and 60Co radio-nuclides onto supported titanium oxide // Journal of Radioanalytical and Nuclear Chemistry. 2021. Vol. 330 Iss. 1. P. 127-139. DOI: 10.1007/s10967-021-07956-w
- Chang Y.S., Au P.I., Mubarak N.M. et al. Adsorption of Cu(II) and Ni(II) ions from wastewater onto bentonite and bentonite/GO composite // Environmental Science and Pollution Research. 2020. Vol. 27. Iss. 26. P. 33270-33296. DOI: 10.1007/s11356-020-09423-7
- Afolabi F.O., Musonge P., Bakare B.F. Bio-sorption of a bi-solute system of copper and lead ions onto banana peels: characterization and optimization // Journal of Environmental Health Science and Engineering. 2021. Vol. 19. Iss. 1. P. 613-624. DOI: 10.1007/s40201-021-00632-x
- Sosun Ali A., Mannan A. et al. Removal of toxic metal ions (Ni2+ and Cd2+) from wastewater by using TOPO decorated iron oxide nanoparticles // Applied Water Science. 2022. Vol. 12. Iss. 5. № 86. DOI: 10.1007/s13201-022-01588-5
- Khadem M., Husni Ibrahim A., Mokashi I. et al. Removal of heavy metals from wastewater using low-cost biochar prepared from jackfruit seed waste // Biomass Conversion and Biorefinery. 2022. DOI: 10.1007/s13399-022-02748-y
- Babeker T.M.A., Chen Q. Heavy Metal Removal from Wastewater by Adsorption with Hydrochar Derived from Biomass: Current Applications and Research Trends // Current Pollution Reports. 2021. Vol. 7. Iss. 1. P. 54-71. DOI: 10.1007/s40726-020-00172-2
- Abd-Elhamid A.I., Elgoud E.M.A., Aly H.F. Alginate modified graphene oxide for rapid and effective sorption of some heavy metal ions from an aqueous solution // Cellulose. 2022. Vol. 29. Iss. 11. P. 6231-6245. DOI: 10.1007/s10570-022-04656-w
- Ajala M.A., Abdulkareem A.S., Tijani J.O. et al. Adsorptive behaviour of rutile phased titania nanoparticles supported on acid-modified kaolinite clay for the removal of selected heavy metal ions from mining wastewater // Applied Water Science. 2022. Vol. 12. Iss. 2. № 19. DOI: 10.1007/s13201-021-01561-8
- Abdelbasir S.M., Khalek M.A.A. From waste to waste: iron blast furnace slag for heavy metal ions removal from aqueous system // Environmental Science and Pollution Research. 2022. Vol. 29. Iss. 38. P. 57964-57979. DOI: 10.1007/s11356-022-19834-3
- Agunwamba J.C., Amu A.M., Nwonu D.C. An efficient biosorbent for the removal of arsenic from a typical urban-generated wastewater // Environmental Monitoring and Assessment. 2022. Vol. 194. Iss. 12. № 911. DOI: 10.1007/s10661-022-10631-6
- Naseem K., Imran Q., Ur Rehman M.Z. et al. Adsorptive removal of heavy metals and dyes from wastewater using Azadirachta indica biomass // International Journal of Environmental Science and Technology. 2022. DOI: 10.1007/s13762-022-04389-0
- Singh S., Kapoor D., Khasnabis S. et al. Mechanism and kinetics of adsorption and removal of heavy metals from wastewater using nanomaterials // Environmental Chemistry Letters. 2021. Vol. 19. Iss. 3. P. 2351-2381. DOI: 10.1007/s10311-021-01196-w
- Zhang L., Zhang S., Wang C. et al. Hypoxanthine Modified Polyethylene Glycol Diglycidyl Ether Gel for Ciprofloxacin Adsorption // Journal of Biomedical Research & Environmental Sciences. 2021. Vol. 2. Iss. 4. P. 244-250. DOI: 10.37871/jbres1219
- Yanhui Li, Bing Xia, Quansheng Zhao et al. Removal of copper ions from aqueous solution by calcium alginate immobilized kaolin // Journal of Environmental Sciences. 2011. Vol. 23. Iss. 3. P. 404-411. DOI: 10.1016/s1001-0742(10)60442-1
- Joshi H.K., Vishwakarma M.C., Kumar R. et al. Adsorption of Cd2+ from synthetic wastewater by modified leaves of Eupatorium adenophorum and Acer oblongum: thermodynamics, kinetics and equilibrium studies // Discover Water. 2022. Vol. 2. Iss. 1. № 9. DOI: 10.1007/s43832-022-00018-6
- Обуздина М.В., Руш Е.А. Моделирование сорбционных процессов очистки сточных вод модифицированными цеолитами // Вестник Российского университета дружбы народов. Серия: Экология и безопасность жизнедеятельности. 2022. Т. 30. № 3. С. 240-249. DOI: 10.22363/2313-2310-2022-30-3-240-249
