Кинетика растворения фосфатов редкоземельных металлов растворами карбонатов щелочных металлов
- 1 — д-р техн. наук профессор Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 2 — аспирант Санкт-Петербургский горный университет ▪ Orcid
Аннотация
При переработке апатитового сырья образуются крупнотоннажные отходы – фосфогипс. Содержание редкоземельных металлов в таких отходах достигает 1 %, что позволяет рассматривать их в качестве техногенного источника получения редкоземельных металлов и их соединений. В настоящее время отсутствуют как эффективная схема переработки, так и предприятия по переработке отвалов фосфогипса. Рационально использование схемы, в которой предусмотрено извлечение ценных компонентов и сокращение отвалов фосфогипса в целом. Такая схема переработки возможна при карбонатной конверсии фосфогипса на сульфат щелочного металла или аммония и карбонат кальция при условии попутного извлечения соединений редкоземельных металлов (РЗМ). Попутное извлечение соединений РЗМ возможно за счет образования ими прочных и устойчивых комплексы с жесткими основаниями по Пирсону, к которым, в том числе, относят карбонат, фосфат- и сульфат-анионы. Образованию комплексов лантаноидов с неорганическими кислородсодержащими анионами способствует формирование высокоэнергетичных Ln-O связей. Изучено растворение фосфатов лантаноидов в карбонатных средах. Установлено, что образование карбонатных комплексов РЗМ из их фосфатов – самопроизвольный эндотермический процесс, а термодинамическим ограничением растворения является образование карбонатов и гидроксидов лантаноидов. Смещение равновесия в сторону образования карбонатных комплексов достигается при увеличении температуры до 90-100 °С и избытке карбоната. Лимитирующей стадией процесса растворения фосфатов РЗМ в карбонатных средах является внешняя диффузия. На это указывает увеличение скорости процесса при росте интенсивности перемешивания, протекание процесса по первому порядку и величина энергии активации растворения фосфата от 27 до 60 кДж/моль. Совокупность физико-химических показателей процесса позволила сформировать техническое решение попутного извлечения РЗМ при карбонатной конверсии фосфогипса, включающее конверсию фосфогипса при температуре 90-110 °С раствором карбоната щелочного металла или аммония концентрацией 2-3 моль/л в течение 4-5 ч. В результате получают раствор с сульфатом щелочного металла (аммония), содержащим РЗМ в форме карбонатных комплексов и карбонат кальция. Степень извлечения РЗМ в раствор достигает не менее 93 %. Редкоземельные металлы отделяют от маточного раствора осаждением или сорбцией на анионообменных смолах, а избыток карбоната щелочного металла или аммония возвращают на начало процесса.
Введение
В настоящее время развитие многих отраслей промышленности напрямую связано с использованием редкоземельных металлов. Российская Федерация входит в первую четверку стран по количеству разведанных запасов редкоземельных металлов, однако обеспечить собственные нужды в индивидуальных редкоземельных металлах (РЗМ) или смеси их соединений не может, что, в свою очередь, приводит к зависимости от импортных производителей (например, Китая, который является крупнейшим производителем редких земель в мире). Постоянный рост потребности в соединениях РЗМ требует вовлечения в переработку нетрадиционного сырья, например, продуктов переработки апатитов Кольского полуострова.
Основная часть территориально доступных запасов РЗМ, расположенных в регионах с развитой инфраструктурой, заключена в месторождениях, где они являются попутными компонентами [1, 8-11].
Например, в апатит-нефелиновых рудах месторождений Хибинской группы в Мурманской области содержится более 40 % российских запасов РЗМ, которые в действующем цикле переработки остаются в отвалах фосфогипса. В соответствии с государственной программой РФ «Развитие промышленности и повышение ее конкурентоспособности на период до 2020 года» разработка технологии извлечения, разделения и получения РЗМ, в том числе при переработке апатита и фосфогипса, является критически востребованной стратегической задачей.
Фосфогипс – это побочный продукт переработки фосфатного рудного сырья (апатитов, фосфоритов) мокрым кислотным методом, на который в настоящее время приходится более 90 % производства фосфорной кислоты. Мировое производство фосфогипса по разным оценкам составляет около 160-170 млн т в год. На каждую тонну получаемой из фосфатного сырья фосфорной кислоты образуется 4-5 т фосфогипса [15, 24, 26, 29].
Ежегодно во всем мире производится более 22 млн т фосфорной кислоты. Основное количество фосфатного сырья перерабатывается в США, странах бывшего СССР, Китае, Африке и на Ближнем Востоке, а также на Востоке и Юго-Востоке Европейского региона. Отвалы фосфогипса играют ключевую роль в извлечении РЗМ и других критических металлов [25, 28].
Тенденция европейской политики в области минеральных ресурсов по обеспечению критически важным сырьем для устойчивых экологически чистых отраслей промышленности направлена на вовлечение в переработку фосфогипса. Фосфогипс содержит около 0,5-1 % РЗЭ и других критических металлов (Te, V, F, Ag, Mo, Se), которые попадают в фосфогипс при переработке фосфатного (например, апатитового) сырья [32-34].
Организация переработки фосфогипса может значительно снизить критичность этих элементов для многих высокотехнологичных отраслей промышленности [40]. Известно, что сырьевая база многих отраслей химической промышленности истощается, и все актуальнее становится вопрос вовлечения в производство как сырья с низким содержанием полезных компонентов, так и отходов производств. Кроме того, отвалы фосфогипса существенно влияют на биосферу. Так, например, почвы в радиусе до двух километров от отвалов фосфогипса подвергаются загрязнению элементами, входящими в состав отходов [17].
Массовая доля оксидов РЗМ в фосфогипсе меньше, чем в бастнезитовых рудах или в рудах месторождения Байян-Обо в Китае (это месторождение по содержанию РЗМ справедливо относят к уникальным), но сопоставима с массовой долей оксидов РЗМ в не столь богатых месторождениях. Состав редких земель по индивидуальным элементам значительно лучше по сравнению с лопаритом и монацитом, поскольку содержание дефицитных элементов средней группы (европия, тербия, диспрозия) существенно выше [2, 13].
В отличие от других источников РЗМ, фосфогипс практически не содержит радиоактивного тория. Таким образом, переработку апатитового сырья в основном производственном цикле и длительное хранение в накопителях можно рассматривать как этап подготовки фосфогипса к промышленной переработке.
Для переработки фосфатного сырья возможно применение как кислотных, так и щелочных технологий, включающих обработку монацитового или ксенотимового концентрата крепкими растворами щелочей или соды [3].
У всех вариантов кислотной переработки фосфогипса, направленных на извлечение соединений РЗМ, основной стадией является кислотное выщелачивание с применением азотной [22, 30, 36], серной [4, 5, 18, 31] или соляной кислот различной концентрации [14, 38]. Способы отличаются количеством стадий переработки и степенью извлечения РЗМ в кислый раствор, которая не превышает 80-85 %. Однако ни один из вариантов не предполагает полной переработки отвалов фосфогипса, а некоторые из предложенных технических решений могут только ухудшить экологическую ситуацию из-за применения органических экстрагентов (например, третичных аминов, относящихся ко второму классу опасности) [21].
Процесс карбонатной конверсии гипса на сульфат аммония и карбонат кальция по реакции хорошо известен с начала прошлого столетия и является основой большинства известных технических решений снижения количества отвалов фосфогипса с помощью технологии его карбонизации [10].
При получении карбоната щелочного металла (аммония) за счет поглощения углекислого газа раствором щелочи или аммиака достигается эффект связывания одного из основных парниковых газов, что благоприятно использовать для смягчения последствий глобального изменения климата и формировании зеленых технологий. Годовое производство фосфогипса (100-280 Мт) может связывать 26-72 Мт СО2, а уже накопленные отвалы фосфогипса – заметно бо́льшие количества [16, 23, 27].
Технологии карбонатной конверсии фосфогипса с целью увеличения глубины переработки могут быть дополнены извлечением ценных компонентов, например, РЗМ и/или солей стронция [20, 37].
К недостаткам описанных способов следует отнести многостадийность процесса, большие затраты на обжиг мела и последующий цикл растворения-осаждения. Тем не менее основным достоинством предложенных способов извлечения РЗМ при карбонатной конверсии фосфогипса является уменьшение количества отвалов и выделение ценных компонентов.
Таким образом, разработка эффективной технологии переработки фосфогипса с получением концентрата редкоземельных элементов и другой востребованной продукции является актуальной и перспективной.
Известно, что скандий способен образовывать растворимые карбонатные комплексы состава [Sc(CO3)2]– и [ScCO3]+ [6]. Также существует возможность растворения карбонатов РЗМ при действии избытка карбоната аммония или калия [19, 25, 39]. Сведения о кинетических закономерностях растворения малорастворимых солей РЗМ в карбонатных средах носят весьма обрывочный характер.
Целью настоящего исследования является анализ кинетики растворения фосфатов РЗМ в карбонатных средах.
Методология
Термодинамический анализ растворимости фосфатов РЗМ в карбонатных средах проведен методом математического моделирования с использованием сведений об энергии Гиббса образования карбонатных комплексов иттрия и лантаноидов при температуре 298 K, взятых из литературных источников [19, 25, 39].
Для оценки тепловых эффектов образования карбонатных комплексов для температуры 298 K использовано известное соотношение
Энтропия образования комплексных ионов для обычных температурных условий рассчитана по эмпирическому уравнению Латимера – Пауэлла [28]:
где М – молярная масса иона, г/моль; z – заряд иона; (r + x) – радиус комплексного иона, вычисленный как сумма термохимических радиусов катиона РЗМ и карбонат-иона, пм.
Сведения о термохимических радиусах иттрия и лантаноидов заимствованы из статьи [35], термохимический радиус карбонат-иона принят равным 155 пм [7].
Исследования кинетики растворения фосфатов РЗМ в карбонатных средах проводили на модельных объектах – фосфатах РЗМ, полученных методом неорганического синтеза [12] из нитратов иттрия, церия, неодима, эрбия (марка ХЧ) и иттербия. Достоверность состава получаемых препаратов РЗМ подтверждена оценкой осадков методами рентгеновской порошковой дифрактометрии и рентгенофлуоресцентного анализа. Выбор синтетических препаратов РЗМ обусловлен составом фосфогипса, который, помимо церия и иттрия, содержит РЗМ среднетяжелой группы, к которым относят неодим. Поведение иттриевых РЗМ изучено на примере фосфатов иттрия и иттербия.
Исследование закономерностей растворения фосфатов РЗМ в карбонатных средах выполнены в термостатируемом аппарате на установке HEL Auto-MATE Reactor System с регулируемой скоростью перемешивания и подачи реагентов.
Навеску исследуемого материала помещали в стеклянный сосуд, добавляли раствор карбоната калия заданной концентрации и перемешивали при постоянной температуре, потом твердую фазу отделяли фильтрованием на вакуумном фильтре при температуре эксперимента. Водный раствор анализировали на содержание иттрия или лантаноидов, а остаток высушивали до постоянной массы и взвешивали. Таким образом, контроль степени извлечения в раствор вели как весовым методом по убыли массы фосфата лантаноида, так и по концентрации лантаноида в водном растворе по результатам комплексонометрического анализа раствора в присутствии индикатора арсеназо (III).
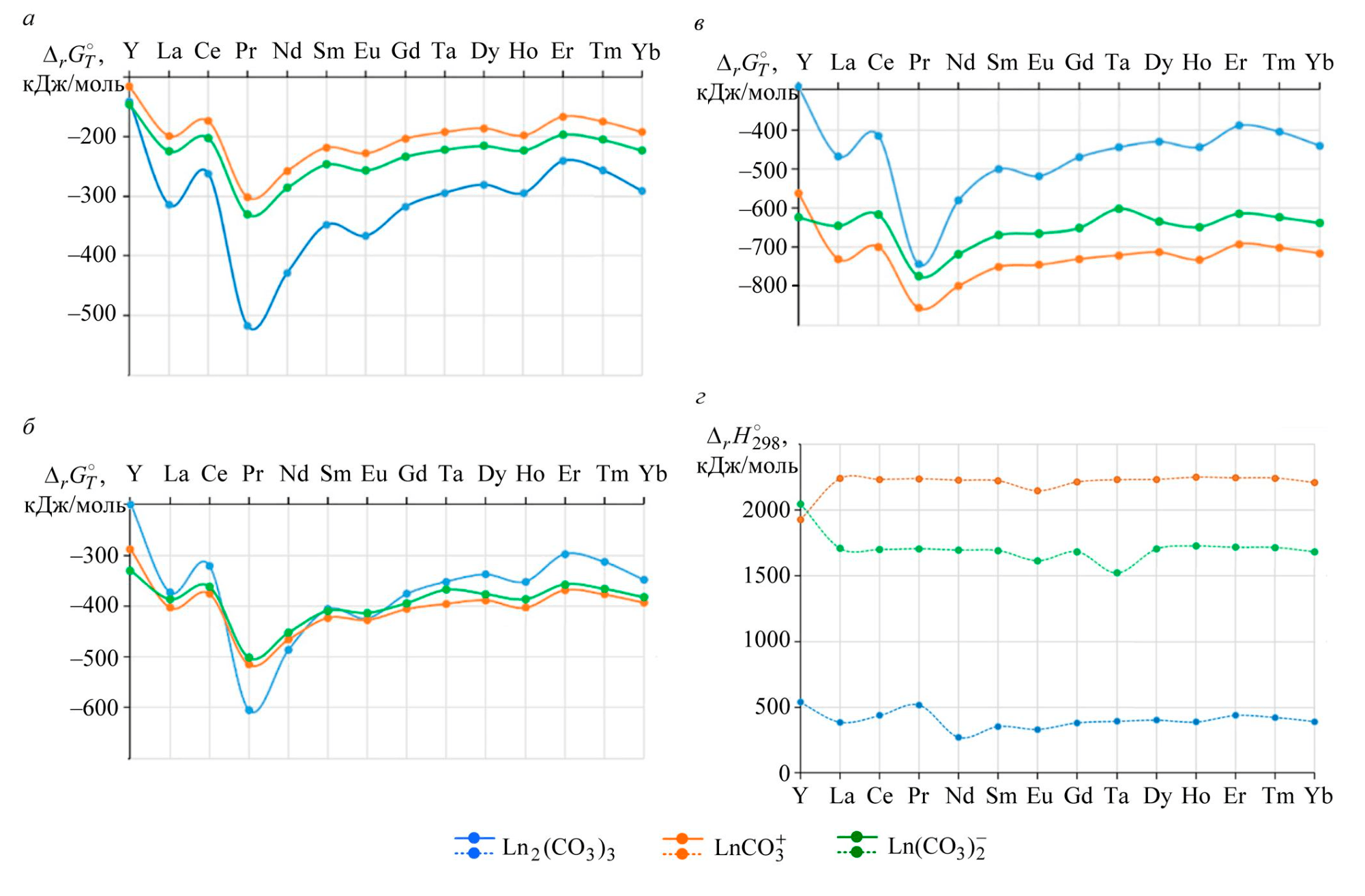
Рис.1. Влияние температуры на образование карбонатных соединений РЗМ: 25 °С (а), 50 °С (б), 90 °С (в), и изменение энтальпии (г)
Раствор карбоната калия готовили путем растворения рассчитанного количества препарата марки ХЧ в дистиллированной воде.
Степень извлечения РЗМ в раствор вычисляли по уравнению:
где СLn – молярная концентрация ионов лантаноидов в конечном растворе, моль/л; Vр – объем раствора, л; $M_\mathrm{LnPO_4}$ – молярная масса фосфата лантаноида, г/моль; mi, mk – исходная и конечная массы навески фосфата лантаноида соответственно, г.
Расчет термодинамических параметров карбонизации фосфатов лантаноидов
Карбонизация фосфатов лантаноидов протекает двумя путями:
- образованием карбоната лантаноида из его фосфата
и последующим его растворением с образованием бикарбонатного комплекса
- растворением фосфата лантаноида в среде карбоната щелочного металла с образованием моно- и бикарбонатных комплексов:
На рис.1 показано влияние температуры на протекание реакций по обоим вариантам, вычисленное по уравнению изобары химической реакции.
Реакции образования карбоната РЗМ из его фосфата и растворение фосфатов лантаноидов с образованием карбонатных комплексов протекают самопроизвольно с эндотермическим эффектом (рис.1, г). Эндотермический эффект образования карбонатных комплексов значительно больше, чем при получении карбоната.
Термодинамическим затруднением растворения фосфатов РЗМ с образованием карбонатных комплексов может являться образование гидроксидов иттрия и лантаноидов
Комплексообразование гидроксидов лантаноидов в карбонатные комплексы по реакциям:
протекает с гораздо меньшей интенсивностью, чем для карбонатов или фосфатов РЗМ, однако из-за эндотермического эффекта реакции комплексообразования при увеличении температуры до 90-100 °С процесс растворения гидроксидов РЗМ становится самопроизвольным.
При обычных условиях более вероятна конверсия фосфата РЗМ до его карбоната или гидроксида. По мере увеличения температуры более интенсивно протекают реакции, сопровождающиеся растворением фосфатов с образованием карбонатных комплексов.
Результаты
Ввиду гетерогенности процесса зависимость степени извлечения от скорости перемешивания позволит предположить лимитирующую стадию реакции растворения фосфатов лантаноидов в карбонатных средах. Влияние скорости перемешивания получено для растворов с концентрацией карбоната калия 2 моль/л при температуре 90 °С (рис.2).
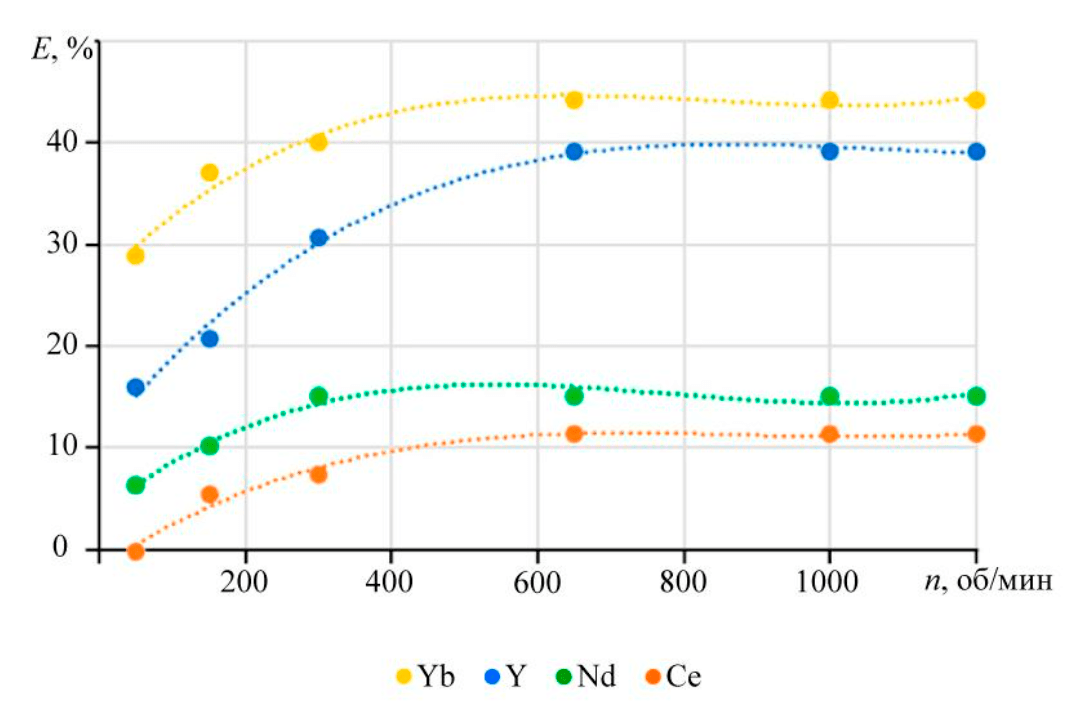
Рис.2. Влияние скорости перемешивания на степень извлечения иттрия и лантаноидов в раствор
Степень извлечения уменьшается в направлении от иттербия к церию, что, в том числе, может быть связано с различиями энергии активации выщелачивания фосфата лантаноида. Увеличение скорости перемешивания приводит к росту степени извлечения в раствор, что характерно для процессов, лимитируемых внешней диффузией реагентов.
На рис.3 представлены зависимости степени извлечения цериевых (Ce, Nd) и иттриевых (Y, Yb) РЗМ от времени, полученные для температур 50, 70 и 90 °С, т.е. для условий, при которых вероятно образование карбонатов РЗМ, и условий, при которых более вероятно растворение фосфата с образованием в растворе карбонатных комплексов. Учитывая опыт сравнительно немногочисленных исследований растворимости соединений РЗМ в карбонатных средах, а также рекомендованный при карбонатной конверсии фосфогипса избыток карбоната щелочного металла, концентрация карбонат-иона в растворе составила 2 моль/л.
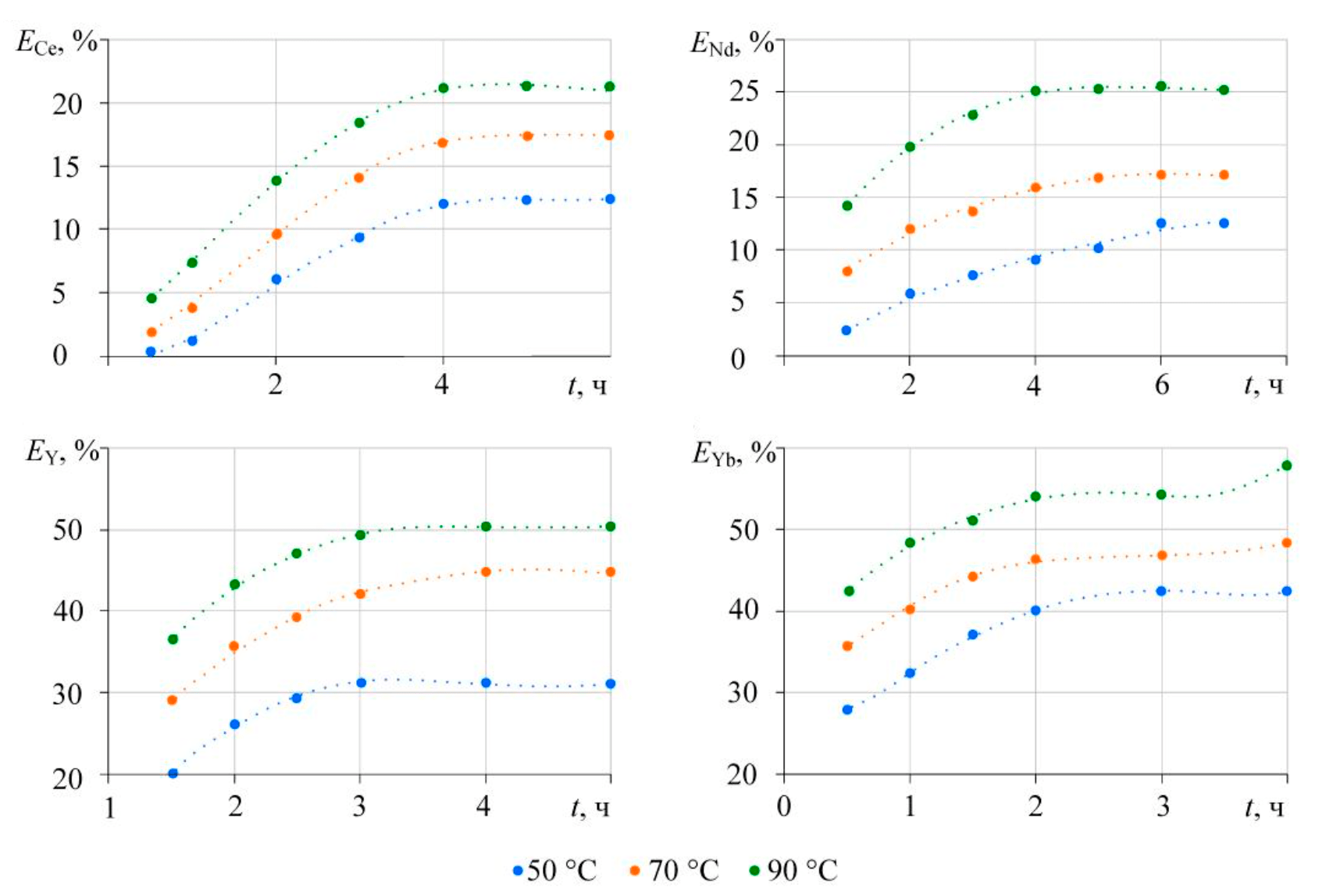
Рис.3. Влияние температуры и продолжительности контакта фаз на степень извлечения РЗМ
Для элементов иттриевой группы степень извлечения в раствор больше, чем для РЗМ цериевой группы. Равновесное состояние достигается при продолжительности контакта фаз 2-3 ч для РЗМ иттриевой группы и 4-6 ч для легких лантаноидов. Увеличение температуры приводит к росту извлечения в раствор, что может определяться как термодинамическими особенностями (эндотермическим эффектом протекания процесса), так и кинетическими параметрами процесса. Например, время достижения состояния, близкого к равновесию, в случае неодима существенно зависит от температуры и уменьшается при ее повышении от 50 до 90 °С.
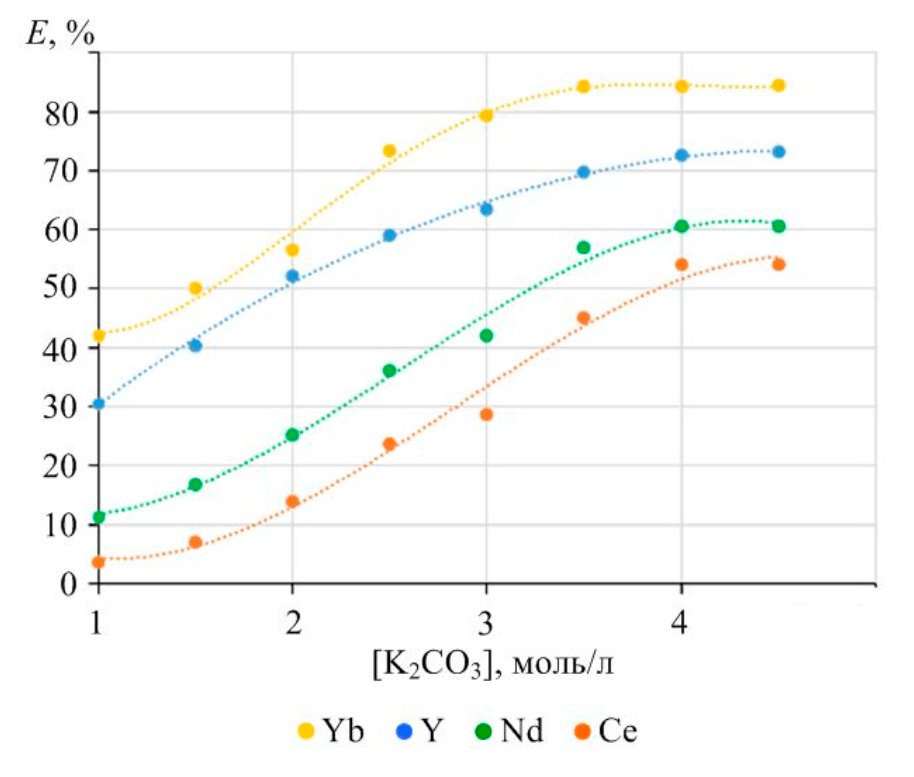
Рис.4. Зависимость степени извлечения в раствор фосфатов лантаноидов от концентрации карбоната калия при продолжительности перемешивания 6 ч и температуре 90 °C
На рис.4 представлены результаты влияния концентрации раствора карбоната калия на степень извлечения РЗМ в раствор при условиях, близких к состоянию равновесия, при продолжительности перемешивания 6 ч. При дальнейшем увеличении времени контакта фаз существенных изменений концентрации раствора или массы остаточного фосфата лантаноида не происходит.
Рост концентрации карбоната в растворе приводит к закономерному увеличению степени извлечения РЗМ в раствор. Максимальное извлечение получено при концентрации карбоната калия в растворе 4 моль/л. Дальнейшее повышение концентрации не приводит к улучшению показателей. Увеличение степени извлечения наблюдается при переходе от цериевых РЗМ к иттриевым.
Обсуждение
Для описания кинетики процесса была принята модель стационарной конвективной диффузии (модель эффективного диффузионного слоя). Уравнение скорости реакции примет вид уравнения первого порядка:
Поскольку карбонат калия находится в избытке по отношению к фосфату редкоземельного металла, скорость процесса и изменение массы образца определяются количеством фосфата лантаноида, вступившего в реакцию комплексообразования,
где β – коэффициент массопереноса; mt – масса карбоната лантаноида.
Соответственно зависимости логарифма массы от времени должны быть линейными с угловым коэффициентом, соответствующим коэффициенту массопереноса. Полулогарифмические зависимости массы фосфата лантаноида от времени, построенные по результатам исследований влияния температуры на степень извлечения лантаноида в раствор, показаны на рис.5.
Полученные зависимости удовлетворительно аппроксимируются линейными зависимостями, представленными в табл.1, с величиной достоверности аппроксимации не менее 90 %. По мере увеличения температуры величина углового коэффициента (константы скорости реакции) закономерно увеличивается.
Кажущаяся энергия активации процесса была вычислена по температурной зависимости скорости превращения вещества при произвольно выбранной (одинаковой для всех температур) степени превращения в соответствии с уравнением
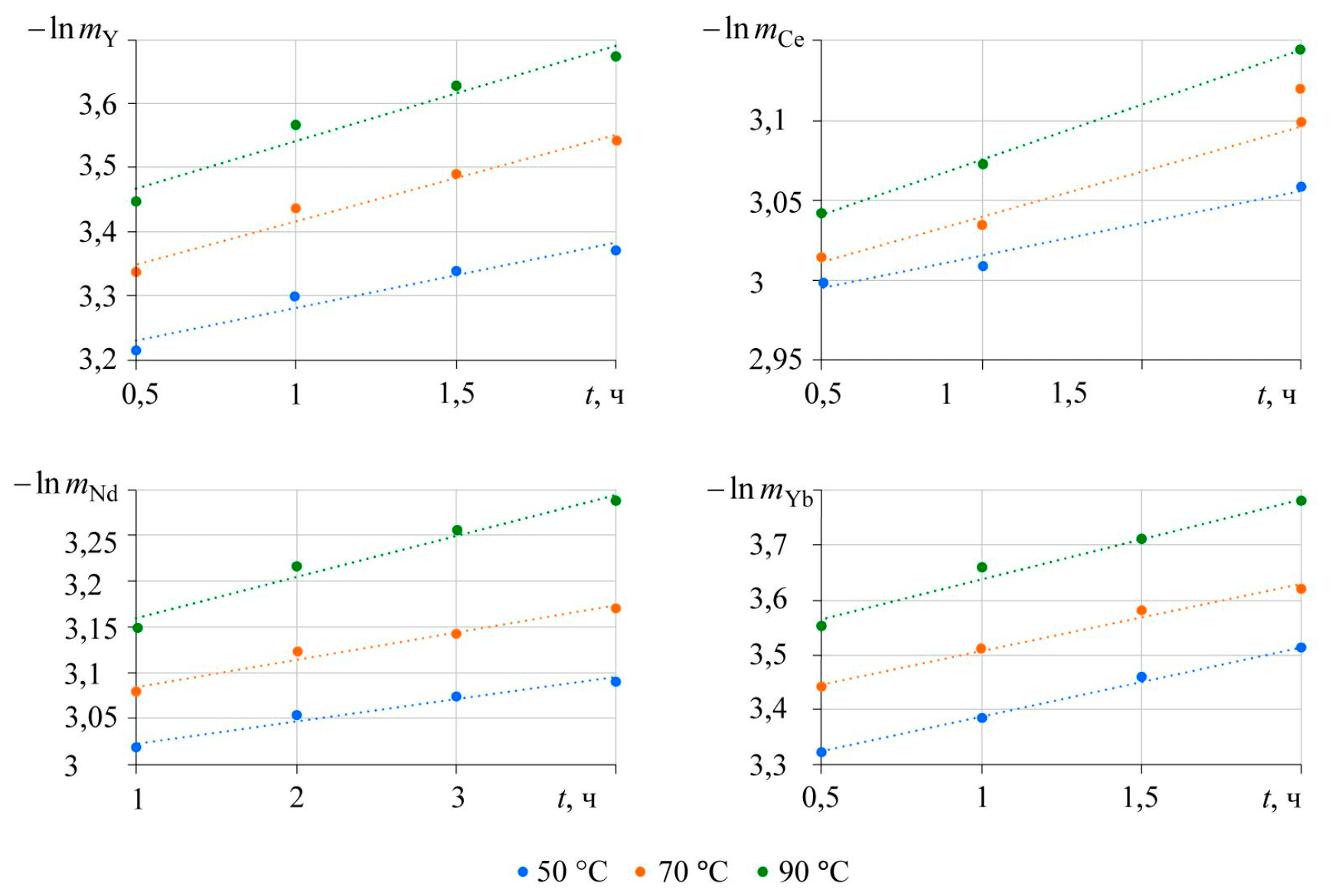
Рис.5. Зависимости логарифма массы от времени, полученные при растворении фосфата лантаноида в 2 М растворе карбоната калия при различных температурах эксперимента
Таблица 1
Уравнения зависимости логарифма массы фосфата лантаноида от времени
|
Элемент |
Т, °С |
||
|
50 |
70 |
90 |
|
|
Иттрий |
–lnm = 0,1024t + 3,1782 |
–lnm = 0,1344t + 3,2828 |
–lnm = 0,1481t + 3,3936 |
|
Церий |
–lnm = 0,0408t + 2,9745 |
–lnm = 0,0569t + 2,983 |
–lnm = 0,0691t + 3,0062 |
|
Неодим |
–lnm = 0,0236t + 3,0003 |
–lnm = 0,0293t + 3,0553 |
–lnm = 0,0448t + 3,1145 |
|
Иттербий |
–lnm = 0,1258t + 3,2624 |
–lnm = 0,122t + 3,3854 |
–lnm = 0,1452t + 3,4932 |
С учетом уравнения Аррениуса
или
Полулогарифмические зависимости скорости выщелачивания от обратной температуры показаны на рис.6.
Линейные зависимости аппроксимируются уравнениями, представленными в табл.2, с величиной достоверности аппроксимации не менее 98 %.
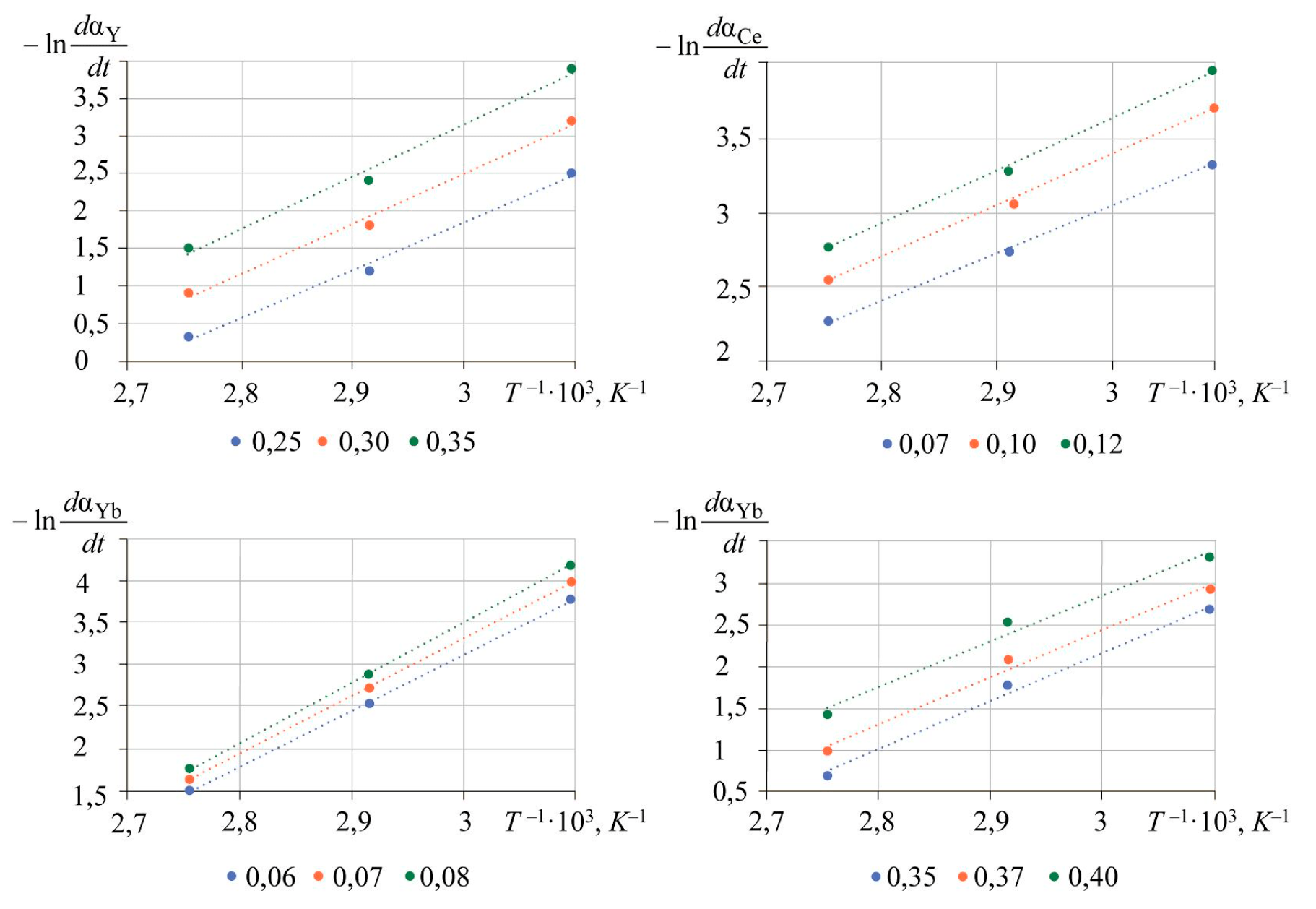
Рис.6. Зависимость логарифма мгновенной скорости реакции растворения фосфатов РЗМ
Таблица 2
Зависимости логарифма скорости реакции от температуры
|
α |
Иттрий |
α |
Неодим |
|
0,25 |
ln(dα/dt) = –6397,8/T + 17,352 |
0,06 |
ln(dα/dt) = –6724,5/T + 17,045 |
|
0,30 |
ln(dα/dt) = –6727,9/T + 17,687 |
0,07 |
ln(dα/dt) = –6950,9/T + 17,536R2 = 0,9999 |
|
0,35 |
ln(da/dt) = –7058/T + 18,022 |
0,08 |
ln(dα/dt) = –7177,4/T + 18,027 |
|
α |
Церий |
α |
Иттербий |
|
0,07 |
ln(dα/dt) = –3095,8/T + 6,2684 |
0,35 |
ln(dα/dt) = –5800,9/T + 15,227 |
|
0,10 |
ln(dα/dt) = –3353,1/T + 6,6829 |
0,37 |
ln(dα/dt) = –5671,7/T + 14,568 |
|
0,12 |
ln(dα/dt) = –3524,6/T + 6,9593 |
0,40 |
ln(dα/dt) = –5477,9/T + 13,579 |
Угловой коэффициент зависимостей пропорционален энергии активации. Значения кажущейся энергии активации лантаноидов находятся в диапазоне 30-61 кДж/моль, что характерно для диффузионного или переходного режимов. Полученные значения энергии активации и порядки реакции представлены в табл.3.
Для гетерогенных систем твердое – жидкость, где происходит реакция растворения малорастворимого соединения, характерна реакция первого порядка, что было подтверждено экспериментально. Представленные кинетические данные описывают сложный процесс диффузии комплексо-образователя – карбонат-иона к поверхности осадка лантаноида, диссоциацию и образование комплексного соединения.
Отличие кинетических показателей церия от иттрия и других лантаноидов можно объяснить быстрым окислением до четырехвалентного состояния, что приводит к уменьшению выхода в раствор по термодинамическим показателям, несмотря на меньшую по сравнению с другими элементами энергию активации.
Таблица 3
Кинетические параметры растворения фосфатов лантаноидов в карбонатных средах
|
Элемент |
Энергия активации, кДж/моль |
k |
Постоянная Аррениуса |
Кажущийся порядок реакции n |
|
Y |
55,91 |
0,150 |
1,68⋅107 |
1 |
|
Ce |
27,63 |
0,070 |
6,68⋅102 |
|
|
Nd |
57,76 |
0,048 |
1,00⋅107 |
|
|
Yb |
46,95 |
0,155 |
8,91⋅105 |
Формирование технического решения
Анализ совокупности физико-химических параметров карбонизации фосфатов РЗМ позволил сформировать контуры технологии попутного извлечения РЗМ при карбонатной конверсии фосфогипса. Переработка фосфогипса карбонатно-щелочным методом с попутным выделением редкоземельных металлов представляет собой совокупность следующих операций (рис.7): приготовление раствора карбоната щелочного металла или аммония; конверсию фосфогипса; фильтрацию, промывку и сушку фосфомела; выделение РЗМ из карбонатно-сульфатного раствора; разделение сульфата и карбоната щелочного металла или аммония.
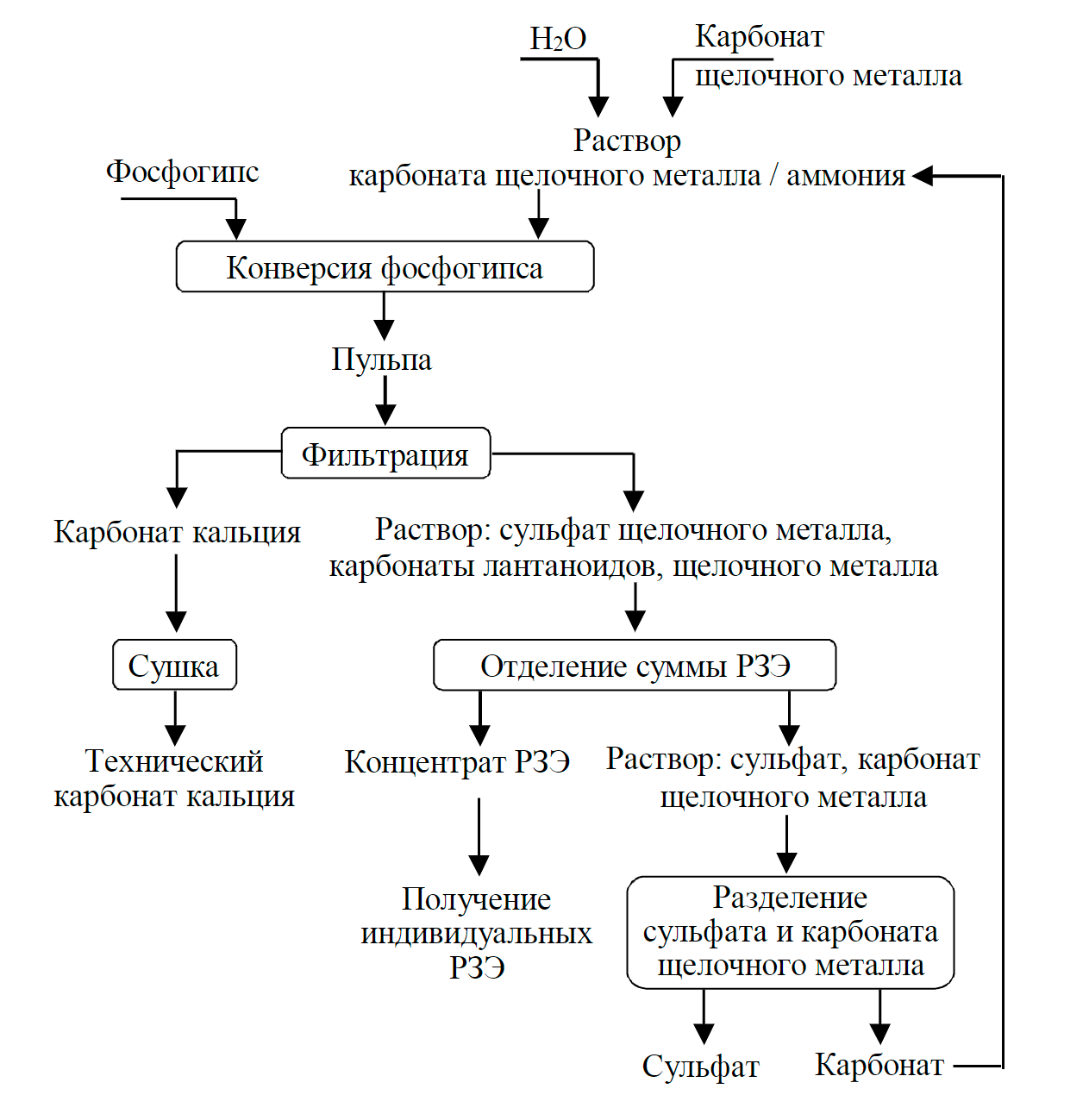
Рис.7. Схема комплексной переработки фосфогипса с попутным получением РЗМ
Приготовление раствора карбоната щелочного металла или аммония возможно двумя путями: растворением промышленных препаратов или методом абсорбции углекислого газа гидроксидом аммония или щелочами. В последнем случае достигается эффект полезной утилизации CO2.
Фосфогипс из отвалов смешивают с раствором карбоната щелочного металла или аммония концентрацией 2,5 ± 0,5 моль/л при температуре 110 ± 10 °С в течение 4,5 ± 0,5 ч при соотношении Ж:Т, равном 1900 ± 100 по отношению к сумме оксидов редкоземельных металлов, содержащихся в фосфогипсе. В указанных условиях происходит перевод соединений РЗМ в раствор в форме карбонатных комплексов. Нерастворимая часть пульпы представляет собой карбонат кальция, содержащий примеси железа и других элементов, входящих в состав фосфогипса. Раствор конверсии содержит сульфат щелочного металла (аммония), избыток карбоната щелочного металла (аммония) и РЗМ в форме карбонатных комплексов. Степень извлечения РЗМ в раствор составляет 95 ± 3 %.
Из карбонатно-сульфатного раствора РЗМ могут быть отделены осаждением в виде гидроксидов при охлаждении раствора до 20 ± 5 °С или выделены методом сорбции на анионообменных смолах или методом жидкостной экстракции с использованием анионообменных экстрагентов, например, солей четвертичных аммониевых оснований.
После отделения РЗМ раствор сульфатов и карбонатов калия направляют на стадию разделения карбонатов и сульфатов щелочных металлов (аммония). При конверсии с использованием карбоната калия выделяют сульфат калия в качестве товарного продукта, а карбонат калия в виде оборотного раствора возвращают на стадию приготовления раствора и проведения конверсии.
Выводы
- Введен новый подход к переработке техногенных отходов, основанный на теоретических представлениях о жестких и мягких кислотах и основаниях по Пирсону: катионы РЗМ, являясь жесткими кислотами, образуют прочные анионные комплексы с кислородсодержащими неорганическими лигандами как жесткими основаниями, к которым в том числе относят карбонат-ионы.
- Установлены термодинамические закономерности карбонатной конверсии малорастворимых соединений РЗМ с образованием карбонатных комплексов. Показано, что растворениефосфатов РЗМ в карбонатных средах является самопроизвольным эндотермическим процессом. Увеличение температуры приводит к усилению растворения фосфатов РЗМ с образованием карбонатных комплексов.
- Термодинамическим ограничением растворения фосфатов РЗМ в карбонатных средах может являться образование карбонатов и гидроксидов иттрия и лантаноидов. Растворение карбонатов и гидроксидов РЗМ с образованием карбонатных комплексов является эндотермической реакцией и преобладает при температуре не менее 90°С в избытке карбоната.
- Лимитирующей стадией карбонатной конверсии фосфатов РЗМ с образованием карбонатных комплексов является внешняя диффузия, энергия активации составляет 30-60кДж/моль, но нельзя исключить и возможность внутридиффузионных процессов.
- Определена последовательность и условия проведения технологических операций попутного извлечения соединений РЗМ при карбонатной конверсии фосфогипса на карбонат кальцияи сульфат щелочного металла (аммония).
Литература
- Каплунов Д.Р. Обоснование полного цикла комплексного освоения недр при разработке месторождений твердых полезных ископаемых / Д.Р.Каплунов, Д.Н.Радченко // Горный информационно-аналитический бюллетень. 2011. № S1. С. 447-455.
- Комплексная переработка фосфогипса с получением химически осажденного мела, гипса и концентрата редкоземельных элементов / В.Д.Косынкин, А.К.Селивановский, Т.Т.Федулова и др. // Цветные металлы. 2012. № 3. C. 31-34.
- Михайличенко А.И. Редкоземельные металлы / А.И.Михайличенко, Е.Б.Михлин, Ю.В.Патрикеев. М.: Металлургия, 1987. 232 с.
- Патент № 2225892 РФ. Способ извлечения редкоземельных элементов из фосфогипса / Э.П.Локшин, Ю.А.Вершкова, В.Т.Калинников и др. Опубл. 20.03.2004. Бюл. № 8.
- Патент № 2293781 РФ. Способ извлечения редкоземельных элементов из фосфогипса / Э.П.Локшин, В.Т.Калинников, К.Г.Ивлев и др. Опубл. 20.02.2007. Бюл. № 5.
- Переработка отвального шлама глиноземного производства с извлечением скандиевого концентрата / И.Н.Пягай, В.Л.Кожевников, Л.А.Пасечник, В.М.Скачков // Записки Горного института. 2016. Т. 218. С. 225-232.
- Рябухин А.Г. Структурные характеристики карбонатов двухзарядных катионов ЩЗМ и 3d-элементов (Mn-Zn) / А.Г.Рябухин, О.Н.Груба // Вестник Южно-Уральского государственного университета. Cерия: Химия. 2010. № 31. С. 83-89.
- Савельева И.Л. Редкоземельная промышленность России: современное состояние, ресурсные условия развития // География и природные ресурсы. 2011. № 1. С. 122-129.
- Сарычев Г.А. Освоение сырьевых и техногенных источников редкоземельных металлов, программный метод и комплексный подход к созданию производственных РЗМ-мощностей / Г.А.Сарычев, М.Н.Стриханов // Цветные металлы. 2012. № 3. С. 45-52.
- Сизяков В.М. Технология комплексной переработки фосфогипса конверсионным способом с получением сульфата аммония, фосфомела и новых продуктов / В.М.Сизяков, С.В.Нутрихина, Б.В. Левин // Записки Горного института. 2012. Т. 197. С. 239-244.
- Фосфогипс и его использование / В.В.Иваницкий, П.В.Классен, А.А.Новиков и др. М.: Химия, 1990. 221 c.
- Черемисина О.В. Кинетика кристаллизационных процессов соединений редкоземельных металлов на затравочных фазах // Цветные металлы. 2009. № 10. С. 47-52.
- Al-Thyabat S. REE extraction from phosphoric acid, phosphoric acid sludge, and phosphogypsum / S.Al-Thyabat, P.Zhang // Journal of Mineral Processing and Extractive Metallurgy. Transactions of the Institutions of Mining and Metallurgy: Section C. 2015. Vol. 124. Iss. 3. P. 143-150. DOI: 10.1179/1743285515Y.0000000002
- Azimi G. Modelling of Calcium Sulphate Solubility in Concentrated Multi-Component Sulphate Solutions / G.Azimi, V.Papangelakis // Fluid Phase Equilibria. 2017. Vol. 260. Iss. 2. P. 300-315. DOI: 10.1016/j.fluid.2007.07.069
- Evaluation of the recovery of Rare Earth Elements (REE) from phosphogypsum waste – case study of the WIZÓW Chemical Plant (Poland) / J.Kulczyckaa, Z.Kowalskib, M.Smolc, W.H.Herbert // Journal of Cleaner Production. 2016. Vol. 113. P. 345-354. DOI: 10.1016/j.jclepro.2015.11.039
- Experimental study of enhanced phosphogypsum carbonation with ammonia under increased CO2 pressure / Hongtao Zhao, Huiquan Li, Weijun Bao et al. // Journal of CO2 Utilization. 2014. Vol. 11. P. 10-19. DOI: 10.1016/j.jcou.2014.11.004
- Hydrobiological characteristics of ponds collecting effluents from a phosphogypsum tip of the Police chemical works near Szczecin / B.Szlauer, M.Szwanenfeld, H.W.Jakubiec, K.Kolasa // Acta Hydrobiologica. 1990. Vol. 32. P. 27-34.
- Jarosinski A. Development of the Polish wasteless technology of apatite phosphogypsum utilization with recovery of rare-earths / A.Jarosinski, J.Kowalczyk, C.Mazanek // Journal of Alloys and Compounds. 1993. Vol. 200. Iss. 1-2. P. 147-150. DOI: 10.1016/0925-8388(93)90485-6
- Johannesson K.H. Rare-earth element geochemistry of Colour Lake, an acidic freshwater lake on Axel Heiberg Island, Northwest Territories, Canada / K.H.Johannesson, W.B.Lyons // Chemical Geology. 1995. Vol. 119. Iss. 1-4. P. 209-223. DOI: 10.1016/0009-2541(94)00099-T
- Kolokolnikov V.A. Processing Rare-Earth Element Concentrate Obtained from Phosphogypsum / V.A.Kolokolnikov, M.I.Kovalev // Chemistry for Sustainable Development. 2009. Vol. 17. P. 261-266.
- Kouraim M.N. Leaching of Lanthanides from Phosphogypsum Waste using Nonyl Phenol Ethoxylate Associated with HNO3 and HCl / M.N.Kouraim, M.M.Fawzy, O.S.Helaly // International Journal of Sciences: Basic and Applied Research. 2014. Vol. 16. № 2. P. 31-44.
- Leaching of Lanthanides from phospho-hemihydrate with nitric acid / E.P.Lokshin, Y.A.Vershkova, A.V.Vershkov, O.A.Tareeva // Russian Journal of Applied Chemistry. 2002. Vol. 75. P. 1753-1759. DOI: 10.1023/A:1022285330832
- Mineral carbonation of flue gas desulfurization gypsum for CO2 sequestration / Myung gyu Lee, Young Nam Jang, Kyung won Ryu et al. // Energy. 2012. Vol. 47. Iss. 1. P. 370-377. DOI: 10.1016/j.energy.2012.09.009
- Mulopo J. Phosphogypsum Conversion to Calcium Carbonate and Utilization for Remediation of Acid Mine Drainage / J.Mulopo, D.Ikhu-Omoregbe // Chemical Engineering and Process Technology. 2012. Vol. 3. Iss. 2. P. 1-6. DOI: 10.4172/2157-7048.1000129
- Ohta A. Rare earth element partitioning between Fe oxyhydroxide precipitates and aqueous NaCl solutions doped with
- NaHCO3: Determinations of rare earth element complexation constants with carbonate ions / A.Ohta, I.Kawabe // Geochemical Journal. 2000. Vol. 34. Iss. 6. P. 439-454. DOI: 10.2343/geochemj.34.439
- Parreira A.B. Influence of Portland cement type on unconfined compressive strength and linear expansion of cement-stabilized phosphogypsum / A.B.Parreira, A.R.K.Kobayashi Jr, O.B.Silvestre // Journal of Environmental Engineering. 2003. Vol. 129. P. 956- 960. DOI: 10.1061/(ASCE)0733-9372(2003)129:10(956)
- Pérez-Moreno S.M. CO2 sequestration by indirect carbonation of artificial gypsum generated in the manufacture of titanium dioxide pigments / S.M.Pérez-Moreno, M.J.Gázquez, J.P.Bolívar // Journal of Chemical Engineering. 2015. Vol. 262. P. 737-746. DOI: 10.1016/j.cej.2014.10.023
- Powell R.E. The Entropy of Aqueous Solutes / R.E.Powell, W.M.Latimer // Journal of Chemical Physics. 1951. Vol. 19. № 1139. DOI: 10.1063/1.1748492
- Preparation of load-bearing building materials from autoclaved phosphogypsum / Jiakuan Yang, Wanchao Liu, Lili Zhang, Bo Xiao // Construction and Building Materials. 2009. Vol. 23. Iss. 2. P. 687-693. DOI: 10.1016/j.conbuildmat.2008.02.011
- Preston J.S. The recovery of a mixed rare-earth oxide and the preparation of cerium, europium and neodymium oxides from a South African phosphoric acid sludge by solvent extraction / J.S.Preston, P.Du // Mineral Processing and Extractive Metallurgy Revue. 1988. Vol. 18. Iss. 2. P. 175-200. DOI: 10.1016/0304-386X(95)00067-Q
- Rare Earths Concentration from Phosphogypsum Waste by Two-Step Leaching Method / I.Hammas-Nasri, K.Horchani-Naifer, M.Férida, D.Barca // International Journal of Mineral Processing. 2016. Vol. 149. P. 78-83. DOI: 10.1016/j.minpro.2016.02.011
- Reijnders L. Cleaner phosphogypsum, coal combustion ashes and waste incineration ashes for application in building materials: A review // Building and Environment. 2007. Vol. 42. Iss. 2. P. 1036-1042. DOI: 10.1016/j.buildenv.2005.09.016
- Rutherford P.M. Environmental impacts of phosphogypsum / P.M.Rutherford, M.J.Dudas, R.A.Samek // The Science of the Total Environment. 1994. Vol. 149. Iss. 1-2. P. 1-38. DOI: 10.1016/0048-9697(94)90002-7
- Rutherford P.M. Heterogeneous distribution of radionuclides, barium and strontium in phosphogypsum by-product / P.M.Rutherford, M.J.Dudas, J.M.Arocena // Science of the Total Environment. 1996. Vol. 180. Iss. 3. P. 201-209. DOI: 10.1016/0048-9697(95)04939-8
- Shannon R.D. Effective ionic radii and crystal chemistry / R.D.Shannon, C.T.Prewitt // Journal of Inorganic and Nuclear Chemistry. 1970. Vol. 32. Iss. 5. P. 1427-1441. DOI: 10.1016/0022-1902(70)80629-7
- The recovery of rare earth oxides from a phosphoric acid by-product. Part1: Leaching of rare earth values and recovery of a mixed rare earth oxide by solvent extraction / J.S.Preston, P.M.Cole, W.M.Craig, A.M.Feather // Hydrometallurgy. 1996. Vol. 41. Iss. 1. P. 1-19. DOI: 10.1016/0304-386X(95)00051-H
- Vlasjan S.V. Producing calcium nitrate and rare-earth element concentrates by phosphogypsum conversion / S.V.Vlasjan, N.D.Voloshin, A.B.Shestozub // Chemical Technology. Technology of inorganic materials. 2013. Vol. 64. № 2. P. 58-62. DOI: 10.5755/j01.ct.64.2.6024
- Walawalkar M. Sustainable Processing of Phosphogypsum Waste Stream for the Recovery of Valuable Rare Earth Elements / M.Walawalkar, C.K.Nichol, G.Azimi // REWAS. 2016. P. 107-112. DOI: 10.1007/978-3-319-48768-7_16
- Yu-Ran Luo. Carbonate complexation of yttrium and the rare earth elements in natural waters / Yu-Ran Luo, R.H.Byrne // Geochimica et Cosmochimica Acta. 2004. Vol. 68. Iss. 4. P. 691-699. DOI: 10.1016/S0016-7037(03)00495-2
- Zhang P. 2014 Comprehensive Recovery and Sustainable Development of Phosphate Resources // Procedia Engineering. 2014. Vol. 83. P. 37-51. DOI: 10.1016/j.proeng.2014.09.010
