Повышение эффективности извлечения РЗМ из технологических растворов в процессе переработки апатитового сырья
- 1 — канд. хим. наук ассистент Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 2 — д-р техн. наук заведующий кафедрой Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 3 — лаборант Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary
- 4 — лаборант Санкт-Петербургский горный университет ▪ Orcid
Аннотация
Вопросы комплексной переработки минерального сырья актуальны вследствие обеднения имеющихся сырьевых запасов и с возможностью использования технологических отходов, которые образуются в процессе переработки сырьевых источников, для получения ценных компонентов. В технологической схеме переработки апатитового концентрата сернокислотным способом образуется большое количество фосфогипса со средним содержанием легких редкоземельных металлов (РЗМ) 0,032-0,45 %. При обработке фосфогипса растворами серной кислоты часть РЗМ переходит в сульфатный раствор, из которого возможно проводить их извлечение с применением ионообменного способа. В работе изучен сорбционный процесс извлечения легких РЗМ (празеодима, неодима и самария) в виде анионных сульфатных комплексов состава [Ln(SO4)2]– на полистирольном анионите АН-31. Исследования проводились в статических условиях при соотношении жидкой и твердой фаз 1:1, рН 2, температуре 298 K и исходной концентрации РЗМ в растворах от 0,83 до 226,31 ммоль/кг. Термодинамическое описание изотерм сорбции проводилось методом, основанным на линеаризации уравнения действующих масс, модифицированным для реакции ионного обмена. В результате проведенных расчетов получены значения констант ионообменного равновесия для Pr, Nd, Sm, а также значения изменения энергии Гиббса для процесса ионного обмена сульфатных комплексов РЗМ на анионите АН-31 и значения полной емкости анионита. Рассчитанные коэффициенты разделения свидетельствуют о низкой селективности анионита АН-31 для легких РЗМ, однако анионит может использоваться для эффективного извлечения суммы легких РЗМ. На основании среднего значения константы ионообменного равновесия легких РЗМ рассчитаны параметры сорбционной установки с псевдоожиженным слоем анионита.
Введение
В настоящее время вопросы комплексной переработки минерального сырья актуальны из-за обеднения имеющихся сырьевых запасов и необходимости использования технологических отходов, таких как фосфогипс, красные шламы [10, 15, 16] и др., а также возможности попутного извлечения ценных компонентов без нарушения основных производственных технологических схем.
Стратегически важными для Российской Федерации являются редкоземельные металлы (РЗМ), которые широко применяются в таких наукоемких отраслях как лазерная техника, медицина, автомобилестроение и электроника [6].
При оценке стран-поставщиков РЗМ на мировой рынок за третий квартал 2020 г. лидируют Китай с долей 33,04 %, Япония – 19,19 % и США – 11,7 %, в то время как РФ поставляет на мировой рынок только 6,4 %. По доле продаж РЗМ на мировом рынке в третьем квартале 2020 г. Россия имеет 1,58 % [13].
К промышленному редкоземельному сырью относят монацит, бастнезит, эвксенит и лопарит [7]. Одним из способов переработки концентратов, содержащих РЗМ, является сернокислотное выщелачивание, в результате которого образуются сульфатные растворы [24]. В сернокислотных растворах РЗМ находятся в виде катионных комплексов, однако при уменьшении концентрации H+ в растворе и увеличении концентрации сульфат-ионов становится возможным образование анионных комплексов РЗМ [20].
Одним из альтернативных источников получения РЗМ является фосфогипс, образующийся в больших количествах при переработке апатитового концентрата по сернокислотной технологии. При выщелачивании серной кислотой фосфогипса, в котором содержится ~0,32-0,45 % преимущественно легких РЗМ, часть из них переходит в сульфатный раствор. Усредненный химический состав фосфогипса: SO3 – 44,07, CaO – 32,04, Fe2O3 – 1,02, Фториды – 0,20, H2O – 18,00, Al2O3 – 0,40, SiO2 – 1,93, P2O5(общ) – 1,49, Ln2O3 – 0,65, TiO2 – 0,20 %.
Основными способами получения РЗМ и других металлов из различных сырьевых источников являются экстракционные [1, 14, 25], сорбционные [11, 21, 26] и осадительные [4, 29] процессы. Сорбционные методы часто применяют для извлечения элементов из сложносолевых многокомпонентных растворов. Использование того или иного метода обуславливается условиями проведения процессов и общей технологической схемой производства [3].
В процессе переработки сырья, содержащего РЗМ, широко используют растворы серной кислоты, в которых РЗМ при высокой концентрации сульфат-ионов находятся в виде анионных комплексов второй ступени координации. Извлечение РЗМ в виде сульфатных комплексов с помощью ионообменных смол недостаточно широко описано в литературе. Вместе с тем, перевод РЗМ в анионные комплексы позволит повысить эффективность их извлечения, что обосновывает актуальность настоящего исследования.
Извлечение РЗМ с применением катионообменных смол
Авторами работы [32] показана возможность использования макропористой сильнокислой катионообменной смолы SQS-6 в качестве адсорбента для лантана и неодима из фосфорнокислых сред. Исследованы различные параметры, влияющие на сорбцию этих металлов: отношение объема раствора к массе ионообменной смолы, концентрация кислоты и иона металла. Установлено, что состояние равновесия наступает через 10 мин, процесс является спонтанным, эндотермическим и сопровождается увеличением энтропии. Результаты адсорбции редкоземельных металлов согласуются с моделью изотермы Ленгмюра во всем исследованном диапазоне концентраций. Десорбцию La(III) и Nd (III) проводили с использованием 1,0 M раствора лимонной кислоты при рН 4. Сорбционная емкость смолы SQS-6 для лантана и неодима составила 33,55 и 17,3 мг/г соответственно.
Сильнокислая катионообменная смола Lewatit MDS 200H была использована для извлечения и разделения редкоземельных элементов (РЗЭ) из растворов, аналогичных по составу кислотным стокам шахт, авторами работы [22]. Эксперименты по сорбции проводили в колонках при рН 3,5; исходный раствор содержал 3,13 ммоль/л РЗЭ (La, Pr, Nd, Sm, Eu, Gd, Dy, Er), 1,17 ммоль/л примесей Al, Ca, Mg и 11,6 моль/л сульфат-аниона. Элюирование адсорбента проводилось с использованием 0,02 моль/л NH4ЭДТА (этилендиаминтетраацетат аммония). Элюат содержал 39,0 ммоль/л РЗЭ и 2,79 ммоль/л примесей металлов.
Авторами работы [23] изучено сорбционное извлечение ионов лантана, железа (III), алюминия и кальция из растворов фосфорной кислоты макропористым сульфокатионитом MTS 1600 в динамических условиях. Установлено, что кальций подавляет сорбцию лантана и других элементов: в его присутствии динамическая обменная емкость сорбента по лантану снижается с 53,5 до 11,8 г/л, а по железу и алюминию стремится к нулю. При элюировании ионов лантана и кальция раствором нитрата аммония максимальная концентрация ионов составила 5,5 и 9,5 г/л соответственно. Соотношение концентраций кальция и лантана в элюате оказалось в два раза выше, чем в исходном растворе фосфорной кислоты.
В работе [18] изучена сорбция лантана и церия на хелатирующих ионообменных смолах M4195, TP207 и XUS43605 с тремя различными функциональными группами. Авторами оценено влияние рН и массы смолы на величину ее емкости, изучена термодинамика адсорбции, а также применены различные кинетические модели. Экспериментально установлено, что процесс носит спонтанный и эндотермический характер.
Влияние сульфатных и хлоридных сред на адсорбцию редкоземельных элементов сильнокислыми и иминодиуксуснокислыми смолами изучено в работе [27]. Для сильнокислой смолы Lewatit MonoPlus SP 112 с сульфокислотными функциональными группами константы адсорбции для La, Sm и Er в растворах MgSO4 были значительно ниже по сравнению со значениями, полученными при использовании раствора MgCl2. Было установлено, что на эффективность извлечения Sm из 0,5 М раствора MgSO4 не влияет изменение рН раствора в диапазоне от 1 до 3. Для имидоуксуснокислой смолы Purolite S930Plus выявлено аналогичное значительное снижение констант адсорбции La в растворе MgSO4 по сравнению с раствором MgCl2, что привело к значительному сдвигу в сторону более высокого значения рН. Для обеих смол снижение адсорбционной способности к РЗЭ в сульфатном растворе также привело к снижению селективности РЗЭ по отношению к ключевым примесным ионам. Например, селективность сильнокислой смолы по отношению к Sm в присутствии Al была более чем вдвое снижена в растворе MgSO4 по сравнению с MgCl2, в то время как селективность смолы иминодиуксусной кислоты по отношению к La в присутствии Mg снизилась на порядок в растворе MgSO4 по сравнению с MgCl2.
Извлечение РЗМ с применением различных сорбентов
Для отделения легких редкоземельных элементов (Ce, La, Nd) авторами работы [33] предложено использование ряда нанокомпозитных адсорбентов с различным соотношением магнетита и технического углерода. Установлено, что наибольшая величина сорбции достигается при соотношении: 20 % Fe3O4, 80 % С, и составляет 370 мг/г при начальной концентрации металлов 250 ppm и рН 7. Изотермы сорбции, полученные для наиболее эффективного материала, адекватно описывают модель Ленгмюра. Рассчитанные термодинамические параметры указывают на эндотермический и необратимый механизм хемосорбции.
В качестве адсорбента для извлечения РЗЭ из сточных вод авторами работы [31] был синтезирован криогель на основе оксида графена и N-изопропилакриламид-малеиновой кислоты GO/P(NIPAM-MA). Равновесная адсорбционная емкость для La3+ составила 33,1 мг/г. Использование модели Ленгмюра обуславливает высокие коэффициенты корреляции экспериментальных данных, характеризующих однородную адсорбцию РЗМ на поверхности адсорбента. Использование материала показало преимущественную адсорбцию La3+ по сравнению с Cu2+, Co2+ , Ni2+, Nd3+, Yb3+, что свидетельствует о высокой селективности синтезируемого адсорбента по отношению к лантану.
В работе [19] исследованы сорбционные свойства нового полимера, полученного гидролизом поли(диэтил-6-(акриламидо)гексилкарбамоилметилфосфоната). Экспериментально была определена максимальная емкость Qmax, которая составила 1,5 ммоль/г. По уравнению Ленгмюра были рассчитаны параметры Qmax и значение константы равновесия KL, которые составили 1,72 ± 0,067 ммоль/г и 0,302 ± 0,063 л/моль соответственно. Установлено, что емкость адсорбента зависит от различных параметров: исходной концентрации металлов, массы сорбента, рН и ионной силы. Исследование показало, что полимер селективен по отношению к гадолинию в смесях Gd/Ni.
В качестве эффективного адсорбента для извлечения ионов Ce(III) авторами работы [34] предложено использование гранул ксантатированного хитозана (КС). Были исследованы факторы, влияющие на эффективность адсорбции Ce(III), а именно рН раствора, скорость перемешивания, соотношение фаз и время контакта. Согласно полученным результатам, оптимальными условиями проведения процесса являются: температура 300 К, рН 4, масса адсорбента 0,02 г. Время достижения равновесия вне зависимости от начальных концентраций металла составило 10 мин. Кинетические исследования показали, что лимитирующей стадией процесса является хемосорбция. С применением модели Ленгмюра авторами работы была рассчитана величина предельной сорбции, которая составила 555,6 мг/г при оптимальных условиях проведения процесса. Энтальпия и энтропия сорбции составили –6,18 кДж/моль и 130,36 Дж/моль∙K соответственно. Адсорбция Ce (III) осуществляется за счет ионного обмена и комплексообразования.
Авторами работы [28] разработан адсорбент на основе хитозана, модифицированный полиэтиленимином, для извлечения редкоземельных элементов из растворов выщелачивания бокситов, которые характеризуются низким рН, невысокой концентрацией РЗЭ и присутствием других трехвалетных ионов. Доказана эффективность применения полученного материала для отделения La(III) от Al(III), коэффициент разделения составил 3,1. Величина предельной адсорбции La(III) в отсутствии примесного компонента составила 2,015 ммоль/г. В бинарных системах La(III) показал преимущественную адсорбцию за счет образования хелатных соединений с материалом. Адсорбент пригоден для повторного использования с эффективностью регенерации 90 % после четырех циклов адсорбции-десорбции.
Постановка проблемы
Переработка побочных продуктов и отходов химических производств для извлечения ценных компонентов является решением проблем рационального и экологически эффективного использования минеральных ресурсов [2, 5]. На производстве предприятия «ФосАгро» ежегодно образуется большое количество фосфогипса, который является основным отходом производства фосфорных удобрений в процессе переработки апатитовой руды [17]. В настоящее время переработка фосфогипса ведется в недостаточном объеме, что наносит существенный урон окружающей среде [30]. В процессе переработки отходов промышленности целесообразно проводить попутное извлечение ценных компонентов, таких как РЗМ, что позволит обеспечить получение металлов без изменения основной технологической схемы производства [9].
Применение анионообменных смол позволяет выделять РЗМ из растворов сложносолевого состава и отделять их от сопутствующих примесных компонентов, таких как железо и кальций, которые содержатся в фосфогипсе и других сырьевых источниках РЗМ [12].
Выделение металлов из растворов проводится с применением сорбционных аппаратов в процессе переработки сырья. Для непрерывных процессов адсорбции и ионного обмена применяются аппараты с псевдоожиженным слоем сорбента [8]. Расчет ионообменной установки предполагает получения основных размеров сорбционного аппарата, который основывается на использовании значений констант сорбционного равновесия, полученных экспериментально по изотермам сорбции равновесных параметров.
В работе изучено сорбционное извлечение празеодима, неодима и самария из сульфатных растворов в виде анионных комплексов с целью определения значения константы ионообменного равновесия, на основании которой проведен технологический расчет ионообменной аппарата с псевдоожиженым слоем анионита АН-31 для извлечения легких РЗМ.
Методология
Извлечение неодима, празеодима и самария проводилось из сульфатных растворов в виде анионных комплексов $[\mathrm{Ln{(SO_4)}_2]^-}$ [20] на анионообменной смоле АН-31 (Россия). Перед экспериментом анионит переводили в сульфатную форму.
АН-31 представляет собой гелевый анионит с полистирольной матрицей, сшитой дивинилбензолом (ДВБ), с активными функциональными группами вторичных и третичных аминов. Средний размер гранул 0,3-1,25 мм, обменная емкость по Cl–, согласно сертификату, составляет не менее 1,28 экв/кг.
Анионит АН-31 – широко распространенная и доступная ионообменная смола, обладающая невысокой стоимостью, что является немаловажным при дальнейшем внедрении предлагаемого способа извлечения РЗМ в технологическую цепочку предприятия. Проведенные ранее исследования на других анионообменных смолах, таких как D-403 [20], Cybber EV009 и др., показывают невысокие степени извлечения и приводят к необходимости изучения новых ионообменных смол для промышленного применения.
Сорбцию проводили в статических условиях при температуре 298 K в течении 5-6 ч в термостатированном перемешивающем шкафу GFL (Германия) при постоянном фоновом содержании сульфат-ионов 1 моль/кг, концентрация РЗМ в растворах составляла от 0,83 до 226,31 ммоль/кг. Содержание РЗМ в растворе определяли спектрофотометрическим методом с арсеназо III и рентгенофлуоресцентным анализом с применением Epsilon 3 производства PANanalytical (Нидерланды).
Определение оптимальных условий проведения извлечения РЗМ
Для определения кислотности среды для проведения процесса сорбции оценили степень извлечения РЗМ из растворов при рН от 1 до 4 и соотношении твердой и жидкой фаз 1:1 (10 см3 анионита и 10 мл раствора). Полученные зависимости степени извлечения от рН раствора представлены на рис.1, а. Максимальные полученные значения степени извлечения на анионите АН-31 составили для Sm 52,8 % при pH 4 и Pr 59,7 % при рН 2, таким образом оптимальным значением для проведения исследований выбрано pH 2.
Для определения оптимального соотношения жидкой и твердой фазы проведены исследования при рН 2 для соотношений 1:1, 1:5, 1:10, 1:25, 1:50 и 1:100. На рис.1, б представлена зависимость степени извлечения от соотношения фаз для самария и празеодима.
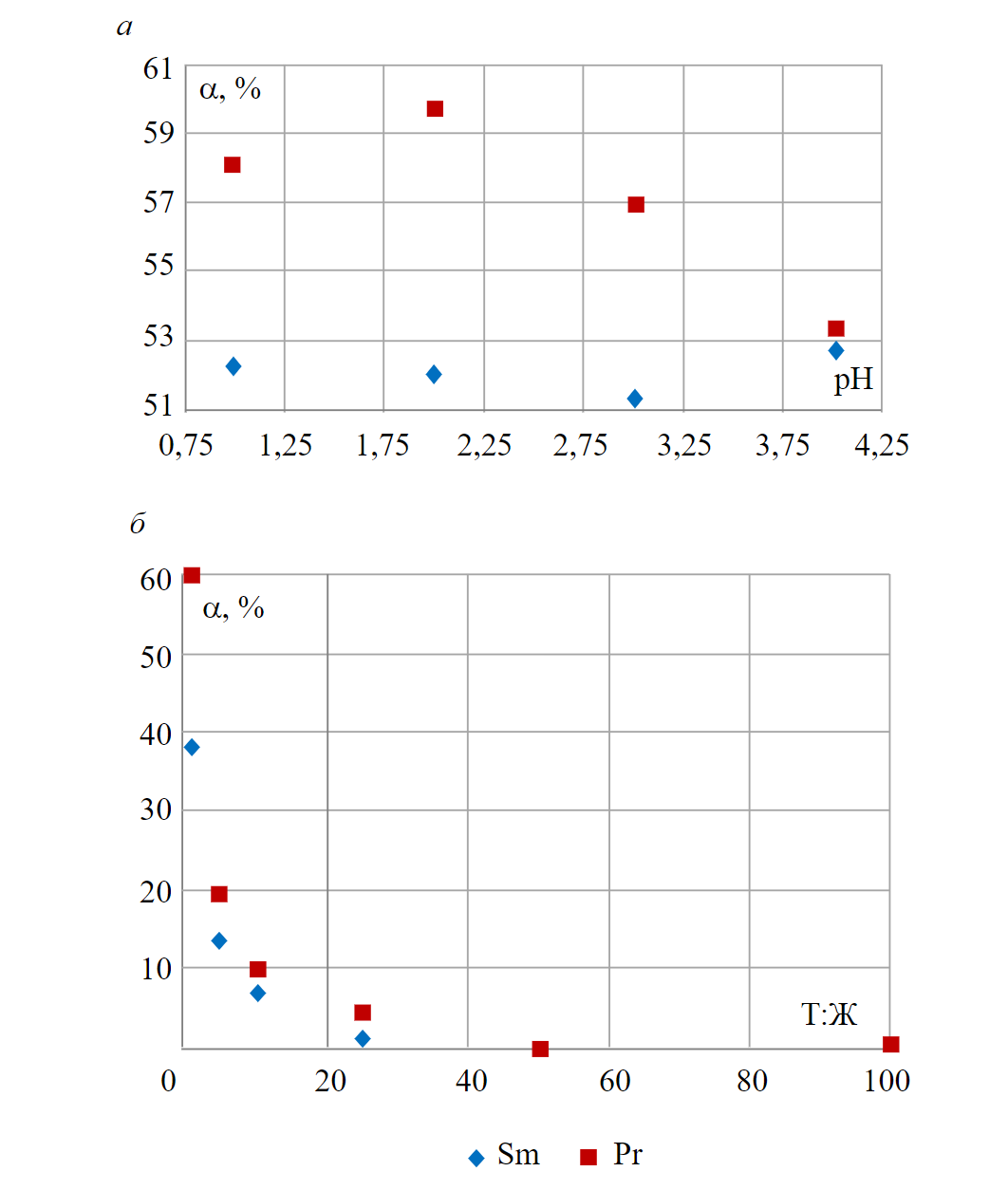
Рис.1. Зависимость степени извлечения самария и празеодима из сульфатных растворов на анионите АН-31 от величины рН исходного раствора (а), от соотношения твердой и жидкой фаз (б)
Степень извлечения на анионите АН-31 при соотношении 1:50 и 1:100 составила не более 0,01 %. На основании экспериментальных данных оптимальным соотношением выбрано 1:1.
Обсуждение
Расчет доли сульфатных комплексов РЗМ второй ступени координации в растворе
Термодинамическим расчетом доказано существование анионных сульфатных комплексов празеодима, неодима и самария в сульфатных растворах [20]. Образование комплексов происходит в две ступени:
Образующиеся комплексы характеризуются константами нестойкости KN1 и KN2, соответственно для реакций (1) и (2):
После математического преобразования получили формулу для расчета доли анионных сульфатных комплексов для РЗМ в растворе:
где $γ\mathrm{Ln(SO_4)}_2^-$, $γ\mathrm{Ln(SO_4)}^+$,$γ\mathrm{(SO_4)}^{2-}_4$ ,$γ\mathrm{Ln}^{3+}$ – коэффициенты активности соответствующих ионов; KN1 = 1,63 ∙10–4; KN2 = 7,72 ∙10–3.
Коэффициенты активности отдельно взятых ионов рассчитывались методом экстраполяции приближенных величин справочных данных Л.Мейтесома.
Полученные значения доли анионных сульфатных комплексов празеодима, неодима и самария составили 99,1-99,4 %.
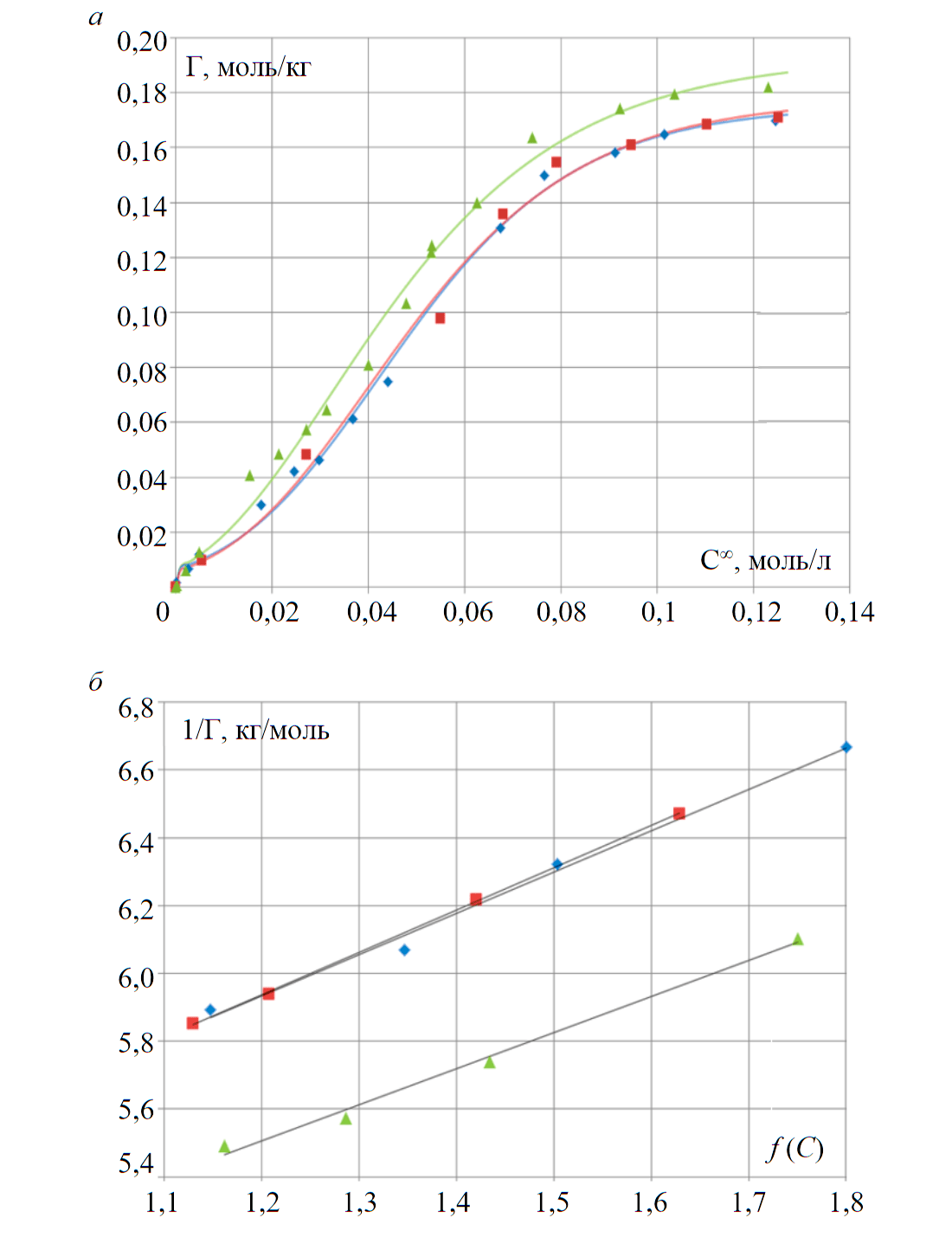
Рис.2. Изотермы сорбции (а) и линейные изотермы (б) празеодима, неодима и самария на анионите АН-31
Определение равновесных параметров сорбции легких РЗМ
Величину сорбции (рис.2, а) рассчитывали по формуле:
где С0 и С∞ – значения исходной и равновесной концентрации РЗМ в растворе, моль/л; V – объем раствора, мл; m – масса анионита, г; ρ – плотность раствора (1,13 г/см3).
Для расчета значений констант ионообменного равновесия и изменения энергии Гиббса на анионите проведено термодинамическое моделирование, основанное на линеаризации уравнения закона действующих масс, модифицированного для уравнения ионного обмена [20]:
Уравнение закона действующих масс для процесса ионного обмена, описываемого уравнением (3), имеет вид:
где $\mathrm{Г_{[Ln(SO_4)_3]^{3-}}}$,$\mathrm{Г_{SO_4^{2-}}}$ – концентрации соответствующих ионов в твердой фазе ионообменной смолы, моль/кг; $\mathrm{γ_{±MgSO_4},γ_{±Mg[Ln(SO_4)_2]_2}}$ – среднеионные коэффициенты активности соответствующих электролитов.
В термодинамической модели имеется допущение об идеальности твердой фазы и, как следствие, значение коэффициентов активности в твердой фазе принято за единицу. Учитывая слабую зависимость среднеионных коэффициентов активности отдельно взятых ионов от их природы, а основную зависимость от заряда и ионной силы, для расчетов значений коэффициентов активности $\mathrm{γ_{±MgSO_4},γ_{±Mg[Ln(SO_4)_2]_2}}$ использовали ,$\mathrm{γ_{±MgCl_2}}$ аппроксимируя справочные данные.
После математического преобразования уравнения закона действующих масс получили следующую линейную форму:
Линейные формы изотерм Pr, Nd и Sm, представленные в координатах значения обратной сорбции $\mathrm{\frac{1}{Г_{Ln(SO_4)_{2^-}}}}$ от концентрационного аргумента , приведены на рис.2, б.
По аппроксимационным уравнениям линейных форм изотерм сорбции, имеющим вид y = kx + b, рассчитаны значения констант ионообменного равновесия K, изменения энергии Гиббса $\mathrm{ΔG_{298}^0}$ и величина полной емкости анионита (табл.1):
где b – свободный член аппроксимационного уравнения линейной формы изотермы; k – тангенс угла наклона.
Таблица 1
Термодинамические характеристики и значение полной емкости анионита АН-31 по отношению к анионным сульфатным комплексам Pr, Nd, Sm
|
РЗМ |
Уравнение аппроксимации |
Коэффициент корреляции R2 |
Константа ионообменного равновесияK |
Изменение энергии Гиббса $\mathrm{ΔG_{298}^0}$, Дж/моль∙К |
Полная емкость сорбента Г∞, моль/кг |
|
Pr |
y = 1,2172x + 4,4729 |
0,9922 |
1,84±0,09 |
1507,16±73,36 |
0,6707±0,0335 |
|
Nd |
y = 1,2487x + 4,4380 |
0,9995 |
1,66±0,08 |
1259,15±62,96 |
0,6760±0,0338 |
|
Sm |
y = 1,0647x + 4,2278 |
0,9926 |
2,32±0,12 |
2082,96±104,15 |
0,7096±0,0355 |
Полученные значения констант ионного обмена и изменения энергии Гиббса согласуются с данными сорбции дисульфатоцеррат-ионов слабоосновным анионитом D-403: K= 1,77 ± 0,06 и ΔrG298 = –1,42 ± 0,06 кДж/моль [20].
Коэффициенты разделения практически близки к единице (D(Sm/Pr) = 1,59; D(Sm/Nd) = = 1,21; D(Nd/Pr) = 1,12), что характерно для низкой селективности анионита по отношению к РЗМ при разделении элементов, однако, отрицательные значения изменения энергии Гиббса показывают эффективность использования анионообменной смолы для извлечения суммы легких РЗМ.
Расчет сорбционного аппарата с псевдоожиженным слоем анионита АН-31
Согласно данным табл.1, определено, что среднее значение константы ионообменного равновесия для ряда легких РЗМ в пределах погрешности составляет 1,94 ± 0,09. Эту величину использовали для технологического расчета ионообменной аппарата.
При расчете аппарата производительность по исходному раствору составляла 1,5 м3/ч. Исходное содержание суммы легких РЗМ в растворе принято равным концентрации после выщелачивания фосфогипса раствором серной кислоты 0,0018 моль/л (0,024 %). Основные исходные параметры для расчета ионообменного аппарата: производительность по исходному раствору V – 1,5 м3/ч; полная емкость сорбента по отношению к исследуемым комплексам Г∞ – 0,6853 моль/кг; средний размер гранулы d – 0,71 мм; насыпная плотность анионита АН-31, ρнас – 557 кг/м3; константа равновесия K – 1,94; исходная концентрация РЗМ в растворе Сн– 0,0018 моль/л; плотность раствора ρ – 1130,0 кг/м3; порозность слоя анионита ε – 0,55.
Процесс ионного обмена является процессом массопереноса, поэтому в расчетах необходимо учитывать основные параметры, такие как критерий Рейнольдса Re = 15,8, на основании которого рассчитали параметр скорости движения жидкости в колонне, критерий Архимеда Ar = 1428,7, массообменный критерий Нуссельта Nu = 29,4. Для определения лимитирующей стадии диффузионного сопротивления рассчитан массообменный критерий Био Bi = 36,9,который показывает, что лимитирующей стадией процесса является внутридиффузионное сопротивление. В табл.2 представлены рассчитанные значения размеров сорбционной колонны и динамические параметры процесса. Для выбора оптимального аппарата проведен расчет односекционной и многосекционной колонны.
Таблица 2
Параметры анионообменного аппарата
|
Параметр |
Колонна |
|
|
Многосекционная |
Односекционная |
|
|
Диаметр аппарата, м |
0,4 |
0,4 |
|
Количество секций, шт |
7 |
1 |
|
Рабочий расход сорбента, кг/ч |
5,1 |
487,3 |
|
Высота псевдоожиженного слоя, м |
0,1 |
0,18 |
|
Высота псевдоожиженного слоя с учетом сепарационной зоны, м |
0,2 |
|
|
Объем псевдоожиженного слоя, м3 |
0,012 |
0,029 |
|
Скорость движения жидкости в колонне, м/с |
0,0033 |
0,0033 |
На основании проведенного расчета рабочий расход сорбента для односекционного аппарата составил 487,3 кг/ч. Для понижения расхода сорбента был проведен расчет седьмого секционного аппарата, что позволило снизить рабочий расход до 5,1 кг/ч. Технологическая схема сорбционного извлечения группы легких РЗМ с применением аппарата с псевдоожиженным слоем анионита АН-31 представлена на рис.3.
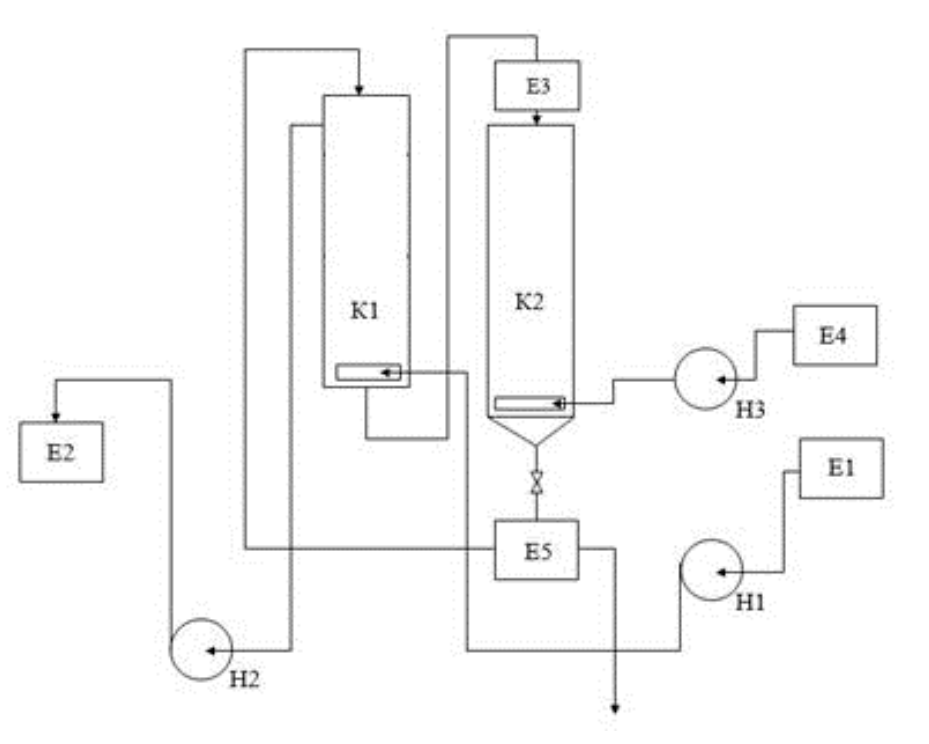
Рис.3. Ионообменная установка E1 – емкость исходного раствора; K1 – анионообменная колонна; K2 – регенерационная колонна; E2 – емкость очищенной воды; E3 – приемник отработанного анионита; E4 – емкость регенерирующего раствора; E5 – приемник регенерированного анионита; H1-H3 – насосы
В технологическом процессе получения легких РЗМ из сульфатных растворов переработки фосфогипса серной кислотой применяется колонна для проведения сорбции К1 и регенерационная колона К2. Исходный раствор после выщелачивания подается в емкость Е1, где проводится его подготовка для сорбционного извлечения РЗМ, а раствор после проведения сорбции отводится в емкость Е2. С применением эрлифта отработанный анионит перемещается в колонну К2, где проводится его регенерация раствором серной кислоты 2 н из емкости Е4. Регенерированный анионит поступает в приемник Е5 и возвращается в колонну К1.
Регенерация анионита АН-31 проводилась раствором серной кислоты концентрацией 2 н двумя способами: в статических и динамических условиях. При проведении исследований в статических условиях порцию анионита (2 см3) заливали 50 мл раствором серной кислоты и оставляли на сутки. В динамических условиях раствор серной кислоты пропускали через слой анионита со скоростью 0,1 об/мин. Оптимальная степень регенерации анионита составила 89 % в статических условиях и 83 % – в динамических. Значение концентрации РЗМ в элюате составило 0,015 моль/л.
Данная технологическая схема позволяет проводить непрерывный процесс извлечения легких РЗМ из сульфатных растворов выщелачивания фосфогипса с применением анионита АН-31.
Заключение
Одним из альтернативных источников группы легких РЗМ является отход производства фосфорных удобрений в процессе переработки апатитового сырья – фосфогипс, в состав которого входит ~0,45 % РЗМ. При обработке фосфогипса раствором серной кислоты часть РЗМ переходит в раствор. При понижении кислотности раствора до значения рН 2 РЗМ образуют анионные сульфатные комплексы с составом [Ln(SO4)2]– c массовой долей 99,1-99,4 % от общего содержания в растворе.
Исследован процесс сорбционного извлечения легких РЗМ на примере празеодима, неодима и самария из сульфатных растворов с применением анионита АН-31 в статических условиях при температуре 298 K, соотношении твердой и жидкой фазы 1:1 и времени контакта 5-6 ч.
Термодинамическое моделирование проведено методом, основанным на линеаризации уравнения закона действующих масс, модифицированным для процессов ионного обмена. Значения констант равновесия, изменения энергии Гиббса и полной емкости для празеодима составили: K = 1,84 ± 0,09, $\mathrm{ΔG^0_{298}=-1507,16±73,36}$ Дж/моль, Г∞ = 0,67 ± 0,03 моль/кг; для неодима: K= 1,66 ± 0,08, $\mathrm{ΔG^0_{298}=-1259,15±62,96}$ Дж/моль, Г∞ = 0,68 ± 0,03 моль/кг и самария: K= 2,32 ± 0,12, $\mathrm{ΔG^0_{298}=-2082,96±104,15}$ Дж/моль, Г∞ = 0,71 ± 0,04 моль/кг.
Полученные значения коэффициентов разделения D(Sm/Pr) = 1,59; D(Sm/Nd) = 1,21; D(Nd/Pr) = 1,12 свидетельствуют о низкой селективности анионита по отношению к индивидуальным РЗМ. Однако в силу высокого значения сорбционной емкости анионообменная смола рекомендована для извлечения суммы легких РЗМ. Среднее значение константы ионообменного равновесия для группы легких РЗМ составило 1,94 ± 0,09, значение полной емкости сорбента 0,6853 ± 0,0343 моль/кг. На основании полученных данных проведен расчет сорбционного аппарата с псевдоожиженным слоем анионита АН-31. Рабочий расход сорбента для односекционной колонны составил 487,3 кг/ч, для семисекционной колонны – 5,1 кг/ч с диаметром 0,4 м.
