Условия кристаллизации хлоридов при скважинной эксплуатации предельно насыщенных литиеносных рассолов на юге Сибирской платформы
- 1 — канд. хим. наук старший научный сотрудник Институт вулканологии и сейсмологии ДВО РАН ▪ Orcid
- 2 — д-р геол.-минерал. наук главный научный сотрудник Институт вулканологии и сейсмологии ДВО РАН ▪ Orcid ▪ Elibrary ▪ Scopus
- 3 — д-р геол.-минерал. наук заведующий лабораторией Институт земной коры СО РАН ▪ Orcid ▪ Elibrary
- 4 — канд. геол.-минерал. наук начальник отдела ООО «Газпром Инвест» ▪ Orcid ▪ Elibrary
- 5 — канд. геол.-минерал. наук старший научный сотрудник ООО «РН-Красноярск НИПИнефть» ▪ Orcid ▪ Elibrary
- 6 — заведующий Аналитическим центром Институт вулканологии и сейсмологии ДВО РАН ▪ Orcid ▪ Elibrary
- 7 — младший научный сотрудник Институт вулканологии и сейсмологии ДВО РАН ▪ Orcid ▪ Elibrary
- 8 — младший научный сотрудник Институт вулканологии и сейсмологии ДВО РАН ▪ Orcid ▪ Elibrary
Аннотация
Рассмотрены условия кристаллизации предельно насыщенных рассолов хлоридов кальция, калия, магния Ангаро-Ленского артезианского бассейна, Сибирская платформа (СП), при температурах, соответствующих фактическим температурным условиям в скважинах Ковыктинского газоконденсатного месторождения участка «Литий». Этот важнейший тип литиеносного сырья отнесен к трудноизвлекаемым запасам. В большинстве скважин глубиной до 2,2 км температура горных пород верхней части геологического разреза ниже 20 °C, и в процессе работы скважины из предельно насыщенных хлоридных магниево-кальциевых рассолов в эксплуатационной колонне выпадают в осадок различные соли. В результате происходит быстрое зарастание скважин и прекращение их продукции. Термодинамический анализ фазовых диаграмм показывает, что в зависимости от температуры кристаллизуются антарктикит CaCl2·6H2O, тахгидрит Mg2CaCl6·12H2O, небольшие количества карналлита KMgCl3·6H2O, бишофита MgCl2·6H2O и некоторых других хлоридов. При температуре выше 55 °C количество выделяющихся солей незначительное. Термогидродинамическое моделирование эксплуатации одиночной фонтанирующей скважины для гидрогеологических условий, близких к условиям Ковыктинской площади на юге СП, показало принципиальную возможность длительной (от месяца до года) эксплуатации предельно насыщенных хлоридно-натриевых и хлоридно-кальциевых литиеносных рассолов с добычей лития от 31,2 до 4,2 т на одну скважину.
Финансирование
Работа выполнена по теме FWME-2024-0007 «Тепломассоперенос, сейсмичность и минеральные преобразования в гидротермальных и вулканических системах, термогидродинамическое-геохимическое-геомеханическое моделирование, приложения для оценки геотермальных ресурсов, прогноза катастрофических гидротермальных процессов, извержений вулканов и сильнейших землетрясений» ИВиС ДВО РАН с использованием ресурсов Центра коллективного пользования «Камчатский центр элементного, минерального, изотопного анализа».
Введение
Литий, являясь стратегически важным элементом при производстве аккумуляторных батарей, используется в атомной энергетике для замкнутого цикла с участием трития и в целом имеет широкое применение. Сравнительно новый промышленный тип литиевого сырья в России – гидроминеральные ресурсы [1, 2], представляющие природные растворы различной концентрации – от солоноватых термальных вод до весьма крепких рассолов, формирование которых связано с эвапориовыми формациями, длительным взаимодействием в системе вода – порода и масштабными наложенными процессами платформенного магматизма [3, 4]. В ходе добычи гидроминерального сырья нередки случаи лавинообразной кристаллизации солей в колоннах скважин, что затрудняет освоение ресурса. Цель настоящего исследования – анализ диаграмм состояния рассола и термогидродинамическое моделирование для обоснования возможности длительной эксплуатации скважин при извлечении литиеносного рассола в условиях предельного насыщения и фактического распределения температуры в стволе скважины с учетом теплообмена с вмещающими горными породами. Рассматриваются решения тестовых демонстрационных задач по солеотложению (галит NaCl, антарктикит CaCl2∙6H2O) при работе одиночной эксплуатационной скважины в режиме свободного фонтанирования с использованием программы TOUGH2-EWASG, расширением области ее применения на предельно насыщенные рассолы хлорида кальция для гидрогеологических условий, близких к Ковыктинской площади на юге Сибирской платформы (СП).
О мировом интересе к добыче лития свидетельствует множество работ, посвященных разведке и оценке запасов, гибридным технологиям извлечения из геотермальных рассолов и растворов [5, 6], например из отработанного теплоносителя скважин на геотермальных месторождениях [7]. Импульс к развитию получили технологии извлечения лития из природных растворов, (салары, морская вода и геотермальные рассолы [8, 9]), промышленных рассолов СП [10, 11].
Гидроминеральное литиевое сырье имеется в ряде стран – на востоке Франции [12], в районе Хаф-Мун восточной провинции Саудовской Аравии [13], в Германии на геотермальной станции Брухзаль [14]. Поисковые работы проведены на территориях Невады и Солтон (Калифорния, США) [15]. Рудное литиевое сырье не теряет своей промышленной актуальности, поэтому ему по-прежнему посвящены научные и научно-практические работы. Например, для понимания генезиса литиевого сырья исследованы тектоно-магматические факторы, контролирующие локализацию литий-фтористых гранитов востока России [16-18] и рудоносность гранитоидных интрузий [19]. Многие исследователи усматривают связь между литиеносными рассолами, геотермальными и вулканическими проявлениями [20, 21]. Механизм формирования литиеносных рассолов на севере Тибетского нагорья с участием геотермальных флюидов приведен в работах [22, 23]. Подробно рассмотрены вопросы взаимодействия гидротермальных систем и самих вулканических структур [24].
Значительную часть мировой добычи лития обеспечивают месторождения миоцен-четвертичной бор-литиевой провинции Южной Америки. Однако нефтяные и газовые резервуары, а также геотермальные растворы могут представлять альтернативный саларам и твердым породам литиевый ресурс [25]. Актуальность переоценки запасов лития [26] в «литиевом треугольнике» оказалась столь велика, что проводятся работы с использованием спутниковых изображений и ряда геологических данных для поиска древних саларов, погребенных под отложениями вулканов [27-30]. Вопросы транспорта и накопления лития в саларах «литиевого треугольника» исследуются в статье [30]. Интерес к концентрированными литиеносным подземным рассолам СП значительно возрос в последние годы [2, 31]. По ресурсной базе литиеносных рассолов гидроминеральная провинция СП (в том числе Иркутская обл. и Западная Якутия) сопоставимы с месторождениями Южной Америки, Китая и Тибета [31]. Из крепких рассолов можно извлекать хлорид, карбонат, фторид, гидроксид лития [11] и ряд других элементов [32]. Комплексная переработка высокоминерализованных крепких рассолов позволит закрыть потребности в магниевом и кальциевом сырье. Интерес к литию возрастает во всем мире, исследования касаются всех аспектов – генезиса, разведки, оценки запасов, извлечения и создания опытных и промышленных производств. Для достижения технологического суверенитета России необходимо на постоянной основе планировать прирост минерально-сырьевой базы лития, в том числе проводить комплексные исследования гидроминерального сырья. Таким образом будет достигнута независимость от внешних поставщиков лития и получена возможность добывать литиевое сырье внутри страны. На пути освоения богатейшего гидроминерального литиевого сырья СП стоит ряд задач и технических проблем, одной из которых является кристаллизация солей в лифтовых колоннах при скважинной добыче высокоминерализованных крепких рассолов. Цель настоящего исследования – применение термогидродинамического моделирования для оценки количества извлекаемого предельно насыщенного рассола из типовой добычной скважины при ее эксплуатации в режиме самоизлива с учетом минералообразования, вызванного теплопотерями при подъеме в зону пониженных температур вмещающих горных пород. Задачи включают анализ химического состава репрезентативной пробы рассола и соответствующих фазовых диаграмм, демонстрационное термогидродинамическое моделирование эксплуатации добычной скважины с фильтрационно-емкостными и теплофизическими параметрами Ковыктинской площади.
Условия залегания весьма крепких и предельно насыщенных рассолов
В Ангаро-Ленском артезианском бассейне бурением обнаружены весьма крепкие и предельно насыщенные промышленные рассолы с очень высокой минерализацией до 630-728 г/л и высоким пластовым давлением до 400-500 бар на глубинах 1800-2200 м [1, 33, 16]. Аномально высокое давление обеспечивает фонтанную эксплуатацию скважин (рис.1), однако отложения солей в обсадной колонне (ОК) приводит к падению дебита. На рис.2 показан температурный профиль добычной скважины по глубине, на большем протяжении температура ниже 20 °C и выделение хлоридов из пересыщенных растворов может носить лавинообразный характер. Температурный градиент составляет около 15 °С/км, а растворимость хлоридов кальция и магния сильно зависит от температуры, в отличие, например, от растворимости хлорида натрия.

Рис.1. Ковыктинская площадь, Ангаро-Ленский артезианский бассейн: а – управляемое фонтанирование глубокой скважины, участок «Литий»; б – солевая пробка из бурильных труб, соли кристаллизуются при нарушении PVT-условий системы (фотографии предоставлены А.Г.Вахромеевым)
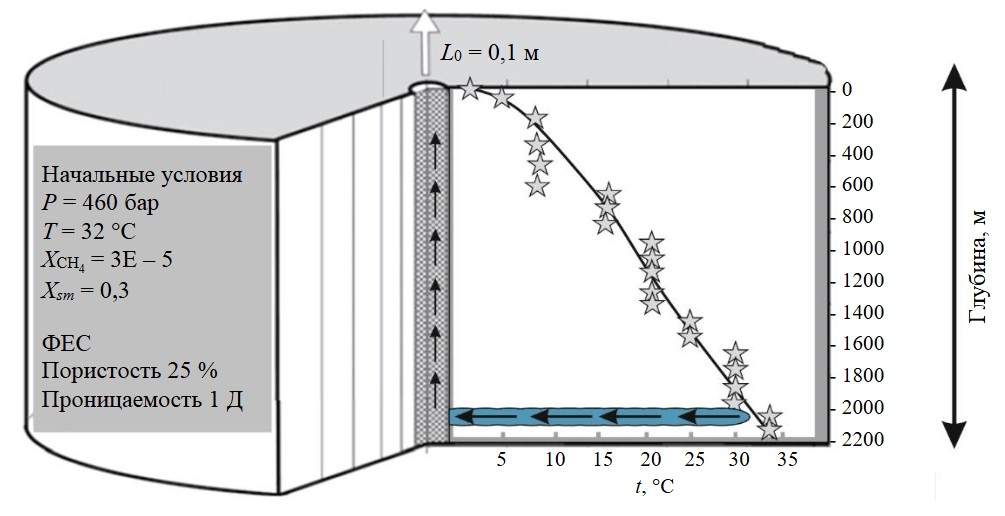
Рис.2. Концептуальная модель скважинной эксплуатации литиеносных предельно насыщенных рассолов, Ковыктинский участок, Ангаро-Ленский бассейн [31] Добычная скважина в асимметричной (RZ) системе координат вскрывает целевой резервуар на глубине 2 км; слева – информация о начальных условиях в целевом резервуаре и его фильтрационно-емкостных свойствах (ФЕС); справа – график изменения температуры с глубиной (звездочки) в покрышке вмещающих горных пород; стрелки – движение рассола из целевого резервуара и вверх по скважине; ХСН4 – массовая доля метана; Хsm – массовая доля соли в растворе
Работы по разведке данного бассейна проводятся с 1960-х годов. В настоящее время в составе проекта геологоразведочных работ (ГРР) на участке недр «Литий» планируется реализовать технологические исследования на опытной установке по добыче рассолов и селективному извлечению лития. На пути решения проблемы добычи лития стоит множество задач, одна из них – это самопроизвольная кристаллизация в обсадной скважине солей [1, 2], что приводит к уменьшению потока и прекращению поступления литиеносных рассолов из скважин. Это основная причина отнесения такого типа сырья к трудноизвлекаемым (ТРИЗ). Отмечено, что кристаллизация солей, забивающих скважины, происходит в пределах оголовка, но может начаться в любом месте при охлаждении рассола до определенных температур. Высокая растворимость солей кальция и магния, в основном антарктикита CaCl2·6H2O, тахигидрита 2MgCl2·CaCl2·12H2O и бишофита MgCl2·6H2O, обеспечивают устойчивое состояние системы в пласте при повышенных температурах 35-40 °С и высоком давлении в залежи. Снижение температуры и давления на устье скважины приводит к самопроизвольной кристаллизации солей, в основном антарктикита с примесью бишофита.
Ковыктинское газоконденсатное месторождение и опытный участок проекта «Литий» находятся в зоне резко континентального климата, где перепад суточных температур воздуха превышает 25 °С, лето жаркое до 38-43 °С, а зимы холодные, зачастую ниже –45 °С. Внешние суточные и сезонные перепады неблагоприятно воздействуют на рассматриваемую хлоридную систему рассол – соли. Многолетняя мерзлота и область низких температур в верхнем интервале геологического разреза осадочного чехла – критически важный фактор снижения температур обсадных и лифтовых колонн скважины и, как следствие, восходящего по стволу потока гидроминерального сырья – ТРИЗ концентрированных рассолов в циклах ГРР и добычи [2], особенно при остановке потока на скважине. При хранении таких рассолов в открытых бассейнах количество выпавших солей в значительной степени зависит от температуры окружающей среды [10]. Для переработки рассолов предварительным этапом может быть естественное охлаждение, сопровождаемое кристаллизацией и перераспределением элементов между кристаллическими фазами и раствором.
Методы исследования химического состава рапы и осадка
Рассмотрена кристаллизация хлоридных солей в скважине при температурах, соответствующих температурному профилю лифтовой колонны. В задачи дальнейших исследований входит создание нестационарных химически-термогидродинамических моделей. Проанализирован состав рассолов из Ковыктинского участка (проект «Литий») для определения содержания лития и макроэлементов – натрия, калия, кальция, магния, и основных анионов – хлорида, сульфата, гидрокарбоната. Рапа представляет высококонцентрированный рассол, поэтому для анализа он был разбавлен в 200 раз с высокоточным контролем степени разбавления.
Образец для анализа отобран с устья фонтанирующей скважины из Ковыктинского участка (проект «Литий»). Условия отбора пробы – на переливе с высоким (более 1000 м3/сут.) дебитом управляемого фонтанирования скважины рассолом. При комнатной температуре он представлял двухфазную смесь, вязкий раствор с кристаллами на дне, причем количественно кристаллы преобладали над раствором. Гомогенизация двухфазной смеси достигалась путем небольшого нагрева до температуры около 40-50 °C, после чего отбирали аликвоту полученной жидкости и переносили в мерную колбу с суммарным разбавлением в 200 раз. По мнению авторов статьи, рассол при фонтанировании до зарастания скважины практически не меняет своего химического состава во время поднятия и проанализированный состав отражает состав насыщенного рассола.
Макрокомпонентный состав исследован на базе Центра коллективного пользования «Камчатский центр элементного, минерального, изотопного анализа» ИВиС ДВО РАН. Содержания кальция и магния определяли методом атомно-абсорбционной спектрометрии с погрешностью 11 % по методике ПНДФ 14:1:2:4.137-98. Литий, натрий, калий, рубидий и цезий – методом пламенно-эмиссионной спектрометрии с неопределенностью 10 %, ПНДФ 14:1:2:4.138-98, с помощью атомно-абсорбционного спектрофотометра Thermo Electron SOLAAR. Железо – по взаимодействию с сульфосалициловой кислотой, вначале находили общее содержание железа, затем только железо (III), по разнице общего и железа (III) определяли железо (II), ПНДФ 14:1:2:4.50-96. Измерения проводились с помощью спектрофотометра UV-Mini-1240 Shimadzu. Содержание хлорид-ионов определяли аргентометрическим методом с неопределенностью 16 %, ПНДФ 14:1:2:3.96-97; сульфат-иона – турбидиметрическим методом с погрешностью 15 %, ПНДФ 14:1:2:159-2000.
Минеральный состав солевого осадка, выпавшего при температуре около 20 °C, исследован с помощью рентгеновского дифрактометра MAX XRD 7000 (Shimadzu) в диапазоне углов гониометра от 6 до 65° 2θ с шагом 0,1° 2θ, скорость сканирования составляла 2 град/мин, что эквивалентно выдержке в точке 3 с. Съемка велась при вращении образца со скоростью 30 об/мин.
Сведения о растворимости в системе KCl–MgCl2–CaCl2–H2O взяты из справочных данных по растворимости в многокомпонентных водно-солевых системах. Пространство состояний системы KCl–MgCl2–CaCl2–H2O при фиксированных температуре и давлении представляет тетраэдр, где вершинам отвечают чистые компоненты, шесть ребер соответствуют двухкомпонентным подсистемам, четыре грани – тройным подсистемам [34-36]. Использованы данные по растворимости в бинарных и тройных подсистемах системы KCl–MgCl2–CaCl2–H2O. В справочниках имеется информация о составе твердых фаз, существующих растворов и температуре. Справочные данные по составу пересчитаны в мольные доли, построены концентрационные треугольники с нанесенными составами твердых фаз и сосуществующих растворов в определенных температурных интервалах. Температурные интервалы выбирались таким образом, чтобы в их пределах не было значимых фазовых переходов.
Влияние давления на кристаллизацию из рассола можно оценить исходя из соотношения молярных объемов или плотностей сосуществующих фаз. Кристаллы солей тонут в собственном насыщенном растворе, поэтому кристаллизация сопровождается уменьшением молярного объема. Увеличение давления будет способствовать кристаллизации, а сброс давления, наоборот, благоприятен для растворения солей. Влиянием давления на равновесие солей с растворами можно пренебречь, так как давление слабо воздействует на процессы в конденсированных средах.
Для удобства представления рассмотрены три тройные подсистемы, в которых одним из компонентов является вода; из-за незначительного содержания в представленной рапе отброшен хлорид натрия. Для построения квазиизотермических сечений свели воедино данные о составе растворов, сосуществующих с кристаллами солей при различных температурах из рассмотренной четверной системы. Составы растворов и твердых фаз выразили в мольных долях, в качестве компонентов взяли соединения KCl, MgCl2, CaCl2, H2O. Для упрощения рассмотрены тройные подсистемы MgCl2–CaCl2–H2O, KCl–CaCl2–H2O, KCl–MgCl2–H2O в определенных температурных интервалах от –35 до 100 °C, а не собственно изотермические разрезы. Полученные результаты соотнесены с реальным составом рапы из добычной скважины, чтобы определить состав солей, которыми зарастает ОК скважины в зависимости от температуры. При построении трехкомпонентной подсистемы MgCl2–CaCl2–H2O количества хлорида калия выбраны как не превышающие содержания в рассоле. В таких пределах хлорид калия не оказывает заметного влияния на положения коннод.
Треугольники состава масштабированы, чтобы были видны поля кристаллизации в области, прилегающей к воде. Необходимо подобрать такие условия, при которых фигуративная точка рапы попадает в поле жидкости. В этом состоянии соли не должны выделяться. При условии попадания фигуративной точки на двухфазную конноду, которая является образцом равновесия кристаллов соли с раствором, чем ближе фигуративная точка рапы к полю жидкости, тем меньшее количество солей выделяется, так как соотношение количеств фаз в равновесии определяется правилом рычага или моментов.
Результаты анализа фазовых диаграмм и термогидродинамического моделирования
Состав рапы
В составе рассола доминируют хлориды кальция, магния, в меньших количествах присутствуют калий и натрий. Благодаря наличию трехвалентного железа раствор окрашен в буро-оранжевый цвет и обладает сравнительно низким pH, так как трехвалентное железо склонно к гидролизу. Содержание в рассоле лития после выпадения солей около 660 мг/л, что в пересчете на LiCl дает около 4 г хлорида. Кроме лития в рассоле присутствуют рубидий и цезий – 4,7 и 13,9 мг/л. В пересчете на соли рассол представленной на анализ пробы содержит 442 г/л CaCl2, 112 г/л MgCl2, 5 г/л KCl. Основные компоненты рассола – хлориды кальция и магния при подчиненных количествах хлоридов калия и натрия. Поэтому следует ожидать кристаллизации доминирующих солей в виде различных соединений, а соли на основе хлоридов калия и натрия будут выделяться в небольшом количестве, которое может и не привести к зарастанию скважин. Состав предельно насыщенного рассола, сосуществующего с осадком, г/л: анионы – Cl– 382,80, 0,45; катионы – Li+ 0,66, Na+ 1,69, K+ 2,49, Ca2+ 159,20, Mg2+ 28,20, Feобщ 1,00, Cs+ 0,014, Rb+ 0,005. Суммарная минерализация – 576,51 г/л; анионы 383,25 г/л; катионы 193,26 г/л. Массовая доля лития в минерализации исходного рассола – 0,114 %.
Состав солевого осадка
Солевой осадок при 20 °C представлен небольшим количеством карналлита при доминировании легкоплавкого антарктикита – шестиводного хлорида кальция (рис.3). Он кристаллизуется при температуре ниже 30 °C, при более высокой температуре постепенно плавится в собственной кристаллизационной воде, может переходить в менее гидратированные формы – тетрагидрат и дигидрат хлорида кальция. Менее растворимыми являются соли калия, магния и их соединение – карналлит. Карналлит сохраняется при температуре плавления антарктикита и, по всей видимости, может кристаллизоваться во внутреннем пространстве скважин, хотя его количество для данного состава рассола небольшое. Тахгидрит с помощью рентгеновской дифрактометрии не обнаружен. Скорее всего, при температуре около 20 °C скважина будет зарастать антарктикитом. При незначительном повышении температуры до 40 °C солевой осадок растворяется практически полностью, в виде взвеси остаются небольшие количества других хлоридов.
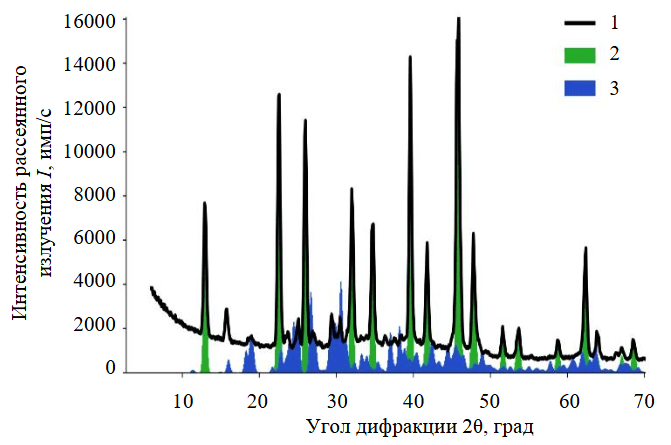
Рис.3. Дифрактограмма солевого осадка, сосуществующего с литиеносным рассолом, при температуре около 20 °C
1 – соль; 2 – антарктикит; 3 – карналлит
Система KCl–MgCl2–CaCl2–H2O
Сопоставлены положения фигуративной точки, отвечающей составу рапы, и полей двухфазных равновесий в разрезах, построенных для различных температурных интервалов (рис.4) при давлении 1 атм. Для гексагидрата CaCl2·6H2O характерна ступенчатая дегидратация с образованием дигидрата и отщеплением воды, с конечным появлением насыщенного раствора (L) тетрагидрата и дигидрата в небольшом температурном интервале 20-45 °C (см. таблицу). Фазовые переходы гексагидрата хлорида кальция могут протекать по метастабильному пути.
В системе KCl–MgCl2–CaCl2–H2O зафиксировано около 20 фаз, включая воду и лед. В таблице показаны те соли, которые могут кристаллизоваться из рапы исследованного состава при температурах от –34 до 100 °C. Соли кальция и магния склонны к образованию гидратов с переменным количеством воды, при повышении температуры вода постепенно отщепляется и кристаллогидраты переходят в менее гидратированные формы. Условно обозначим кристаллогидраты хлорида кальция протяженной областью на ребре CaCl2–H2O. Антарктикит при нагревании переходит в тетрагидрат и дигидрат, его растворимость увеличивается. Аналогично ведет себя хлорид магния – при низких температурах количество кристаллизационной воды доходит до 12, при повышении температуры додекагидрат переходит в октагидрат, гексагидрат и далее в тетрагидрат и тригидрат, но это происходит при более высоких температурах по сравнению с гидратами хлорида кальция. Такое поведение характерно для кристаллогидратов. Особенностью хлоридов кальция и магния может являться сам характер фазового перехода, который совершается по перитектоидному равновесию с выделением жидкости и напоминает плавление в собственной кристаллизационной воде. Для кристаллогидратов при повышении температуры сокращается поле двухфазных равновесий, соответственно уменьшается количество выделяющейся соли, и можно подобрать такие условия, при которых количество выделяющейся соли будет незначительным, не приводя к созданию пробки, либо когда фигуративная точка рапы окажется в поле жидкости.
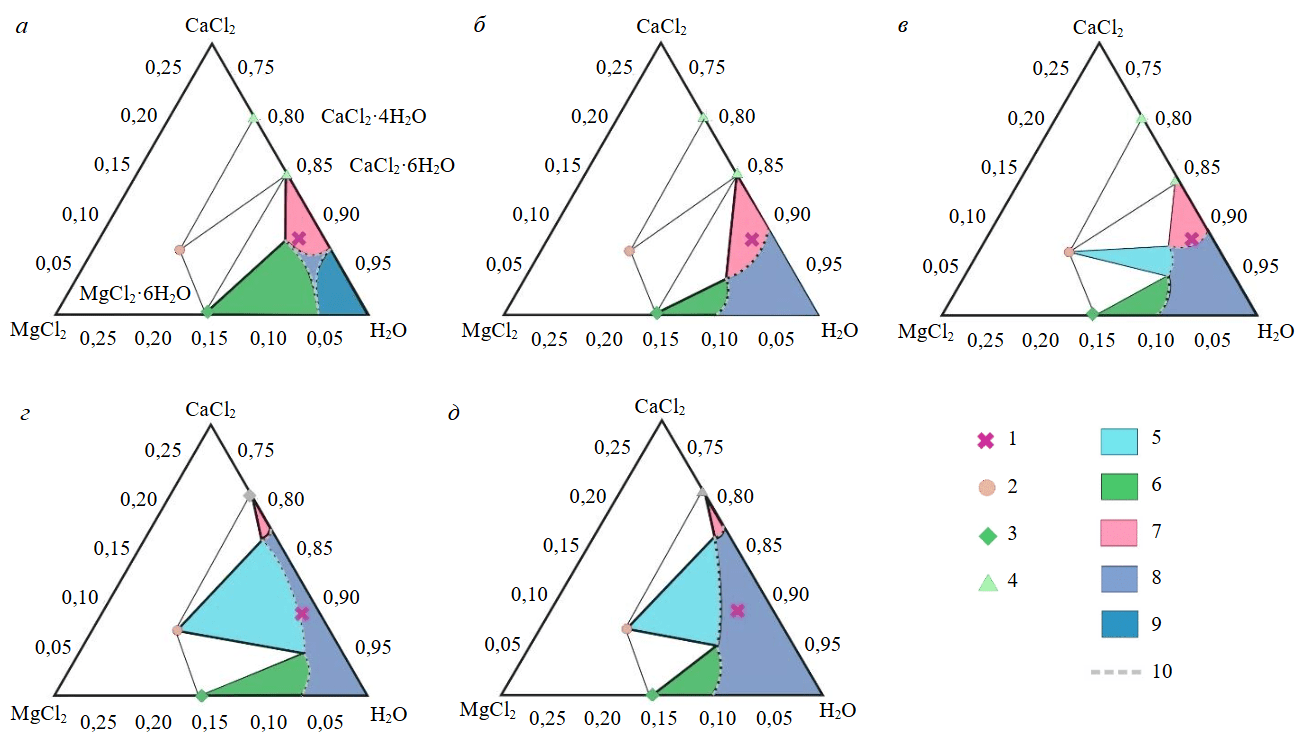
Рис.4. Схема фазовых отношений в тройной подсистеме MgCl2–CaCl2–H2O, температурные диапазон от –35 до 0 °C (а), от 0 до 20 °C (б), от 20 до 30 °C (в), от 30 до 40 °C (г), и свыше 40 °C (д)
1 – состав рапы Ковыткинское; 2 – тахгидрит Mg2CaCl6·12H2O; 3 – гидраты хлорида магния MgCl2·6H2O; 4 – гидраты хлорида кальция CaCl2·6H2O; 5-7 – насыщенные растворы в равновесии с осадком тахгидрита (5), гидратов хлорида магния (6), гидратов хлорида кальция (7); 8 – область жидкого раствора; 9 – лед в контакте с растворами хлоридов; 10 – линия, отделяющая область жидкого раствора от областей двухфазных равновесий. Состав выражен в мольных долях, треугольник состава масштабирован; разнообразие гидратов хлоридов магния и кальция не показано [37]
Фазы системы KCl–MgCl2–CaCl2–H2O [38]
|
Формула (название) |
Равновесия с участием растворов |
t, °C |
|
KMgCl3‧6H2O (карналлит) |
– |
– |
|
MgCl2‧12H2O |
MgCl2‧12H2O ~ 2H2O (лед + L) |
≈ –34 |
|
MgCl2‧12H2O ~ MgCl2‧8H2O + 2H2O (L) |
≈ –17 |
|
|
MgCl2‧8H2O |
MgCl2‧8H2O ~ MgCl2‧6H2O + 2H2O (L) |
≈ –3 |
|
MgCl2‧6H2O (бишофит) |
MgCl2‧6H2O ~ MgCl2‧4H2O + 2H2O (L) |
117 |
|
CaCl2‧6H2O (антарктикит) |
CaCl2‧6H2O ~ CaCl2‧4H2O + 2H2O (L) |
29 |
|
CaCl2‧4H2O (гиараит) |
CaCl2‧4H2O ~ CaCl2‧2H2O + 2H2O (L) |
45 |
|
Mg2CaCl6‧12H2O (тахгидрит) |
Mg2CaCl6‧12H2O ~ Mg2CaCl6‧6H2O + 6H2O (L) |
>55 |
|
Mg2CaCl6‧6H2O |
– |
– |
Среди фаз подсистемы MgCl2–CaCl2–H2O можно выделить две – образование антарктикита CaCl2‧6H2O и тахгидрита Mg2CaCl6·12H2O, которыми наиболее вероятно будут зарастать скважины. Антарктикит относится к низкотемпературной фазе, он стабилен примерно до 29 °C, тахгидрит же фиксируется при температуре выше 20 °C и приходит на смену антарктикиту. Поэтому подбор температурного режима эксплуатации добычной скважины должен учитывать трансформации солей при изменении температуры. Отметим, что для магния характерно большее разнообразие гидратов вследствие большей склонности катиона магния к комплексообразованию, чем для кальция. Поэтому при низких температурах можно ожидать зарастание скважин гидратами хлорида магния с различным содержанием воды и гидратами хлорида кальция, а при более высоких температурах скважинное пространство будет зарастать преимущественно гидратами хлорида кальция или кальция-магния.
Температурный диапазон –35-0 °C
При таком интервале температур из рапы исследованного состава будут кристаллизоваться гидраты хлорида магния и кальция, фигуративная точка рассола лежит в области равновесия бишофита с антарктикитом (рис.4, а). Указанный диапазон температур актуален при эксплуатации скважин в условиях сибирской зимы, когда температура опускается до –40 °C и поступающий на дневную поверхность рассол, охлаждаясь, будет выделять указанные соли, а также карналлит, не показанный на рис.4 ввиду его принадлежности к другой подсистеме. Если хлорид лития будет оставаться и накапливаться в остаточной жидкости – жидкой фазе, то, например, рубидий может замещать калий в карналлите, хлориде калия и других солях калия, концентрируясь в солевом осадке. Перераспределение целевых элементов в ходе фазовых переходов рассола актуально для научно обоснованных технологий комплексного освоения сырья.
Температурный диапазон 0-20 °C
При таких условиях кристаллизуется антарктикит, как видно на рис.4, б, фигуративная точка лежит в поле двухфазной области CaCl2‧6H2O ~ L в подсистеме MgCl2–CaCl2–H2O, причем довольно далеко от границы с раствором. Растворимости рассматриваемых солей сильно зависят от температуры, и при ее изменении заметно смещаются области двухфазных равновесий и ликвидус. Ввиду того, что концентрация хлорида кальция в рассоле высокая, выделение этого минерала может носить лавинообразный характер. Будет выделяться карналлит, так как содержание хлоридов калия и магния отвечает линии насыщения по карналлиту, не показанной на рис.4 ввиду принадлежности к другой подсистеме. Если состав рапы пересчитывать на содержание гидратированных солей, то концентрации карналлита, антарктикита или тахгидрита – 17,7; 871,6; 303,7 г/л соответственно, количество карналлита незначительно на фоне антарктикита или тахгидрита.
Температурный диапазон 20-30 °C
В этом интервале температур шестиводный хлорид кальция – антарктикит – начинает заметно плавиться в собственной кристаллизационной воде (рис.4, в), поле двухфазного равновесия сокращается; начинает выделяться тетрагидрат хлорида кальция, тоже хорошо растворимый. Появляется узкое поле тахгидрита, однако фигуративная точка рапы лежит близко к границе трехфазной конноды тахгидрит – антарктикит – раствор и выделения тахгидрита незначительно. Могут выделяться незначительные количества карналлита, так как его содержание близко к насыщению по карналлиту. И хотя растворимость антарктикита в этом температурном диапазоне возрастает, фигуративная точка рапы лежит в области двухфазного равновесия с заходом в область трехфазного равновесия антарктикит – тахгидрит – раствор, поэтому зарастание скважин весьма ожидаемо.
Температурный диапазон 30-40 °C
В подсистеме MgCl2–CaCl2–H2O фигуративная точка рапы попадает в поле двухфазного равновесия тахгидрита с насыщенным раствором Mg2CaCl × ×12H2O ~ L, а поле кристаллизации тетрагидрата хлорида кальция сокращается, что отвечает увеличению его растворимости (рис.4, г). Тахгидрит приходит на смену антарктикиту, который при данной температуре становится нестабилен, и гиараиту с узким полем двухфазных коннод. Хлорид калия не должен выделяться из рапы данного состава, однако в небольших количествах могут кристаллизоваться карналлит или бишофит, так как в подсистеме KCl–MgCl2–H2O состав рапы близок к насыщению относительно выделения этих минералов.
Температурный диапазон свыше 40 °C
Фигуративная точка рассола лежит в области двухфазного равновесия тахгидрита с его насыщенным раствором (рис.4, д), по остальным хлоридам рапа получается ненасыщенной. Ввиду того, что состав рапы лежит практически на границе однофазной области, отвечающей жидкому раствору, и линии двухфазного равновесия, количество выделяющегося тахгидрита не должно быть большим, так как соотношение фаз определяется правилом рычага и масса жидкого раствора должна значительно превышать массу выделяющегося тахгидрита. Этот температурный диапазон сравнительно удобен для эксплуатации, так как в его пределах зарастание обсадной трубы скважины не должно наблюдаться вследствие небольшого количества выделяющейся соли – тахгидрита, а также выноса выделяющихся кристаллов на поверхность. Допустимо расчетное смешение с горячей пресной технической водой, паром, с порционной подачей в область башмака лифтовых труб.
С повышением температуры поле жидкости увеличивается, и фигуративная точка рапы оказывается в однофазной области раствора. Так же и по остальным хлоридам – нагретая рапа становится ненасыщенной относительно других солей. Это наиболее удобный диапазон температур для эксплуатации лифтовых глубоких скважин, при котором не должно наблюдаться зарастания и падения потока.
Термогидродинамическое моделирование солеоотложения при работе эксплуатационной скважины, уравнения состояния флюида
Постановка задачи, геометрия модели
Показана геометрия радиально-цилиндрической RZ-модели (см. рис.2). Для моделирования систем, содержащих солевые растворы и неконденсирующийся газ [38], применяется программа TOUGH2 с модулем состояния EWASG.
Исходные ФЕС целевого резервуара соответствуют Знаменской площади: глубина 2 км, мощность 2,5 м, пористость 0,25 (25 %), проницаемость 1 Д, начальное давление 300 бар, температура 32 °С, массовая доля СН4 = 3·10–5. В качестве соли на первых этапах моделирования задавался NaCl, хотя в реальных условиях преобладает СаCl2. С практической точки зрения предполагалось, что это обеспечивает запас прочности при обосновании инженерно-технологических решений, так как хлориды натрия выпадают в твердую фазу в первую очередь. Заданная в модели температура 32 °C, измеренная на забое, скорее всего несколько занижена, так как при таких условиях фигуративная точка находится в области сосуществования тахгидрита и его насыщенного раствора. Но для хлорида натрия данное упрощение не является критическим, так как его растворимость слабо зависит от температуры.
На модели начальная массовая доля растворенной соли NaCl автоматически определяется программой TOUGH2 с модулем состояния EWASG по условиям предельного насыщения. В широком температурном диапазоне плотность и вязкость насыщенных растворов хлоридов натрия, кальция и магния близки, поэтому при геофильтрационных расчетах можно опираться на свойства NaCl, поддерживаемые в модуле состояния EWASG программы TOUGH2. Для моделирования существенные отличия хлорида натрия от хлоридов кальция и магния состоят в том, что растворимость NaCl слабо зависит от температуры, и в целом у галита меньшая растворимость, чем у хлоридов магния и кальция.
Моделирование добычи с циклической закачкой горячей воды (тестовая задача 1)
В этой задаче ствол скважины (см. рис.2) не учитывается в явном виде и добыча/закачка определены в режиме циклически действующего массового источника. Целевой резервуар задан в виде диска мощностью 2,5 м и с радиусом 200 м. Вычислительная сетка (RZ) состоит из 100 смежных элементов (NX = 100) с прогрессивно увеличивающимся радиусом. Циклический массовый источник задается в центре модели следующим образом: закачка пресной воды с расходом Q и температурой 100 °С (энтальпией 419 кДж/кг) в диапазонах времени [∆tK, ∆t(K + 1)], откачка рассола с расходом Q в диапазонах времени [∆t(K + 1), ∆t(K + 2)], где ∆t = 1 сут., K = 0, 2, 4, … 364. В течение суток закачивается в скважину горячая вода, затем в течение суток извлекается флюид с тем же расходом, и так происходит в течение года (365 сут.). На внешней границе модели заданы фиксированные граничные условия. Для улучшения перемешивания закачиваемой воды с пластовым рассолом на модели определено повышенное значение гидродисперсии (молекулярной диффузии 0,001 м2/с).
Максимальный возможный расход циклической откачки/закачки определен равным 9,3 кг/с методом многовариантного моделирования из условия недопущения кристаллизации в призабойном пространстве. Суммарная годовая добыча соли NaCl в такой модели оценивается как 8436,7 т, в пересчете на литий 9,6 т, если принять его массовую долю в минерализации исходного рассола 0,114 %.
Моделирование добычи в режиме самоизлива (тестовая задача 2)
В таком варианте моделирования учитывается теплообмен извлекаемого флюида через стенки скважины глубиной 2000 м с вмещающими горными породами. Модель определена на RZ вычислительной сетке с разбиением по радиальному направлению на 100 элементов (NX = 100, как в тестовой задаче 1), а по глубине на 101 элемент (NZ = 100). Целевой резервуар определен в диапазоне глубин от 1977,5 до 2000,0 м, а выше по разрезу – непроницаемые вмещающие породы с заданным распределением температуры. Начальные условия задаются по следующим основным переменным: давлению P, температуре T, насыщению твердой фазой SS (объемной доле твердой соли в поровом пространстве); массовой доле метана XCH4. Начальное распределение температуры задается уравнением
где Z – глубина, м.
Начальное давление задано по гидростатическому закону с максимальным значением 300 бар на глубине 2 км; SS = 0,01 (что автоматически определяет насыщенный раствор хлорида натрия); XCH4 = 3,0·10–7 (т.е. массовая доля СН4 невелика). Добычная скважина определена в режиме самоизлива на устье с индексом продуктивности 1,0·10–12 м3.
Расчетная производительность скважины в течение 3 сут. в данной задаче такова, что максимальный расход достигает 7 кг/с, далее поток стабилизируется на величине 4 кг/с. Зарастание ствола скважины эквивалентно достижению переменной SS значения 1,0 (100 %). На момент времени 237 сут. насыщение твердой фазы SS достигает 1,0 в приустьевой части, т.е. ствол скважины закупоривается соляной пробкой. Таким образом, срок эксплуатации скважины для заданных на модели условий ограничен 237 сут.
Моделирование добычи в режиме самоизлива с учетом снижения проницаемости при зарастании порового пространства (тестовая задача 3)
В этой задаче сохраняются условия предыдущей, но дополнительно учитывается снижение проницаемости продуктивного резервуара при заполнении его трещинно-порового пространства кристаллической солью. Соотношение между количеством высадившейся из раствора твердой фазой и изменением пористости достаточно простое. При этом вклад изменения пористости в изменение проницаемости более сложен. Лабораторные эксперименты показывают, что небольшое изменение пористости может привести к значительным изменениям проницаемости. Это объясняется конвергентно-дивергентной природой поровых каналов, когда сужения пор запечатываются осадком, в то время как в поровом пространстве остаются разъединенные полости [39]. Эффекты снижения проницаемости определяются не только общим понижением пористости, но и особенностями геометрии порового пространства и распределением осадка в нем. Такие эффекты могут по-разному проявляться в пористых средах различного типа, что создает трудности для прогноза проницаемости при изменении пористости за счет солеотложения. В EWASG есть несколько опций функциональной зависимости относительных изменений проницаемости k/k0 от относительного изменения активной пористости ⇔f/⇔0:
где 1 – SS – доля начального порового пространства, остающегося доступным для флюидов.
Простейшую модель, отображающую конвергентно-дивергентную природу естественных поровых каналов, можно представить в виде последовательности сегментов капиллярных трубок большего и меньшего радиусов (рис.5).
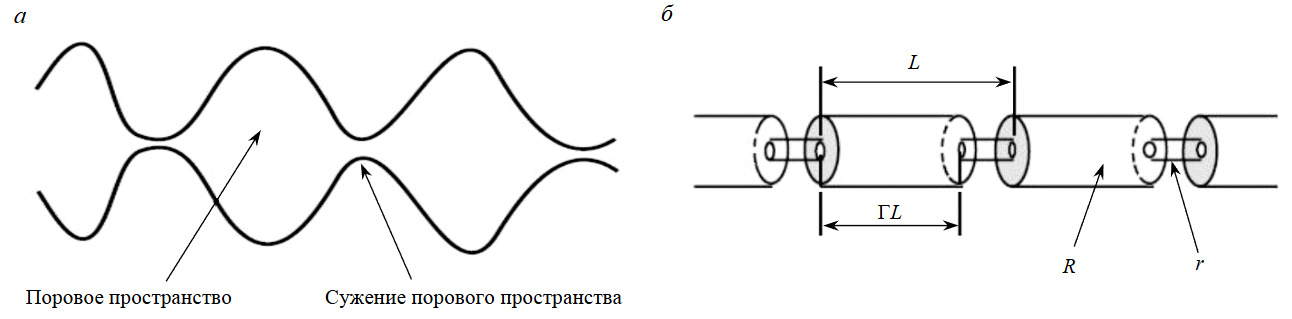
Рис.5. Модель для конвергентно-дивергентных (сжимающихся-расширяющихся) поровых каналов: а – концептуальная модель; б – серия последовательных трубок
Хотя для моделей прямых капиллярных трубок проницаемость остается ненулевой, пока пористость не обратится в нуль, в моделях трубок с переменным радиусом каналов проницаемость падает до нуля при ненулевой пористости. Для модели, изображенной на рис.5, справедливо следующее соотношение [39]:
где общая пористость имеет вид:
⇔r – доля начальной пористости, при которой проницаемость понижается до нуля; Г – доля длины пористых каналов большого радиуса.
Тогда возникает следующее выражение:
Таким образом, уравнение (1) имеет только два исходных геометрических параметра, которые необходимо определить, – ⇔r и Г. При моделировании принята изложенная выше схема серии последовательных трубок зависимости понижения проницаемости от пористости с параметрами ⇔r = 0,1, Г= 0,8. Дополнительно также увеличен (по сравнению с тестовой задачей 2) индекс продуктивности скважины до 1,0·10–11 м3, на устье давление прежнее – 1 бар (свободное фонтанирование).
На рис.6 показаны результаты моделирования с исходными параметрами: изменение расхода и устьевой температуры; насыщения твердой фазой и концентрации NaCl в устьевой части скважины в процессе ее эксплуатации продолжительностью один год. Динамика заполнения ствола скважины твердыми осадками на различные моменты эксплуатации (t = 0, 30, 60, 150 и 360 сут.) такова, что происходит неравномерное заполнение ствола скважины твердым осадком преимущественно в верхней приустьевой части скважины, уже через месяц эксплуатации скважина зарастает в верхней части на 50 % и ее расход уменьшается в три раза. Cуммарная добыча соли составит 27387,7 т, в пересчете на литий – 31,2 т, если принять его массовую долю в минерализации исходного рассола 0,114 %.
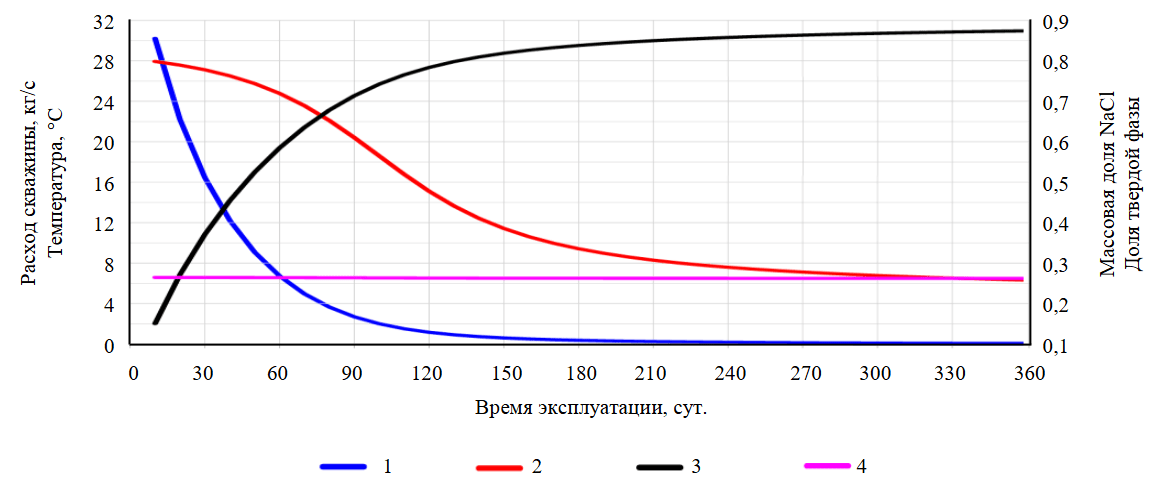
Рис.6. Результаты TOUGH2-EWASG моделирования извлечения предельно насыщенных рассолов (тестовая задача 3)
1 – изменение расхода добычной скважины, кг/с; 2 – устьевой температуры, °С; 3 – объемной доли SS заполнения скважинного пространства твердой фазой NaCl; 4 – массовой доли NaCl в приустьевой части добычной скважины
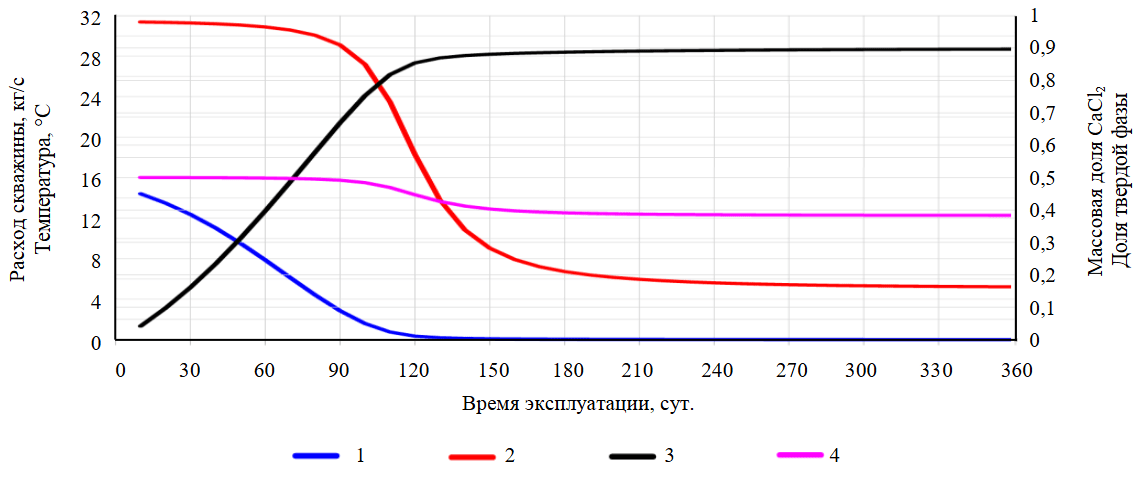
Рис.7. Результаты TOUGH2-EWASG-CaCl2 моделирования извлечения предельно насыщенных рассолов (тестовая задача 4А)
1 – изменение расхода добычной скважины, кг/с; 2 – устьевой температуры, °С; 3 – объемной доли SS заполнения скважинного пространства твердой фазой CaCl2∙6H2O; 4 – массовой доли CaCl2 в приустьевой части добычной скважины
Моделирование добычи в режиме самоизлива с учетом снижения проницаемости при зарастании порового пространства и хлоридно-кальциевого состава предельно насыщенного рассола (тестовые задачи 4, 4А)
В тестовой задаче 4 сохраняются условия предыдущей (тестовая задача 3), но при этом рассматривается хлоридно-кальциевый состав предельно насыщенного рассола и возможность отложения в твердой фазе антарктикита в целевом резервуаре и стволе скважины. В связи с этим модуль состояния флюида EWASG был программно преобразован в EWASG-CACL2. Растворимость антарктикита в зависимости от температуры аппроксимирована формулой
где XEQ – массовая доля CaCl2 в предельно насыщенном рассоле; Т – температура, °С;
Зависимость плотности предельно насыщенного рассола DB от массовой доли CaCl2 определена, как DB = 997,55060 + 460,56046 ∙ XEQ + 974,57187 ∙ XEQ2.
Результаты моделирования с исходными параметрами показывают, что расход скважины катастрофически падает с 2 кг/с до нуля в первую неделю эксплуатации и устьевая часть заполняется антарктикитом. Cуммарная добыча CaCl2 невелика и составит 207,6 т, в пересчете на литий – 237 кг, если принять его массовую долю в минерализации исходного рассола 0,114 %. Поэтому была рассмотрена тестовая задача 4А, в которой по сравнению с тестовой задачей 4 увеличен индекс продуктивности скважины до 1,0·10–10 м3 и уменьшена теплопроводность вмещающих скважину горных пород до 0,1 Вт/м·°С.
На рис.7 показаны результаты моделирования с исходными параметрами: изменение расхода и устьевой температуры; насыщения твердой фазы и концентрации СaCl2 в устьевой части скважины в процессе ее эксплуатации продолжительностью 37 сут. Как и в предшествующих тестовых задачах, динамика заполнения ствола скважины твердыми осадками на различные моменты эксплуатации (t = 1 ч, 1, 3, 5, 10 и 37 сут.) такова, что происходит неравномерное заполнение ствола скважины твердым осадком преимущественно в верхней приустьевой части скважины, уже через неделю эксплуатации скважина зарастает в верхней части на 50 % и ее расход уменьшается с 14 до 5,5 кг/с. Cуммарная добыча соли составит 3681 т, в пересчете на литий – 4,2 т, если принять его массовую долю в минерализации исходного рассола 0,114 %.
Обсуждение результатов
В составе рассолов доминируют хлориды кальция, магния, калия и натрия. И если для хлоридов натрия и калия характерна слабая зависимость растворимости от температуры, то растворимость хлоридов кальция и магния, которые кристаллизуются в виде кристаллогидратов с переменным количеством воды, очевидно зависит от температуры. Вследствие сильной зависимости растворимости от температуры предельно насыщенные концентрированные растворы хлоридов кальция и магния крайне чувствительны к колебаниям внешних параметров, и уже при небольшом понижении температуры из рассола могут лавинообразно кристаллизоваться водные хлориды. Хлорид кальция доминирует в составе рассола, добытого из скважины Ковыктинского газоконденсатного месторождения, участка «Литий», на котором проводятся ГРР и строится опытное производство по добыче литиеносных рассолов. Рапа должна оставаться жидкой при температуре выше 40-55 °C, когда в подсистеме MgCl2–CaCl2–H2O широкую область занимает кристаллизация тахгидрита, а фигуративная точка рапы попадает почти на границу его выделения.
На рис.2 показан температурный профиль ОК, где видно, что на большей части колонны температура ниже 35 °C, что в принципе может привести к зарастанию на любом участке. Особенно критична ситуация на первом километре от поверхности, когда температура опускается до 2-9 °C. Это зона лавинообразного выделения антарктикита, бишофита. На глубине 600-1200 м скважина имеет температуру 10-20 °C. Здесь будет кристаллизоваться антарктикит, и его количество может стать существенным для зарастания ОК. На глубине 1200-1900 м, где ОК имеет температуру 20-30 °C, количество выделяющегося антарктикита уменьшается, ему на смену приходит тах-гидрит. Выше 30 °C на глубинах ниже 1900 м может выделяться тахгидрит, и с ростом температуры количество кристаллических фаз уменьшается. Выше 40 °C количество выделяющегося тахгидрита уменьшается вследствие увеличения его растворимости, и количество выделяющейся соли может быть уже не критичным для скважины, например по причине механического удаления кристаллов потоком рассола, находящегося под давлением.
Отметим, что в ходе добычи ТРИЗ гидроминерального сырья участка «Литий» оптимальным будет обеспечить технико-технологические решения по сохранению высокой, условно более 40-55 °C, температуры обсадной, лифтовой колонн и устьевого оборудования. В высокотемпературных условиях антарктикит уже нестабилен, а поле кристаллизации тахгидрита уменьшается, количество выделяющейся соли может быть небольшим и не заполнит пространство внутри лифтовой колонны.
Иной вариант решения проблемы зарастания добычных скважин хлоридными солями предлагает российский опыт по оптимизации работы добычных скважин [40]. Исследуется проблема снижения проницаемости коллекторов вследствие кольматации скважин при первичном вскрытии в ходе добычи углеводородного сырья [41], проведено моделирование дробления пород и течения технологических растворов [42], где образование осадка компенсируется его выносом на поверхность. Снижение проницаемости продуктивных пластов, имеющее негативные последствия, обсуждается в работе [43]. Одним из способов борьбы является применение технологических растворов, снижающих поверхностное натяжение. Отрабатывается технология бурения в ледовом массиве методом плавления [44], что показывает актуальность и технологическую возможность температурного контроля в ходе бурения скважин. Отметим, что способ добычи предельно насыщенных рассолов, склонных к кристаллизации (ТРИЗ), рассмотрен в ряде патентов [31], где предлагается одновременно несколько решений: новая конструкция и схема обвязки устья и технология бурения с одновременным возвратом, обратной закачкой в поглощающий горизонт; при остановке углубления скважины – закачки в призабойную зону пласта слабоминерализованных, стабилизированных рассолов, последующего стравливания давления и перехода в режим самоизлива с прогревом колонны. Также существует российский патент на изобретение – способ вскрытия пропластков с аномально высоким пластовым давлением и низкими ФЕС.
Создана технология термокейса [45, 46] – создания теплоизоляционного слоя в ОК [47] либо потока горячего теплоносителя. Изначально технология термокейса разработана для добычи нефти в многолетнемерзлотных породах и предотвращения их таяния [48]. В качестве теплоизолятора может быть использовано базальтовое волокно, пенополиуретан и др. Возможно, технология термокейса может быть полезна не только для предотвращения оттаивания вечной мерзлоты, но и контроля температурного режима скважин в ходе гидродинамических исследований и добычи ТРИЗ высокоминерализованных рассолов.
Оптимальной можно считать технологию прогрева эксплуатационной колонны горячим потоком теплоносителя, которая проверена в условиях производственных циклов работы на управляемом переливе скважины 3А Знаменской и показала свою эффективность. Поэтому для решения проблемы зарастания скважин солями из рассола могут быть применены существующие технологии с прогревом, закачкой слабоминерализованных либо практически «чистых» горячих технических вод, прогрев и теплоизоляция скважиного оборудования.
Применение TOUGH2-EWASG моделирования воспроизводит динамические процессы при эксплуатации хлоридно-натриевых рассолов и позволяет оценить принципиальную возможность эксплуатации в аналогичных условиях более растворимых хлоридно-кальциевых рассолов. Кристаллизация соли в модели происходит в результате уменьшения растворимости галита при изменениях температуры, однако сама по себе зависимость растворимости NaCl от температуры слабая, в отличие от растворимости хлоридов кальция и магния. Экстраполируя результат моделирования на раствор хлорида кальция и магния, можно отметить более быстрое зарастание скважинного пространства, чем в случае хлорида кальция. Вариант добычи с циклической закачкой горячей воды и откачкой полученного рассола (тестовая задача 1) предотвращает зарастание добычных скважин и приводит к устойчивой добыче гидроминерального сырья. Но при этом необходимо обеспечить хорошее перемешивание закачиваемой горячей воды с исходным рассолом, что легко сделать на модели за счет увеличения коэффициента гидродисперсии, но может оказаться трудновыполнимым на практике.
При термогидродинамическом моделировании (тестовые задачи 3 и 4А) фонтанной эксплуатации с учетом нестационарного теплообмена показана возможность извлечения предельно насыщенного рассола хлоридно-натриевого (27387,7 т) и хлоридно-кальциевого (3681 т) из целевого продуктивного резервуара (вопреки термодинамической кристаллизации, соответствующей температурному профилю скважины). При этом добыча лития оценивается от 31,2 до 4,2 т на одну скважину. Термогидродинамическое моделирование демонстрирует снижение расхода фонтанирующих скважин, синхронизированное с уменьшением температуры и увеличением скорости заполнения скважины твердым осадком. На модели воспроизводится наблюдаемое на практике быстрое зарастание эксплуатационной колонны и снижение дебита добычных скважин в течение недель (хлоридно-кальциевые предельно насыщенные рассолы) или месяцев (хлоридно-натриевые предельно насыщенные рассолы).
Заключение
В системе KCl–MgCl2–CaCl2–H2O зафиксировано около двадцати фаз, включая лед и раствор. При зарастании ОК имеют значение две из них – антарктикит CaCl2‧6H2O и тахгидрит Mg2CaCl6‧12H2O. Соли на основе хлоридов кальция и магния, кристаллизующиеся из рассола, в основном представляют кристаллогидраты с переменным количеством воды, и при повышении температуры их растворимость сильно возрастает. В составе рапы доминирует хлорид кальция – 442 г/л, далее хлорид магния – 112 г/л и хлорид калия около 5 г/л. При зарастании скважин критично поведение хлоридов кальция и магния как доминирующих солей, а соли на основе калия даже если и выделяются, то в небольшом количестве, что позволяет предположить их незначительную и пренебрежимо малую роль в зарастании лифтовых и ОК.
При низких температурах от –35 до –10 oC, которые встречаются в условиях сибирской зимы, из рапы на дневной поверхности кристаллизуются лед, гидраты хлорида магния и кальция, двенадцативодный хлорид магния MgCl2‧12H2O. В виде изоморфной примеси в состав этого соединения может входить рубидий. Литий же, наиболее вероятно, останется в жидкости. При температурах от –10 до 20 °C из рапы может лавинообразно кристаллизоваться антарктикит CaCl2‧6H2O, а скважинное пространство зарастать солевыми отложениями. С повышением температуры поле двухфазного равновесия антарктикита с его насыщенным раствором сокращается за счет увеличения поля жидкости, что эквивалентно увеличению его растворимости и соответствует уменьшению количества выделяющейся соли. В температурном интервале от 20 до 30 °C поле кристаллизации антарктикита сокращается, но он по-прежнему выделяется. Одновременно на диаграмме состояний появляется узкое поле равновесия насыщенного раствора с тахгидритом, который также может кристаллизоваться в ОК и в районе оголовка в заметных количествах. Этот температурный диапазон не слишком оптимален для эксплуатации, хотя в его пределах растворимость антарктикита уже достаточно высокая, а поле кристаллизации тахгидрита достаточно узкое, что скорее приведет к меньшему количеству выделяемых солей, чем в более холодных температурных условиях.
При дальнейшем повышении температуры в диапазоне 30-40 °C на смену антарктикиту приходит тахгидрит (двойная соль с формулой Mg2CaCl6‧12H2O). Кроме того, из рапы может выделяться карналлит KMgCl3‧6H2O, но в небольших количествах. Скважинное пространство в этом диапазоне может зарастать, на этот раз не антарктикитом, а тахгидритом. Повышение температуры приводит к сокращению поля кристаллизации двойного кристаллогидрата, и в диапазоне 40-55 °C фигуративная точка рассола оказывается вблизи линии двухфазного равновесия кристаллизации тахгидрита. Поэтому, несмотря на то, что тахгидрит кристаллизуется, количества выделяющейся соли относительно массы рассола небольшое. При более высоких температурах до 100 °C тахгидрит выделяется в незначительных количествах.
Термограмма скважины показывает, что до глубины 1200 м температура ниже 20 °C и ОК может зарастать антарктикитом и бишофитом. При 20 °C ниже 1200 м на смену антарктикиту приходит тахгидрит, который тоже хорошо растворим, и при температурах выше 30 °C эта соль будет доминировать в составе выделяющегося осадка. Однако с возрастанием температуры количество выделяющегося антарктикита будет уменьшаться вследствие возрастания его растворимости.
Подводя итог термодинамическому анализу, можно заключить, что оптимальными температурными режимами эксплуатации глубоких скважин для добычи ТРИЗ хлоридно-кальциевых сверхкрепких рассолов являются температуры выше 30-55 °C. Имеющийся опыт эксплуатации осложненных скважин показывает, что промывка ОК слабоминерализованными растворами, а также технологии теплоизоляции и прогрева скважин могут быть адаптированы к добыче ТРИЗ предельно насыщенных и весьма крепких литиеносных рассолов. Технические условия, обеспечивающие необходимые температурные диапазоны, могут быть аналогичны методу термокейса, который применяется при разработке ТРИЗ углеводородного сырья в условиях вечной мерзлоты и призван предотвратить как ее протаивание, так и выделение в обсадных трубах отложений из тяжелых парафинов.
Термогидродинамическое моделирование одиночной фонтанирующей скважины для гидрогеологических условий, близких к условиям Ковыктинской площади на юге СП, показало принципиальную возможность длительной (от месяца до года) эксплуатации предельно насыщенных хлоридно-натриевых и хлоридно-кальциевых литиеносных рассолов с добычей лития от 31,2 до 4,2 т на одну скважину.
Задачи дальнейших исследований включают доработку модуля состояния флюидов TOUGH2-EWASG для хлоридно-кальциевых и хлоридно-магниевых рассолов, апробацию моделей на данных опытных работ на участках разведки и эксплуатации предельно насыщенных литиеносных хлоридных рассолов, отработку методов решения обратных задач для определения фильтрационно-емкостных, теплофизических свойств и граничных условий целевых резервуаров, обоснование технологий устойчивой эксплуатации скважины в режиме самоизлива/фонтанирования, откачки или комбинированного самоизлива с закачкой горячей воды или пара.
Литература
- Юрчик И.И. Литий в рассолах Сибирского солеродного бассейна // XX Международный научный конгресс «Интерэкспо ГЕО-Сибирь»: Материалы Международной научной конференции «Недропользование. Горное дело. Направления и технологии поиска, разведки и разработки месторождений полезных ископаемых. Экономика. Геоэкология», 15-17 мая 2024, Новосибирск, Россия. Новосибирск: Сибирский государственный университет геосистем и технологий, 2024. Т. 2. № 1. С. 247-250. DOI: 10.33764/2618-981X-2024-2-1-247-250
- Мохунов В.Ю., Гулый Н.И. Анализ тенденций современных технологий извлечения лития из гидроминерального сырья // Недропользование XXI век. 2022. № 4 (96). С. 38-50.
- Патрикеев П.А., Ахияров А.В., Кирсанов А.М. и др. Прогноз перспектив нефтегазоносности в пределах Кочечумско-Мархинской НГПЗ Лено-Тунгусской НГП, с учетом сложного геологического разреза, насыщенного продуктами интрузивного траппового магматизма // Физико-технические проблемы добычи, транспорта и переработки органического сырья в условиях холодного климата: Сборник трудов III Всероссийской конференции, посвященной 25-летию Института проблем нефти и газа СО РАН, 10-13 сентября 2024, Якутск, Россия. Киров: Межрегиональный центр инновационных технологий в образовании, 2024. С. 75-80. DOI: 10.24412/cl-37255-2024-1-75-80
- Donskaya T.V., Gladkochub D.P. Post-collisional magmatism of 1.88–1.84 Ga in the southern Siberian Craton: An overview // Precambrian Research. 2021. Vol. 367. № 106447. DOI: 10.1016/j.precamres.2021.106447
- Chang S.A., Balouch A., Abdullah. Analytical perspective of lithium extraction from brine waste: Analysis and current progress // Microchemical Journal. 2024. Vol. 200. № 110291. DOI: 10.1016/j.microc.2024.110291
- Попов Г.В., Пашкевич Р.И. Кинетика ионного обмена лития из растворов в статических условиях // Башкирский химический журнал. 2018. Т. 25. № 4. С. 46-49. DOI: 10.17122/bcj-2018-4-46-49
- Белова Т.П., Ратчина Т.И. Исследование сорбции лития катионитом КУ-2-8 из модельных растворов, имитирующих геотермальные теплоносители в динамическом режиме // Записки Горного института. 2020. Т. 242. С. 197-201. DOI: 10.31897/PMI.2020.2.197
- Mends E.A., Chu P. Lithium extraction from unconventional aqueous resources – A review on recent technological development for seawater and geothermal brines // Journal of Environmental Chemical Engineering. 2023. Vol. 11. Iss. 5. № 110710. DOI: 10.1016/j.jece.2023.110710
- Suharyanto A., Rohmah M., Lalasari L.H., Mubarok M.Z. Lithium adsorption behaviour from Ciseeng geothermal brine water onto Amberlite resin // AIP Conference Proceedings. 2024. Vol. 3003. Iss. 1. № 020113. DOI: 10.1063/5.0186324
- Рябцев А.Д., Коцупало Н.П., Менжерес Л.Т. и др. Реализация комплексной технологии переработки рассолов хлоридного кальциевого типа с получением безбромного литиевого концентрата // Химическая технология. 2023. Т. 24. № 9. С. 337-342. DOI: 10.31044/1684-5811-2023-24-9-337-342
- Коцупало Н.П., Немудрый А.П. Разработка технологий переработки горнорудного и гидроминерального литиеносного сырья. Научные основы получения селективного сорбента лития // Химия в интересах устойчивого развития. 2021. Т. 29. № 3. С. 355-362. DOI: 10.15372/KhUR2021312
- Bofill L., Bozetti G., Schäfer G. et al. Quantitative facies analysis of a fluvio-aeolian system: Lower Triassic Buntsandstein Group, eastern France // Sedimentary Geology. 2024. Vol. 465. № 106634. DOI: 10.1016/j.sedgeo.2024.106634
- Ashadi A.L., Martinez Y., Kirmizakis P. et al. First High-Power CSEM Field Test in Saudi Arabia // Minerals. 2022. Vol. 12. Iss. 10. № 1236. DOI: 10.3390/min12101236
- Herrmann L., Ehrenberg H., Graczyk-Zajac M. et al. Lithium recovery from geothermal brine – an investigation into the desorption of lithium ions using manganese oxide adsorbents // Energy Advances. 2022. Vol. 1. Iss. 11. P. 877-885. DOI: 10.1039/d2ya00099g
- Glen J.M.G., Earney T.E. New high resolution airborne geophysical surveys in Nevada And California for geothermal and mineral resource studies // Geothermal Resources Council Transactions. 2023. Vol. 47. P. 1738-1762.
- Кузьменко П.С., Михеева Е.Д. Минерально-сырьевая база месторождений литиеносных глин и туфов // Недропользование XXI век. 2024. № 2 (103). С. 14-19.
- Антипин В.С., Кузьмин М.И., Одгэрэл Д. и др. Редкометалльные литий-фтористые граниты в позднепалеозойском, раннемезозойском и позднемезозойском ареалах гранитоидного магматизма Центральной Азии // Геология и геофизика. 2022. Т. 63. № 7. С. 935-955. DOI: 10.15372/GiG2021165
- Алексеев В.И. Тектоно-магматические факторы локализации литий-фтористых гранитов Востока России // Записки Горного института. 2021. Т. 248. С. 173-179. DOI: 10.31897/PMI.2021.2.1
- Алексеев В.И. Типовая интрузивная серия Дальневосточного пояса литий-фтористых гранитов и ее рудоносность // Записки Горного института. 2022. Т. 255. С. 377-392. DOI: 10.31897/PMI.2022.21
- Alam M.A., Muñoz A. A critical evaluation of the role of a geothermal system in lithium enrichment of brines in the salt flats: A case study from Laguna Verde in the Atacama Region of Chile // Geothermics. 2024. Vol. 119. № 102970. DOI: 10.1016/j.geothermics.2024.102970
- Судариков С.М., Змиевский М.В. Геохимия рудообразующих гидротермальных флюидов Мирового океана // Записки Горного института. 2015. Т. 215. С. 5-15.
- Fei Xue, Hongbing Tan, Xiying Zhang et al. Contrasting sources and enrichment mechanisms in lithium-rich salt lakes: A Li-H-O isotopic and geochemical study from northern Tibetan Plateau // Geoscience Frontiers. 2024. Vol. 15. Iss. 2. № 101768. DOI: 10.1016/j.gsf.2023.101768
- Zheng Hao, Zhao Hai Xiang, Tan Hong Bing. Calculation of ore-forming material balance and material source of Li-B rich brines in Mami Co Lake, Tibet // Mineral Deposits. 2023. Vol. 42. № 2. P. 411-424. DOI: 10.16111/j.0258-7106.2023.02.011
- Kiryukhin A.V., Nazhalova I.N., Zhuravlev N.B. Hot water-methane reservoirs at southwest foothills of Koryaksky volcano, Kamchatka // Geothermics. 2022. Vol. 106. № 102552. DOI: 10.1016/j.geothermics.2022.102552
- Dugamin E.J.M., Cathelineau M., Boiron M.C. et al. Lithium enrichment processes in sedimentary formation waters // Chemical Geology. 2023. Vol. 635. № 121626. DOI: 10.1016/j.chemgeo.2023.121626
- Al-Jawad J., Ford J., Petavratzi E., Hughes A. Understanding the spatial variation in lithium concentration of high Andean Salars using diagnostic factors // Science of The Total Environment. 2024. Vol. 906. № 167647. DOI: 10.1016/j.scitotenv.2023.167647
- Baines A., Broadley M., Gines J. et al. Bare-earth satellite imagery and the search for hidden lithium-rich brines: An example from the Lithium Triangle in South America // The International Meeting for Applied Geoscience and Energy: Expanded Abstracts 2023 Technical Program, 28 August – 1 September 2023, Houston, TX, USA. Society of Exploration Geophysicists, 2023. P. 1136-1140. DOI: 10.1190/image2023-3909965.1
- Lattus J.M., Barber M.E., Skoković D. et al. Spaceborne Radars for Mapping Surface and Subsurface Salt Pan Configuration: A Case Study of the Pozuelos Salt Flat in Northern Argentina // Remote Sensing. 2024. Vol. 16. Iss. 8. № 1411. DOI: 10.3390/rs16081411
- Jiang Guo, Zhou Kefa, Wang Jinlin et al. Identification of lithium-beryllium granitic pegmatites based on deep learning // Earth Science Frontiers. 2023. Vol. 30. № 5. P. 185-186. DOI: 10.13745/j.esf.sf.2023.5.20
- Rossi C., Bateson L., Bayaraa M. et al. Framework for Remote Sensing and Modelling of Lithium-Brine Deposit Formation // Remote Sensing. 2022. Vol. 14. Iss. 6. № 1383. DOI: 10.3390/rs14061383
- Агафонов Ю.А., Алексеев С.В., Алексеева Л.П. и др. Рапогазопроявления и аномально высокие пластовые давления литиеносных рассолов на юге Сибирской платформы (флюидогеодинамическая интерпретация геолого-геофизических и геопромысловых данных; прогноз горно-геологических условий, инновационные подходы и решения в бурении и освоении Ковыктинского газоконденсатного месторождения). В 2 т. Т. 1. Обзор проблемы бурения скважин в условиях АВПД и высокодебитных фонтанных притоков редкометальных рассолов. Геолого-структурная позиция и строение Ковыктинского ГКМ. Гидрогеология и минерагения концентрированных рассолов. Строение межсолевых природных резервуаров осадочного чехла галогенно-карбонатного кембрия. Поликомпонентные промышленные рассолы глубоких горизонтов чехла как комплексное гидроминеральное сырье. Технологии переработки рассолов. Иркутск: Иркутский национальный исследовательский технический университет, 2022. 302 с.
- Мелентьев Г.Б., Шевчук Р.М., Делицын Л.М. и др. Приоритетные минеральные ресурсы и «критические» материалы России для производства литий-ионных аккумуляторов // Известия Коми научного центра УрО РАН. Серия «Экономические науки». 2023. № 3 (61). С. 59-70. DOI: 10.19110/1994-5655-2023-3-59-70
- Alexeev S.V., Alexeeva L.P., Vakhromeev A.G. Brines of the Siberian platform (Russia): Geochemistry and processing prospects // Applied Geochemistry. 2020. Vol. 117. № 104588. DOI: 10.1016/j.apgeochem.2020.104588
- Сырков А.Г., Прокопчук Н.Р., Воробьев А.Г., Бричкин В.Н. Академик Н.С.Курнаков как основоположник физико-химического анализа – научного фундамента для разработки новых металлических сплавов и материалов // Цветные металлы. 2021. № 1. С. 77-83. DOI: 10.17580/tsm.2021.01.09
- Солиев Л., Жумаев М.Т. Дивариантные равновесия в многокомпонентных системах // Химический журнал Казахстана. 2021. № 4 (76). С. 59-71. DOI: 10.51580/2021-1/2710-1185.49
- Хамракулов З.А., Аскарова М.К., Тухтаев С. Растворимость компонентов в системах MgCl2–CaCl2–H2O, (48.2% CaCl2 + 51.8% MgCl2) –NaClO3–H2O // Журнал неорганической химии. 2015. Т. 60. № 10. С. 1405-1410. DOI: 10.7868/S0044457X15080103
- Вахромеев А.Г., Смирнов А.С., Сверкунов С.А. и др. Tехнологические варианты освоения литиеносных залежей ТРИЗ межсолевых рассолоносных пластов с АВПД флюидной системы // Строительство нефтяных и газовых скважин на суше и на море. 2025. № 6 (390). С. 5-13.
- Feng Liu, Gui-ling Wang, Wei Zhang et al. Using TOUGH2 numerical simulation to analyse the geothermal formation in Guide basin, China // Journal of Groundwater Science and Engineering. 2020. Vol. 8. № 4. P. 328-337. DOI: 10.19637/j.cnki.2305-7068.2020.04.003.
- Pruess K., Oldenburg C., Moridis G. TOUGH2 User’s Guide, Version 2.0. Ernest Orlando Lawrence Berkley National Laboratory, 1999. Report № LBNL-43134. 204 p. DOI: 10.2172/751729
- Топоркова Е.В., Конкин В.В., Лашкин Н.Е., Зайцев К.А. Совершенствование технологии подготовки нефти на приразломном нефтяном месторождении // Академический журнал Западной Сибири. 2015. Т. 11. № 5 (60). С. 35-36.
- Гасумов Р.А. Причины отсутствия притоков пластовых флюидов при освоении скважин малых месторождений (на примере хадум-баталпашинского горизонта) // Записки Горного института. 2018. Т. 234. С. 630-636. DOI: 10.31897/PMI.2018.6.630
- Григорьев Б.С., Елисеев А.А., Погарская Т.А., Торопов Е.Е. Математическое моделирование дробления грунта и многофазного течения бурового раствора при бурении скважин // Записки Горного института. 2019. Т. 235. С. 16-23. DOI: 10.31897/PMI.2019.1.16
- Рогов Е.А. Исследование проницаемости призабойной зоны скважин при воздействии технологическими жидкостями // Записки Горного института. 2020. Т. 242. С. 169-173. DOI: 10.31897/PMI.2020.2.169
- Сербин Д.В., Дмитриев А.Н. Экспериментальные исследования теплового способа бурения плавлением скважины в ледовом массиве с одновременным контролируемым расширением ее диаметра // Записки Горного института. 2022. Т. 257. С. 833-842. DOI: 10.31897/PMI.2022.82
- Артеменков В.Ю., Ерехинский Б.А., Заряев И.А. Об опыте применения теплоизолированных лифтовых труб при добыче нефти и газа // Трубопроводный транспорт: теория и практика. 2017. № 2 (60). С. 20-23.
- Гришин М.С., Галеев А.Р. Исследование комбинированной технологии изоляции ствола скважины в интервалах многолетнемерзлых пород // Проблемы разработки месторождений углеводородных и рудных полезных ископаемых. 2023. Т. 1. С. 154-159.
- Посконина Е.А., Курчатова А.Н. Определение минимальной длины термокейса при выбранном расстоянии между скважинами // PROНЕФТЬ. Профессионально о нефти. 2019. № 2 (12). С. 66-70. DOI: 10.24887/2587-7399-2019-2-66-70
- Баданина Ю.В., Комков М.А., Бочкарев С.В., Павловская К.В. Создание насосно-компрессорных труб с высокоэффективным композиционным термобарьерным покрытием для паротепловой обработки скважин // Фундаментальные исследования. 2016. № 11-3. С. 461-466.
