Комбинированный метод переработки отработанного кислого травильного раствора производства изделий из титана
- 1 — канд. техн. наук доцент Институт химических технологий и инжиниринга – филиал Уфимского государственного нефтяного технического университета ▪ Orcid
- 2 — д-р хим. наук профессор Уфимский государственный нефтяной технический университет ▪ Orcid
- 3 — д-р техн. наук профессор Институт химических технологий и инжиниринга – филиал Уфимского государственного нефтяного технического университета ▪ Orcid
- 4 — ассистент Уфимский государственный нефтяной технический университет ▪ Orcid
Аннотация
Обладая высокой прочностью, небольшой плотностью и значительной химической стойкостью, титан нашел широкое применение в различных областях народного хозяйства – химическая индустрия, авиационная и ракетная техника, машиностроение, медицина и т.д. Изготовлению изделий из титана мешает достаточно прочная оксидная пленка, покрывающая его поверхность. Удаление оксидной пленки с поверхности титановых заготовок осуществляют травлением в растворах минеральных кислот различного состава. Образуется отработанный кислый травильный раствор (ОКТР), содержащий титановую соль и остаток непрореагировавших кислот. Практически все травильные растворы содержат HF и одну из сильных кислот. Это H2SO4, HCl или HNO3. Таким образом, в ОКТР входят ионы титана, фтора или хлора, или сульфата, или нитрата. ОКТР достаточно токсичен и перед сбросом в водоем подлежит многократному разбавлению или очистке. Большинство методов, применяемых для извлечения из ОКТР находящихся в нем примесей, приводит к снижению их содержания. В результате такой очистки происходит потеря веществ, содержащихся в ОКТР в значительном количестве и представляющих интерес для дальнейшего использования. В работе приведены экспериментальные результаты, полученные при комбинированной переработке ОКТР, содержащей фторид титана, фтористоводородную и хлористоводородную кислоты. На первой стадии ОКТР обрабатывается гидроксидом натрия. Образующийся в результате осадок гидроксида титана отфильтровывается. На второй стадии фильтрат, содержащий фторид и хлорид натрия, подвергается обработке в мембранном электролизере. При этом происходит не только извлечение солей натрия из фильтрата, но и получение гидроксида натрия и смеси фтористоводородной и хлористоводородной кислот. Гидроксид натрия можно применить для обработки ОКТР, а смесь кислот для травления титановых заготовок.
Введение
Титан и его сплавы широко применяются при изготовлении самого различного оборудования, которое пользуется высоким спросом в связи с антикоррозионной стойкостью, хорошим сочетанием прочностных свойств, устойчивостью к действию температур, довольно низкой плотностью и сравнительно высокой металлоемкостью. Основными потребителями титана и его соединений являются самолето- и ракетостроение [1], химическая промышленность [2-4], металлургия [5], медицина [6, 7], производство катализаторов [8], лакокрасочная промышленность [9]. Как правило, изготовление изделий из титана сопровождается нагреванием, вследствие чего его поверхность покрывается достаточно прочной оксидной пленкой. Для обеспечения технологичности титановых заготовок, особенно при нанесении на его поверхность модифицирующих покрытий, необходимо с поверхности удалять оксидную пленку. Для выполнения этой операции используются различные методы [10-12].
Помимо механических, термических и других методов, широкое распространение нашли и термохимические методы [13-15]. Такие методы заключаются в обработке поверхности изделий минеральными кислотами при определенных температурах [16, 17]. В качестве кислот для растворения оксидных пленок на поверхности титана и его сплавов используют хлористоводородную, серную, азотную, фосфорную и др. кислоты в различных концентрациях и при различных температурах [16, 17]. В отличие от этих кислот фтористоводородная растворяет титан уже при комнатной температуре. С целью регулирования скорости растворения титана в раствор фтористоводородной кислоты вводят такие кислоты, как HCl, H2SO4, HNO3 [18]. Если присутствие серной кислоты незначительно увеличивает скорость процесса растворения титана, то с введением в раствор хлористоводородной она увеличивается почти в два раза, а применение азотной кислоты приводит к уменьшению скорости растворения.
В АО «Башкирская содовая компания» для травления поверхности титана в производстве окисно-рутений-титановых анодов используют хлористоводородную кислоту. Процесс травления осуществляют в 25-27 % HCl при температуре около 85 °С. Получающийся в этом случае отработанный кислый травильный раствор (ОКТР) содержит до 180 г/л хлорида титана и до 110 г/л хлористоводородной кислоты.
В Корпорации ВСМПО-АВИСМА для травления поверхности титана используют смесь водных растворов HF и HCl при комнатной температуре. Образующийся при этом ОКТР содержит около 22 г/л фторида титана, около 1,7 г/л фтористоводородной кислоты и около 6,2 г/л хлористоводородной кислоты. Этот раствор еще более токсичен, чем раствор, содержащий только хлорид титана и хлористоводородную кислоту, вследствие присутствия фторида аниона. Предельно допустимые концентрации компонентов ОКТР в водных объектах хозяйственно-питьевого и культурно-бытового водопользования составляют для ионов, мг/л: фтора 1,5, хлора 350, сульфата 500, титана 0,1 (ГН 2.1.5.1315-03. Гигиенические нормативы. Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования). Таким образом, при сбросе ОКТР в водоем необходимы значительные затраты на воду для его разбавления. Кроме того, в этом случае происходит потеря ценных компонентов, которые могут служить сырьем для получения товарной продукции. Известны способы утилизации и обезвреживания ОКТР с помощью ионного обмена [19-21], коагуляции и отстаивания [22-24], нейтрализации [25, 26]. Процесс нейтрализации ОКТР приводит к затратам щелочных реагентов, образованию таких токсичных твердых отходов, как CaF2 и Na2TiF6 2-го класса опасности, а также к потере минеральных кислот [27-30].
В предыдущих работах авторов рассматривалась возможность переработки сточных вод, содержащих различные вещества с получением продуктов, которые можно использовать в производственном процессе [31-33]. В настоящей статье изложены результаты исследований по переработке ОКТР, содержащего фторид титана, фтористоводородную и хлористоводородную кислоты. Переработка ОКТР осуществлялась в два этапа. На первом этапе ОКТР обрабатывался гидроксидом натрия. Образующийся осадок гидроксида титана отфильтровывался и подвергался сушке. На втором этапе фильтрат, содержащий ионы фтора, хлора и натрия, подвергался переработке в мембранном электролизере. В результате электрохимической обработки фильтрата в электролизере генерировались гидроксид натрия и смесь фтористоводородной и хлористоводородной кислот.
Методология
Экспериментальные исследования осуществлялись в две стадии. На первой стадии ОКТР обрабатывали кристаллическим гидроксидом натрия. Для этого к 100 мл ОКТР добавляли кристаллический NaOH. Образующийся осадок гидроксида титана отфильтровывали и сушили при температуре 200 °С до постоянной массы. По массе осадка определяли степень извлечения титана из ОКТР. Второй этап состоял в электрохимической обработке фильтрата, полученного после отделения гидроксида титана в электролизерах с ионообменными мембранами. Для исследований использовали два типа электролизеров – без протока и с протоком растворов через камеры.
Исследование распределения компонентов по камерам электролизера, определения выхода по току и удельных затрат электроэнергии на процесс переработки фильтрата осуществляли в четырехкамерном мембранном электролизере без протока растворов через камеры (рис.1).
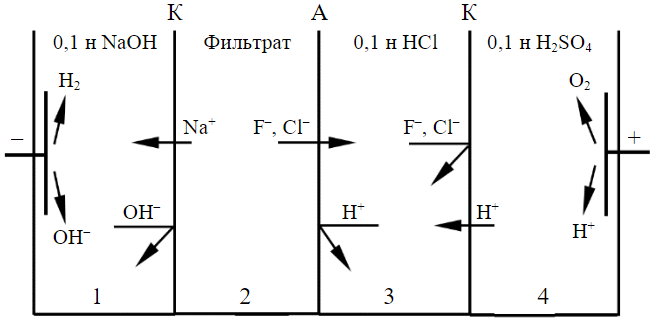
Рис.1. Схема непроточного электролизера для переработки фильтрата, полученного после удаления титана из ОКТР
А – анионообменная; К – катионообменная мембраны
Камеры электролизера диаметром 6 см изготавливались из пластин оргстекла толщиной 2,5 см. Для разделения камер применяли мембраны, изготовленные ООО «Щекиноазот»: катионообменные мембраны марки МК-40, анионообменные мембраны марки МА-40. Рабочая поверхность каждой мембраны, разделяющей камеры, составляла 14,1 см2. Материал катода – пластина из нержавеющей стали, материал анода – титановая пластина, покрытая окисью рутения (ОРТА). В катодную камеру 1 электролизера загружали 0,1 н раствор гидроксида натрия. В камеру 2 загружали фильтрат, полученный после извлечения из ОКТР титана. В камеру 3 – 0,1 н раствор хлористоводородной кислоты. В анодную камеру 4 помещали 0,1 н раствор серной кислоты. Объем загружаемых во все камеры электролизера растворов равнялся 60 мл.
В процессе обработки фильтрата в электролизере (рис.1) на катоде разлагается вода с образованием газообразного водорода и генерацией ионов гидроксила. На аноде происходит разложение воды с выделением газообразного кислорода и генерацией ионов водорода. Ионы натрия и водорода мигрируют к катоду, а ионы гидроксила, фтора и хлора – к аноду. Миграции ионов водорода препятствует анионообменная мембрана, а миграции ионов гидроксила, фтора и хлора – катионообменная мембрана. В результате в катодной камере 1 электролизера происходит накапливание гидроксида натрия, а в камере 3 электролизера – смеси фтористоводородной и хлористоводородной кислот.
Для определения максимальных концентраций щелочи и смеси кислот, генерируемых в катодных и камере 3 электролизера, использовали мембранный электролизер с протоком растворов в камерах аппарата, схематично показанный на рис.2. Электролизер состоял из четырех ячеек, разделенных электродными пластинами. Каждая ячейка разделена на четыре камеры, которые отделены друг от друга катионообменными и анионообменными мембранами. Рабочая поверхность каждой мембраны составляла 30 см2. Камеры в виде рамок изготавливались из поливинилхлоридной пластины толщиной 2 мм. Для предотвращения слипания мембран в каждую камеру помещали просечную сетку, растянутую из каландрированного винипласта. Вся конструкция стягивалась в единый пакет плитами из оргстекла.
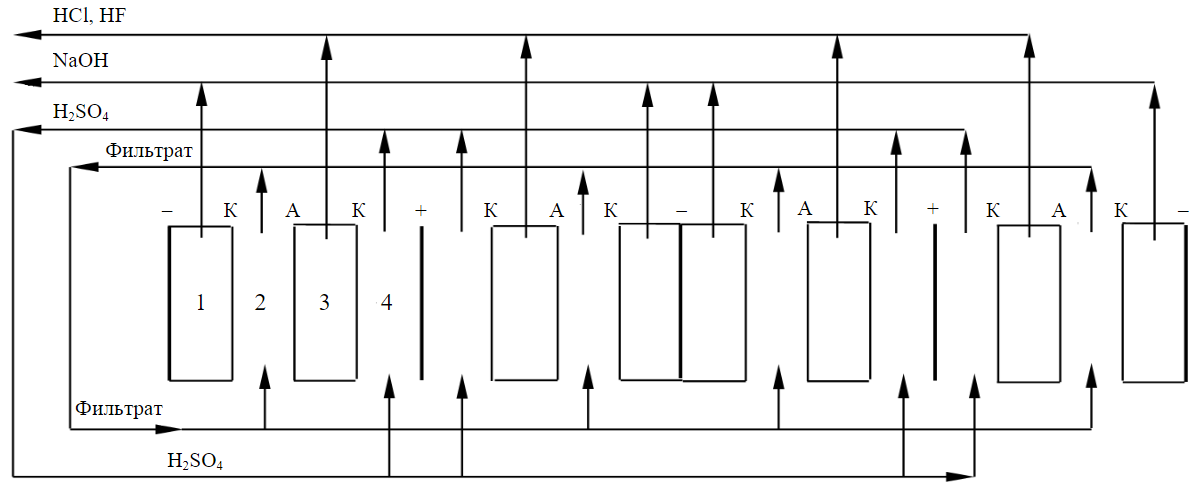
Рис.2. Схема проточного электролизера для переработки фильтрата, полученного после удаления титана из ОКТР
Концентрации растворов, используемых в электролизере с проточными камерами (рис.2), аналогичны концентрациям растворов, применяемых в электролизере без их протока через камеры аппарата (см. рис.1). В камере 2 электролизера циркулировал фильтрат, в анодной камере – раствор серной кислоты. Катодная камера и камера 3 выполнены без протока растворов и предварительно заполнялись 0,1 н растворами гидроксида натрия и хлористоводородной кислоты соответственно. Растворы гидроксида натрия и смеси плавиковой и соляной кислот покидали соответствующие камеры по мере накапливания.
Исследования проводили с модельным раствором, содержащим фторид титана, фтористоводородную и хлористоводородную кислоты. Исследуемый раствор получали растворением металлического титана в смеси фтористоводородной и хлористоводородной кислот. Для этого 10 г титана марки ВТ1-0 растворяли в 1 л смеси фтористоводородной и хлористоводородной кислот, содержащей 14,7 г/л HF и 6,2 г/л HCl. Состав полученного модельного ОКТР, рассчитанный на фторид титана – 22 г/л, 0,21 моль/л; фтористоводородную кислоту – 1,7 г/л, 0,085 моль/л; хлористоводородную кислоту – 6,2 г/л, 0,17 моль/л.
Результаты и их обсуждение
Результаты опытов по извлечению титана из ОКТР его обработкой гидроксидом натрия представлены в табл.1. Обработка ОКТР гидроксидом натрия приводит к полному извлечению титана при достижении рН фильтрата, равном 7,6. Полученный после отделения осадка и промывки фильтрат содержал 0,92 моль/л фторида натрия и 0,17 моль/л хлорида натрия.
Таблица 1
Зависимость степени извлечения титана из ОКТР от массы NaOH и рН фильтрата
|
Масса NaOH, добавленная к100 мл ОКТР, г |
2,4 |
2,6 |
2,8 |
3,0 |
3,2 |
3,4 |
36, |
3,8 |
4,0 |
4,2 |
|
рН |
3,75 |
5,5 |
6,45 |
7,2 |
7,6 |
7,8 |
9,4 |
9,85 |
10,6 |
12,8 |
|
Степень извлечения, % |
85,4 |
89,8 |
96,5 |
98,1 |
99,6 |
100 |
99,8 |
100 |
100 |
100 |
Для исследования распределения ионов натрия, фтора и хлора по камерам электролизера, определения выхода по току и удельных затрат электроэнергии на процесс использовали аппарат без протока растворов через камеры (см. рис. 1). Масса компонентов в электролизере перед опытами, определенная расчетом, основанным на объеме используемых растворов и их концентрации, составляла: ионы натрия 0,138 г в камере 1 и 1,504 г в камере 2; ионы фтора 1,048 г в камере 2; ионы хлора 0,362 г в камере 2 и 0,213 г в камере 3. Плотность тока в процессе переработки фильтрата изменялась от 20 до 80 мА/см2. Количество пропущенного электричества во всех опытах оставалось постоянным и составляло 1,2 А‧ч. Распределение ионов натрия, фтора и хлора приведено в табл.2.
Таблица 2
Распределение ионов натрия, фтора и хлора по камерам электролизера
|
Плотность тока, мА/см2 |
Масса, г |
Нарушение материального баланса, рассчитанного |
|||||
|
Натрий |
Фтор |
Хлор |
|||||
|
Камера 1 |
Камера 2 |
Камера 2 |
Камера 3 |
Камера 2 |
Камера 3 |
||
|
20 |
0,955 |
0,687 |
0,606 |
0,422 |
0,233 |
0,312 |
5,2 |
|
40 |
0,929 |
0,713 |
0,593 |
0,455 |
0,228 |
0,311 |
6,3 |
|
60 |
0,987 |
0,655 |
0,590 |
0,458 |
0,237 |
0,324 |
3,8 |
|
80 |
0,967 |
0,675 |
0,602 |
0,446 |
0,235 |
0,329 |
5,7 |
|
Средние значения |
|||||||
|
|
0,964 |
0,683 |
0,598 |
0,450 |
0,233 |
0,319 |
|
В процессе электролиза ионы натрия мигрируют в камеру 1 электролизера. В этой камере происходит концентрирование ионов натрия с образованием гидроксида. В камерах 3 и 4 присутствие ионов натрия не обнаружено. Зависимости степени извлечения ионов натрия, фтора и хлора из камеры 2 от мембранной плотности тока не наблюдается. Это позволило определить средние значения массы ионов в камерах электролизера и рассчитать погрешность в полученных результатах. Расчет относительной погрешности в соответствии с распределением Стьюдента для доверительной вероятности 95 % для всех компонент изменяется от 2 % для ионов фтора в камере 2 электролизера до 5,6 % для ионов натрия в той же камере. Средняя степень извлечения ионов натрия из камеры 2 составила 79,8 %. Ионы фтора и хлора мигрируют в камеру 3 электролизера и накапливаются в ней, образуя фтористоводородную и хлористоводородную кислоты. Присутствие для ионов фтора и хлора в камерах 1 и 4 не обнаружено. Средняя степень извлечения составила ионов фтора 36,4 % и ионов хлора – 35,6 %. Поскольку извлечение ионов натрия из фильтрата рассчитывали по увеличению концентрации гидроксида натрия в камере 1 электролизера, а извлечение фтора- по увеличению концентрации фтористоводородной кислоты в камере 3, то рассчитать нарушение материального баланса по этим элементам не представляется возможным. В отличие от этого, содержание ионов хлора определялось во всех камерах аппарата, что позволило рассчитать нарушение материального баланса, составившего от 3,8 до 6,3 %.
В табл.3 приведены удельные затраты электрической энергии на процесс переработки фильтрата и выход по току. Представленные данные рассчитаны по результатам, полученным для извлечения натрия из фильтрата.
Таблица 3
Выход по току и удельные затраты электроэнергии процесса переработки фильтрата
|
Напряжение, В |
Плотность тока, мА/см2 |
Выход по току, % |
Затраты электроэнергии |
|
|
Вт‧ч/г |
Вт‧ч/моль |
|||
|
1,97 |
20 |
79,3 |
2,36 |
65,67 |
|
4,12 |
40 |
76,8 |
4,94 |
145,41 |
|
7,06 |
60 |
82,4 |
8,47 |
228,97 |
|
12,14 |
80 |
80,5 |
14,89 |
413,67 |
Выход по току (средняя величина 79,8 %) не зависит от плотности тока. Затраты электрической энергии на процесс извлечения из фильтрата ионов фторида и хлорида натрия определяются мембранной плотностью тока. Увеличение мембранной плотности тока сопровождается довольно резким возрастанием удельных затрат электроэнергии на процесс. Так, изменение плотности тока на 20 мА/см2 в интервале 20-40 мА/см2 сопровождается ростом энергозатрат на 79 Вт·ч/моль, а в интервале 60-80 мА/см2 – увеличением энергозатрат на 185 Вт·ч/моль, т.е. в 2,3 раза.
Исследования по переработке фильтрата в непроточном четырехкамерном электролизере с катионообменными и анионообменными мембранами указывают на возможность получения растворов, содержащих гидроксид натрия и смесь фтористоводородной и хлористоводородной кислот. Для определения максимальной концентрации растворов гидроксида натрия и смеси фтористоводородной и хлористоводородной кислот поставлена серия опытов в электролизере с проточными камерами 2 и 4 (рис.2). Процесс обработки фильтрата проводили до тех пор, пока значения концентрации генерируемых в электролизере гидроксида натрия и смеси фтористоводородной и хлористоводородной кислот переставали изменяться. Объем растворов, циркулирующих в камерах 2 и 4 электролизера, составлял 2 л в каждой.
На рис.3 представлены изменения концентрации гидроксида натрия, фтористоводородной и хлористоводородной кислот во времени при различных плотностях тока. Интенсивность концентрирования щелочи и кислот определяется плотностью тока и максимальна в начальный момент времени. С течением времени обработки фильтрата скорость концентрирования уменьшается и затем перестает изменяться. Максимальная концентрация веществ, генерируемых в камерах 1 и 3 электролизера, достигнутая в опытах, определяется количеством воды, переносимой с соответствующими ионами через ионообменные мембраны, и увеличивается с ростом плотности тока. Значения максимально достигнутых концентраций гидроксида натрия, фтористоводородной и хлористоводородной кислот приведены в табл.4.
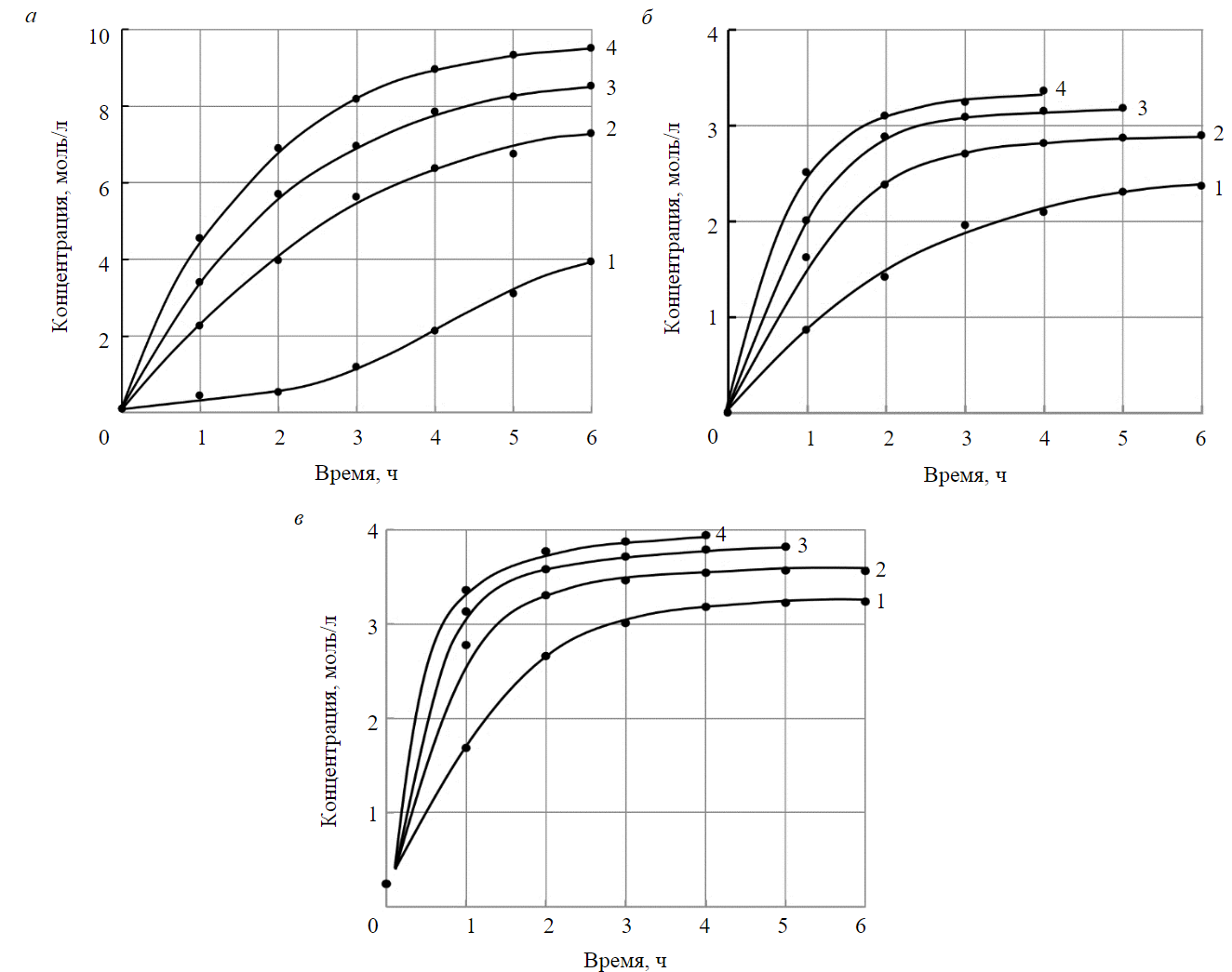
Рис.3. Изменение концентрации гидроксида натрия (а); фтористоводородной кислоты (б); хлористоводородной кислоты (в) во времени при различных плотностях тока
1 – 20; 2 – 40; 3 – 60; 4 – 80 мА/см2
Таблица 4
Максимально достигнутые концентрации NaOH, HF и HCl
|
Плотность тока, мА/см2 |
Гидроксид натрия |
Плавиковая кислота |
Соляная кислота |
|||
|
г/л |
моль/л |
г/л |
моль/л |
г/л |
моль/л |
|
|
20 |
15,7 |
3,94 |
47,3 |
2,36 |
47,4 |
1,31 |
|
40 |
291,4 |
7,29 |
57,7 |
2,89 |
52,0 |
1,42 |
|
60 |
341,1 |
8,53 |
63,6 |
3,18 |
55,8 |
1,53 |
|
80 |
380,4 |
9,51 |
67,0 |
3,35 |
57,6 |
1,58 |
Изменение концентрации во времени гидроксида натрия, фтористоводородной и хлористоводородной кислот в камерах концентрирования электролизера определяется подвижностью ионов натрия, фтора и хлора, создающих электрический ток, конструктивными параметрами установки и описывается уравнением
где Cнас – предельная концентрация указанных соединений; j – плотность тока; S – площадь ионообменной мембраны; q – параметр, зависящий от подвижности ионов и технологических режимов, определяемый экспериментально для каждого из указанных соединений.
Решение уравнения (1) имеет вид:
Из соотношения (2) следует, что изменение концентрации гидроокиси натрия, фтористоводородной и хлористоводородной кислот в камерах концентрирования электролизера происходит по экспоненциальному закону, в зависимости от параметра q, что совпадает с экспериментальными кривыми (рис.3). Как следует из приведенных экспериментальных исследований, для гидроокиси натрия Cнас = 380,4 г/л, q≈ 4,06·103 Кл; хлористоводородной кислоты Cнас = 57,6 г/л, q≈ 2,84·103 Кл; фтористоводородной кислоты Cнас = 67,0 г/л, q≈ 2,44·103 Кл.
Приведенные соотношения можно использовать при проектировании процесса. Результаты, полученные при исследовании процесса переработки отработанного кислого травильного раствора титанового производства, содержащего ионы титана, фтора и хлора, позволили предложить примерную технологическую схему переработки (рис.4).
Заключение
Представленные результаты, полученные при исследовании процесса переработки ОКТР, содержащего 22 г/л фторида титана, 1,7 г/л фтористоводородной кислоты и 6,2 г/л хлористоводородной кислоты без учета примесей в металлическом титане марки ВТ1-0, позволяют сделать следующие выводы.
ОКТР содержит значительные количества фторида титана, фтористоводородной и хлористоводородной кислот. Такой раствор обладает повышенной токсичностью и перед сбросом в водоем должен подвергаться очистке от примесей. Возможна переработка ОКТР с получением веществ, применяемых в производстве.
Обработка ОКТР гидроксидом натрия до рН раствора 7,6 позволяет полностью извлекать титан. После сушки и прокалки осадка окись титана может использоваться в лакокрасочной промышленности (титановые белила). Фильтрат после отделения гидроксида титана состоит из раствора фторида и хлорида натрия. Переработка этого фильтрата в четырехкамерном электролизере с катионообменными и анионообменными мембранами позволяет получать растворы гидроксида натрия и смеси фтористоводородной и хлористоводородной кислот. Гидроксид натрия допустимо использовать для обработки ОКТР с целью извлечения титана. Смесь фтористоводородной и хлористоводородной кислот после корректировки возможно применять для травления поверхности титановых заготовок.
Литература
- Лысенко М.П., Тлехусеж М.А. Титан и его применение в различных отраслях промышленности // Научное обозрение. Педагогические науки. 2019. № 4. Ч. 4. С. 64-67.
- Дьяченко А.Н., Дьяченко Е.Н., Крайденко Р.И. Диоксид титана: рынок, производство, новые технологии // Лакокрасочные материалы и их применение. 2021. № 7-8. С. 41-50.
- Петрова Т.А., Епишина А.Д. Антикоррозионная защита трубопроводного транспорта на горно-перерабатывающих предприятиях // Обогащение руд. 2023. № 6. С. 52-58. DOI: 10.17580/or.2023.06.09
- Солдатов В.Г., Вавилин Я.А. Применение титана для раскисления стали // Уральский научный вестник. 2019. Т. 9. № 2. С. 17-21.
- Zeynalov E.B., Huseynov E.R., Salmanova N.I., Abdurahmanova N.A. Nano-grade titanium dioxide on the nanocarbon carrier as catalyst in aerobic oxidation of alkyl aromatic hydrocarbons // Chemical Problems. 2020. № 3 (18). P. 351-360. DOI: 10.32737/2221-8688-2020-3-351-360
- Трушин П.В. Применение мелкогранулированного никелида титана в хирургической практике // Медицинский вестник Северного Кавказа. 2019. Т. 14. № 3. С. 472-475 (in English). DOI: 10.14300/mnnc.2019.14114
- Marin E., Lanzutti A. Biomedical Applications of Titanium Alloys: A Comprehensive Review // Materials. 2024. Vol. 17. Iss. 1. № 114. DOI: 10.3390/ma17010114
- Lakshmanan V.I., Roy R., Halim M.A. Innovative Process for the Production of Titanium Dioxide // Innovative Process Development in Metallurgical Industry. Cham: Springer, 2016. P. 359-383. DOI: 10.1007/978-3-319-21599-0_18
- Sadeghi M.H., Esfahany M.N. Development of a Safe and Environmentally Friendly Sulfate Process for the Production of Titanium Oxide // Industrial and Engineering Chemistry Research. 2022. Vol. 61. № 4. P. 1786-1796. DOI: 10.1021/acs.iecr.1c03364
- de Formanoir C., Suard M., Dendievel R. et al. Improving the mechanical efficiency of electron beam melted titanium lattice structures by chemical etching // Additive Manufacturing. 2016. Vol. 11. P. 71-76. DOI: 10.1016/j.addma.2016.05.001
- Liu Z., Tsai I.-L., Thompson G.E. et al. Chemical etching behaviour of titanium in bromine-methanol electrolyte // Materials Chemistry and Physics. 2015. Vol. 160. P. 329-336. DOI: 10.1016/j.matchemphys.2015.04.045
- Marin E., Diamanti M.V., Boffelli M. et al. Effect of etching on the composition and structure of anodic spark deposition films on titanium // Materials & Design. 2016. Vol. 108. P. 77-85. DOI: 10.1016/j.matdes.2016.06.088
- Черемисина О.В., Сергеев В.В., Федоров А.Т., Алферова Д.А. Разделение редкоземельных металлов и титана в процессе комплексной переработки апатитового концентрата // Обогащение руд. 2020. № 5. С. 30-34. DOI: 10.17580/or.2020.05.05
- Денисова О.В., Карапетян К.Г. Углеродные материалы, поверхностно модифицированные ионами переходных металлов // Цветные металлы. 2023. № 8. С. 56-61. DOI: 10.17580/tsm.2023.08.10
- Ковальская К.В., Горланов Е.С. Лигатуры Al – Ti – B: структурообразование в модифицированных сплавах // Цветные металлы. 2022. № 7. С. 57-64. DOI: 10.17580/tsm.2022.07.06
- Тюлягин П.Е., Мурашова Н.М., Морозова Я.А., Насакина Е.О. Травление титана с помощью обратных микроэмульсий додецилсульфата натрия, содержащих неорганические кислоты // Успехи в химии и химической технологии. 2021. Т. 35. № 9 (244). С. 53-55.
- Spitaels L., Rivière-Lorphèvre É., Díaz M.C. et al. Surface finishing of EBM parts by (electro-) chemical etching // Procedia CIRP. 2022. Vol. 108. P. 112-117. DOI: 10.1016/j.procir.2022.03.023
- Motasim M., Aydoğan S., Agacayak T. et al. The influence of sodium fluoride on the dissolution kinetics of metallic titanium in citric acid solution using the rotating disc method // Hydrometallurgy. 2024. Vol. 226. № 106297. DOI: 10.1016/j.hydromet.2024.106297
- Черемисина О.В., Пономарева М.А., Молотилова А.Ю. и др. Сорбционная очистка вод кислотонакопителя от железа и титана на органических полимерных материалах // Записки Горного института. 2023. Т. 264. С. 971-980. DOI: 10.31897/PMI.2023.28
- Коломенский А.Б., Шахов С.В., Коломенский Б.А. Влияние газонасыщенных слоев и оксидных пленок на ударную вязкость титановых сплавов различных групп прочности // Вестник Воронежского государственного технического университета. 2017. Т. 13. № 2. С. 132-139.
- Штефан В.В., Смирнова А.Ю. Оксидирование титана в Zr, Mo-содержащих растворах // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 2. С. 197-203. DOI: 10.7868/S0044185617020243
- Любушкин Т.Г., Носова Т.И., Кузин Е.Н. Исследование влияния добавки соединений титана на процесс коагуляционной очистки сточных вод гальванического производства // Успехи в химии и химической технологии. 2021. Т. 35. № 12 (247). С. 108-110.
- Bhattacharya S., Saha I., Mukhopadhyay A. et al. Role of nanotechnology in water treatment and purification: Potential applications and implications // International Journal of Chemical Science and Technology. 2013. Vol. 3. Iss. 3. P. 59-64.
- Кузин Е.Н., Аверина Ю.М., Курбатов А.Ю., Чередниченко А.Г. Повышение эффективности очистки сточных вод гальванических производств с использованием титансодержащих коагулянтов и мембранной очистки // Экология и промышленность России. 2024. Т. 28. № 3. С. 27-31. DOI: 10.18412/1816-0395-2024-3-27-31
- El Khalloufi M., Drevelle O., Soucy G. Titanium: An Overview of Resources and Production Methods // Minerals. 2021. Vol. 11. Iss. 12. № 1425. DOI: 10.3390/min11121425
- Karshyga Z., Ultarakova A., Lokhova N. et al. Processing of Titanium-Magnesium Production Waste // Journal of Ecological Engineering. 2022. Vol. 23. Iss. 7. P. 215-225. DOI: 10.12911/22998993/150004
- Патент № 2538900 РФ. Способ очистки сточных вод титано-магниевого производства / Н.Г.Осипенко, С.В.Кирьянов, С.А.Рзянкин, В.В.Тетерин. Опубл. 10.01.2015. Бюл. № 1.
- Патент № 2786369 РФ. Способ обработки перед напылением титан-германий (Ti-Ge) / Т.А.Исмаилов, Б.А.Шангереева, А.Р.Шахмаева, Э.Казалиева. Опубл. 20.12.2022. Бюл. № 35.
- Патент № 2758704 РФ. Способ обработки тонких листов из титана / А.П.Орлов. Опубл. 01.11.2021. Бюл. № 31.
- Патент № 2522061 РФ. Способ изготовления анодов / Л.С.Иванова, В.В.Макшаков, С.В.Задорожный. Опубл. 10.07.2014. Бюл. № 19.
- Быковский Н.А., Винокуров Е.Г., Шулаев Н.С. Экспериментальный анализ эффективности электрохимического процесса переработки сточных вод производства бикарбоната натрия с получением гидроксида натрия // Известия высших учебных заведений. Серия: Химия и химическая технология. 2021. Т. 64. № 8. С. 139-145. DOI: 10.6060/ivkkt.20216408.6445
- Мешалкин В.П., Шулаев Н.С., Быковский Н.А., Аристов В.М. Физико-химические основы комбинированной энергоресурсоэффективной технологии переработки стоков производства кальцинированной соды // Доклады Российской академии наук. Химия, науки о материалах. 2020. Т. 494. № 1. С. 45-49. DOI: 10.31857/S268695352005009X
- Bykovskii N.A., Puchkova L.N., Fanakova N.N. et al. Recycling the Wastewater in the Production of Ethylenediamine // Chemical and Petroleum Engineering. 2019. Vol. 54. Iss. 11-12. P. 787-794. DOI: 10.1007/s10556-019-00551-7
