Поведение фосфата церия (III) в карбонатно-щелочной среде
- 1 — д-р техн. наук Профессор Санкт-Петербургский горный университет императрицы Екатерины II ▪ Orcid
- 2 — Аспирант Санкт-Петербургский горный университет императрицы Екатерины II ▪ Orcid
Аннотация
Статья посвящена изучению поведения редкоземельных металлов в карбонатно-щелочных системах. Представлены результаты экспериментальных исследований в области извлечения редкоземельных элементов из фосфогипса – крупнотоннажного промышленного отхода, который образуется при производстве фосфорной кислоты. Методом выщелачивания в жидкую фазу удалось суммарно извлечь более 53 % редкоземельных элементов из старого и более 69 % из свежего фосфогипса за счет обработки твердой фазы раствором карбоната калия концентрацией 4 моль/л при температуре 90 °С. Охарактеризовано поведение модельного фосфата церия (III) в карбонатно-щелочной среде: получена изотерма растворимости, а также зависимости степени извлечения церия в раствор от температуры, концентрации карбонат-иона, межфазного отношения, интенсивности перемешивания и pH. Установлена возможность растворимых комплексов редкоземельных элементов выпадать со временем в осадок, что подтверждено на примере церия и неодима. В течение 240 ч после окончания эксперимента из жидкой фазы удалось осадить примерно 25 % церия и 17 % неодима. Подобное свойство было замечено у представителей легкой группы и не зафиксировано у элементов тяжелой группы. Способность к самоосаждению в будущем может послужить основой для разработки альтернативного подхода к разделению редкоземельных металлов на группы после извлечения в среде карбонат-иона. Также на основе анализа полученных экспериментальных данных охарактеризован механизм растворения фосфата церия (III) в карбонатно-щелочной среде. Выдвинуто предположение о том, что фосфаты редкоземельных металлов растворяются последовательно, переходя в нерастворимый карбонат, а затем в растворимый карбонатный комплекс.
Введение
Редкоземельные металлы (РЗМ, REM) – группа, состоящая из 15 лантаноидов, скандия и иттрия [1, 2]. Эти металлы нашли широкое применение в катализе, оборонной промышленности, производстве магнитов, аккумуляторов, сверхпроводников и др. [3-5]. РЗМ относятся к стратегическим металлам, а перспективным направлением их получения является переработка РЗМ-содержащего техногенного сырья [6, 7].
Природный апатит используется в качестве сырья для получения фосфорной кислоты и фосфорных удобрений, однако в процессе его обогащения и переработки образуются отходы: хвосты обогащения и фосфогипс (ФГ) [8, 9]. РЗМ, находящиеся в апатите, переходят в целевые продукты и отходы в виде примесей, причем 20-30 % РЗМ мигрируют в хвосты обогащения, 10-15 % – в H3PO4 и 60-70 % – в фосфогипс [10-12]. Так, ФГ является побочным продуктом технологии получения фосфорной кислоты и имеет в составе примерно 0,5-0,6 % РЗМ (преимущественно легких). Учитывая, что в мире накоплено более 6 млрд т такого отхода, его можно рассматривать как доступный источник РЗМ [13]. Примечательно, что преобладающими фазами РЗМ в ФГ являются монацит (PO3-4) и гипс (SO2-4), содержащие редкоземельные элементы в степени окисления +3 [14]. Среди возможных фаз фосфатная форма РЗМ – менее растворимая и хуже извлекаемая, чем остальные, поэтому для разработки технологии извлечения РЗМ необходимо исходить из ее свойств [15].
Известен метод кислотного выщелачивания редкоземельных элементов из фосфогипса [16]. Большинство последних исследований посвящено их извлечению за счет обработки лимонной или серной кислотами. Такой подход позволяет достичь высоких значений степени извлечения (более 90 %), однако требуется применение автоклавов, поскольку процесс протекает при повышенных температурах (не менее 250 °С) и концентрациях реагентов (2 моль/л H2SO4) [17, 18]. В случае применения серной кислоты для выщелачивания РЗМ уравнение реакции имеет следующий вид:
К недостаткам этого метода относятся неэкологичность (воздействие растворов кислот на окружающую среду) и отсутствие возможности извлечения кальция как основного компонента фосфогипса (превращение кальция в ценный продукт исключено) [19, 20].
Другой метод извлечения РЗМ подразумевает обработку фосфатов редкоземельных элементов (III) щелочью [21, 22]:
Предлагается использовать раствор гидроксида натрия концентрацией 50-70 % при температуре 150 °С [16]. Реакция (1) сопровождается образованием твердого гидроксида РЗМ (III), который является неустойчивым и способен превращаться в оксид РЗМ (особенно характерно для церия) [23]. Таким образом, разделение твердой смеси продуктов является задачей, для решения которой требуются дополнительные технологические операции [24].
Исследовано поведение лантаноидов в системе РЗМ (III) – CO2-3 – H2O [25, 26]. На основании анализа литературных источников карбонат-ионы могут выступать в качестве лиганда и образовывать растворимые комплексные соединения [27]:
Механизм реакции (2) мало изучен. Хотя n может принимать значения от 1 до 4, карбонатные комплексы с n = 1; 2 считаются более стабильными [28, 29]. Более того, из-за протекания процесса гидролиза образующиеся OH– и HCO-3 также могут быть лигандами. Подход (2) представляется наиболее подходящим для переработки фосфогипса, поскольку гипс (CaSO4∙nH2O) при температуре 50-90 °С в течение 4-6 ч также реагирует с карбонат-ионом с образованием ценного карбоната кальция [30-32].
Таким образом, целью данного исследования является попытка охарактеризовать механизм растворения фосфатов редкоземельных элементов (III) в карбонатно-щелочной среде на примере церия как более распространенного РЗМ в ФГ и предложить дальнейшего выделения редкоземельных элементов из карбонатных комплексов.
Методы
В качестве исходного материала, содержащего РЗМ, использовался синтетический фосфат церия (III), который предварительно был получен смешением растворов нитрата церия (0,2 моль/л) и фосфорной кислоты (0,2 моль/л):
Осаждение фосфата церия (III) осуществлялось при перемешивании в течение 30 мин с добавлением затравки. После промывки и сушки с помощью анализатора «Микросайзер 201» был определен средний размер частиц осадка – от 30 до 60 мкм. Фосфаты других редкоземельных элементов получены аналогичным образом.
Помимо синтетических осадков лантаноидов для исследований были использованы образцы свежего и старого фосфогипса из отвалов Кингисеппа (Российская Федерация). Под свежим фосфогипсом подразумевается полученный непосредственно с производства, под старым – складировавшийся на полигоне не менее одного года. По данным масс-спектрометрического анализа, в составе образцов обнаружены следующие РЗМ: Ce, Dy, Er, La, Nd, Pr, Y. Результаты анализа представлены в табл.1.
Таблица 1
Результаты масс-спектрометрического анализа образцов фосфогипса, мас.%
|
ФГ |
SO3 |
CaO |
P2O5 |
K2O |
REM2O3 |
Na2O |
SrO |
Fe2O3 |
Al2O3 |
MgO |
BaO |
|
Старый |
54,84 |
41,39 |
1,73 |
0,77 |
0,32 |
0,28 |
0,22 |
0,19 |
0,18 |
0,02 |
0,01 |
|
Свежий |
54,40 |
41,01 |
2,49 |
0,80 |
0,33 |
0,38 |
0,20 |
0,19 |
0,10 |
0,07 |
0,01 |
Все экспериментальные исследования, представленные в статье, были проведены с использованием карбоната калия в качестве выщелачивающего агента.
Растворимость фосфата церия (III) в карбонатно-щелочных системах была изучена при температуре 25-90 °С, концентрации карбоната калия 1-4,5 моль/л, межфазном соотношении 10-3000 мл/г и интенсивности перемешивания 50-1200 об/мин. Так, экспериментально получены изотерма растворимости фосфата церия (III) при 90 °С, а также зависимости степени извлечения в раствор от времени при различных концентрациях карбонат-иона, температурах, соотношениях Ж:Т, интенсивности перемешивания. Каждый эксперимент был выполнен в реакторной системе HEL Automate Reactor System не менее двух раз. Содержание РЗМ в растворах определялось методом трилонометрического титрования в присутствии индикатора арсеназо (III). Степень извлечения РЗМ в раствор рассчитывали по формуле
где C(TB) – концентрация трилона Б, М; V(TB) – объем трилона Б, мл; V(L) – объем жидкой фазы после эксперимента, л; M(REMPO4) – молярная масса фосфата РЗМ, г/моль; m(REMPO4) – масса навески фосфата РЗМ, г; V(A) – объем аликвоты, мл.
Вторичный осадок, образованный в ходе эксперимента при межфазном соотношении 100 мл/г, после фильтрования, промывки и сушки направлялся на спектроскопию комбинационного рассеяния (спектры Рамана) для идентификации.
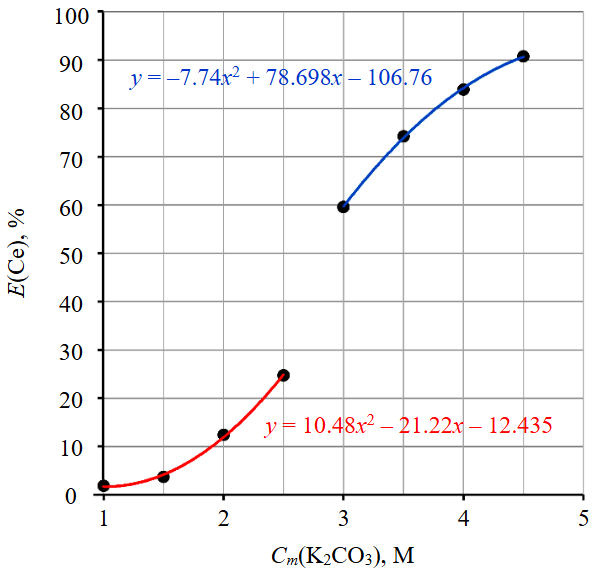
Рис.1. Изотерма растворимости фосфата церия (III)
На основании результатов, представленных в табл.1, оба образца ФГ содержат 0,3 мас.% РЗМ (в пересчете на оксиды), поэтому также были проведены эксперименты по попутному извлечению РЗМ в раствор при конверсии сульфата кальция. Исходя из свойств модельных осадков РЗМ, выщелачивание должно осуществляться при температуре 90 °C, отношении Ж:Т = 2000 мл/г, скорости перемешивания 650 об/мин, концентрации карбоната калия 4 моль/л в течение трех часов. По окончании выщелачивания твердая фаза отделялась от раствора и после промывки и сушки направлялась на масс-спектрометрический анализ.
Обсуждение результатов
Изотерма растворимости фосфата церия (III) (рис.1) получена при 90 °С, Ж:Т = 2100 мл/г и 650 об/мин и представлена в виде функциональной зависимости степени извлечения от концентрации карбоната калия. Исследования были проведены в широком диапазоне концентраций карбоната калия. Обнаружено, что в интервале 1-2,5 моль/л раствор приобретает желтую окраску, при концентрации выше 3 моль/л – оранжевую. Этот факт может свидетельствовать об изменении формы комплексного иона с CeCO+3 на Ce(CO3)-2, что теоретически является возможным.
Полученная изотерма, вероятно, характеризуется наличием трех интервалов: первый – 1-2,5 моль/л, второй –2,5-3 моль/л, третий –3-4,5 моль/л. В табл.2 описаны первый и третий участки.
Таблица 2
Характеристика изотермы растворимости фосфата церия (III)
|
C (K2CO3), моль/л |
Ионная сила, моль/кг |
E, % |
Уравнение |
Возможная растворимая форма |
|
1,0-2,5 |
3,0-7,5 |
1,9-24,7 |
y = 10,48x2 – 21,22x + 12,435 |
|
|
3,0-4,5 |
9,0-13,5 |
59,6-90,8 |
y = –7,74x2 + 78,698x – 106,76 |
|
Растворимость фосфатов обусловлена протеканием процесса комплексообразования, происходящего под влиянием карбонат-иона. В случае фосфата церия (III) межфазное отношение (рис.2) и концентрация карбонат-иона (рис.3) являются факторами, оказывающими существенное воздействие на процесс растворения.
Согласно изотерме растворимости, максимальная степень извлечения церия при температуре 90 °С соответствует концентрации карбоната калия 4,5 М и составляет 90,8 %. Таким образом, возможно протекание результирующих реакций для фосфата церия (III):
Ж:Т = 2100 мл/г – возможно протекание обеих реакций.
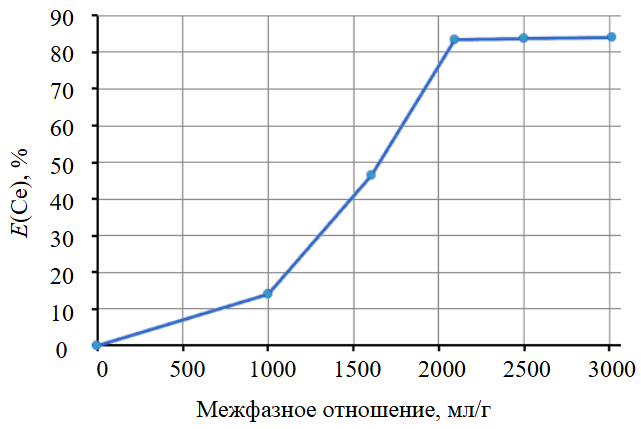
Рис.2. Влияние межфазного отношения на степень извлечения церия в раствор
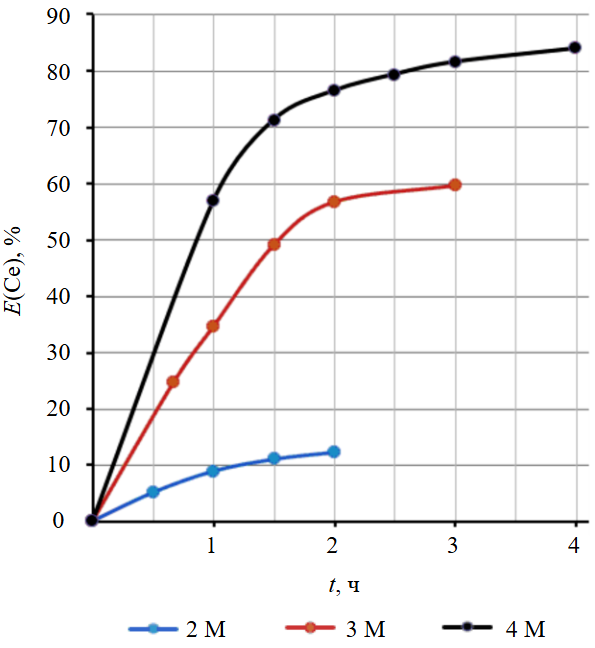
Рис.3. Зависимость степени извлечения церия в раствор от времени перемешивания при различных концентрациях карбонат-иона
Влияние отношения Ж:Т было исследовано при температуре 90 °С и концентрации карбоната калия 4 М при перемешивании в течение двух часов. Согласно полученным данным, оно оказывает воздействие на степень извлечения, поэтому для повышения растворимости необходим значительный избыток раствора карбоната калия.
Увеличение концентрации карбонат-иона закономерно приводит к повышению степени извлечения церия. Для достижения состояния, близкого к состоянию равновесия, требуется длительное время, что может указывать на возможные диффузионные ограничения (вызванные, в частности, вязкостью пульпы). Возрастание степени извлечения при увеличении концентрации косвенно указывает на образование анионного комплекса в виде ионной пары.
Установлено, что температура также оказывает воздействие на процесс растворения. На рис.4 приведены три кинетические кривые, полученные в температурном диапазоне 50-90 °С при исходной концентрации карбоната калия, равной 2 М. Экспериментально определено, что для достижения состояния равновесия требуется не менее 4 ч перемешивания, при этом зависимости обладают схожим видом. При повышении температуры степень извлечения и скорость процесса возрастают от 50 до 90 °C, на что указывает уменьшение времени, необходимого для установления состояния равновесия.
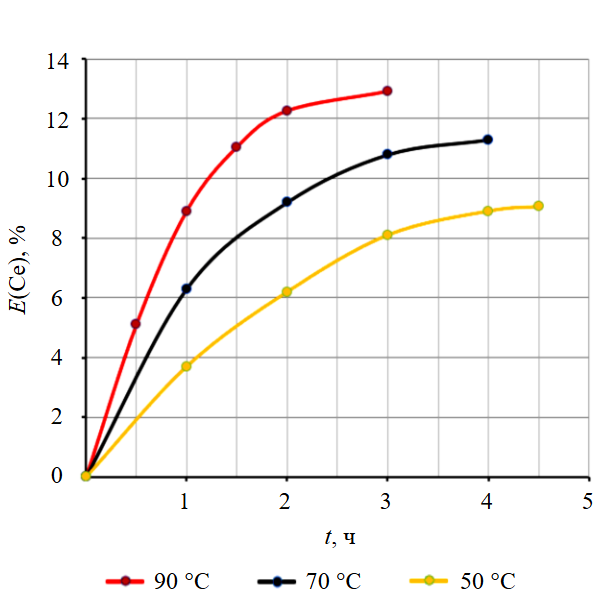
Рис.4. Влияние температуры на степень извлечения церия в раствор
Влияние скорости перемешивания на растворимость было изучено при следующих условиях: 90 °С; 4 М K2CO3; Ж:Т = 2100 мл/г; t = 1 ч. Из зависимости на рис.5 следует, что перемешивание значительно влияет на растворимость до значения 650 об/мин. Следовательно, процесс растворения фосфата церия (III) лимитируется диффузией.
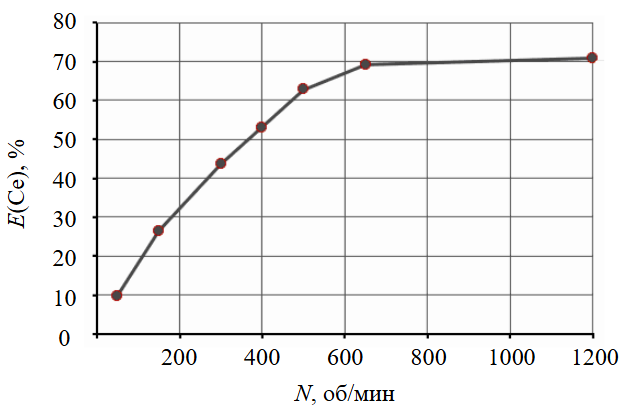
Рис.5. Влияние скорости перемешивания на степень извлечения церия в раствор
Твердая фаза была проанализирована методом спектроскопии комбинационного рассеяния (рис.6) для определения природы осадка и компонентов, входящих в его состав после обработки раствором карбоната калия. Эксперимент проводился в течение трех часов раствором K2CO3 концентрацией 4 М при температуре 90 °С, скорости перемешивания 650 об/мин и отношении Ж:Т = 100 мл/г. Осадок после выщелачивания подвергался многократной промывке от карбоната калия. Расшифровка результатов анализа выполнена при помощи базы данных RRUFF и литературных источников [33, 34].
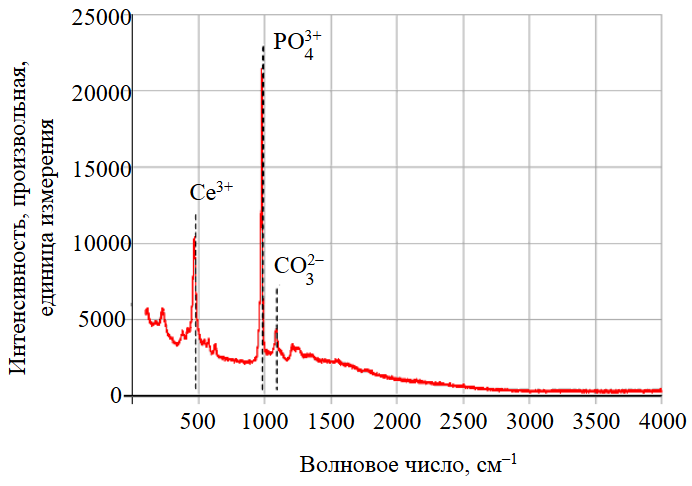
Рис.6. Спектры комбинационного рассеяния вторичного осадка церия
Спектральные пики фосфат- и карбонат-анионов особенно выделяются среди остальных, что указывает на возможность образования карбоната церия (III) как вторичного осадка. Можно предположить, что конверсия фосфата церия в карбонат является первой стадией общего процесса растворения:
В работе [35] были представлены результаты исследований кинетики процесса растворения карбонатов РЗМ (III) в карбонатно-щелочных системах. Примечательно, что растворение карбонатов происходит быстрее, чем растворение фосфатов. Поэтому можно полагать, что процесс переосаждения фосфатов является наиболее долгой стадией. Механизм растворения фосфатов РЗМ может быть описан тремя последовательными стадиями – переосаждение и две стадии комплексообразования (рис.7).

Рис.7. Возможный механизм растворения фосфата церия (III)
Еще одним фактором, оказывающим воздействие на степень извлечения церия в раствор, является уровень pH. Влияние аналогично описанному в литературном источнике [36]: добавление как кислоты, так и щелочи к смеси фосфата церия (III) и раствора карбоната калия в обоих случаях приводит к снижению растворимости. Вероятно, в качестве лиганда наряду с карбонат-анионом выступают гидроксид-анион и бикарбонат-анион, которые образуют менее стабильные комплексы. Учитывая способность фосфатов РЗМ (III) превращаться в карбонаты РЗМ (III), совместное добавление ОН– и CO2-3 может являться причиной образования гидроксикарбонатов РЗМ (III). Таким образом, для достижения высоких значений растворимости требуется внесение только карбонатного раствора без дополнительных реагентов.
Обнаружено, что некоторые растворы, содержащие карбонатные комплексы РЗМ, со временем мутнеют и образуют осадок. Подобное поведение наблюдалось у некоторых представителей легких РЗМ, в то время как комплексы тяжелых РЗМ осадок не образовывали. Так, самоосаждение РЗМ из щелока может быть использовано в качестве метода дальнейшего разделения смеси редкоземельных элементов на индивидуальные компоненты или группы. Среди редкоземельных элементов церий может быть охарактеризован как более способный к самоосаждению металла из карбонатных комплексов: за 240 ч отстаивания разрушилось 24,7 % его комплексов, при этом в случае неодима в осадок перешло лишь 17,1 %.
Метод карбонатного выщелачивания нашел применение в переработке техногенных отходов, в частности фосфогипса. Проведенные исследования указывают на возможность извлечения редкоземельных металлов из ФГ в раствор. Степень извлечения РЗМ из образцов старого и свежего фосфогипса различается. В результате экспериментов, проведенных в течение трех часов при температуре 90 °С и концентрации раствора карбоната калия 4 М удалось извлечь 53,6 % РЗМ из образцов старого ФГ и 69,6 % РЗМ из свежего ФГ. Разница в степени извлечения вызвана различиями в морфологии порошков ФГ, на что указывает их различие в цвете (образец старого ФГ – темно-серый, образец свежего ФГ – светло-серый). Такое отличие может быть вызвано фазовыми изменениями при нахождении в отвале.
Заключение
Установлен предположительный механизм растворения фосфата церия в карбонатно-щелочной среде (как одного из самых распространенных представителей РЗМ в фосфогипсе). Фосфат церия (III) последовательно превращается в карбонат церия (III) и затем переходит в растворимый карбонатный комплекс. Определено, что на степень извлечения РЗМ влияет множество факторов: температура, концентрация карбонат-иона, отношение Ж:Т, скорость перемешивания и уровень pH. Параметры, при которых экспериментально достигается максимальная растворимость синтетического фосфата церия, были установлены для конверсии образцов техногенного фосфогипса.
Так, для переработки фосфогипса может быть применен метод карбонатно-щелочной конверсии, в результате которого образуется карбонат кальция, сульфат калия и карбонатные комплексы редкоземельных металлов. Такой подход является комплексным, в отличие от разработанных ранее кислотных методов, поскольку попутно представляется возможным извлечение в раствор значительного количества РЗМ: удалось извлечь 53,6-69,6 % суммы РЗМ из различных образцов фосфогипса.
Перспективным направлением для дальнейших исследований является разделение редкоземельных элементов в карбонатно-щелочных системах, что технически возможно, поскольку некоторые лантаноиды обладают способностью к самоосаждению, в частности представители легкой группы РЗМ.
Литература
- Tominc S., Ducman V., Wisniewski W. et al. Recovery of Phosphorus and Metals from the Ash of Sewage Sludge, Municipal Solid Waste, or Wood Biomass: A Review and Proposals for Further Use // Materials. 2023. Vol. 16. Iss. 21. № 6948. DOI: 10.3390/ma16216948
- Saidakhmetov P., Piyanzina I., Faskhutdinova A. et al. Ab Initio Magnetic Properties Simulation of Nanoparticles Based on Rare Earth Trifluorides REF3 (RE = Tb, Dy, Ho) // Crystals. 2023. Vol. 13. Iss. 10. № 1487. DOI: 10.3390/cryst13101487
- Ormerod J., Karati A., Baghel A.P.S. et al. Sourcing, Refining and Recycling of Rare-Earth Magnets // Sustainability. 2023. Vol. 15. Iss. 20. № 14901. DOI: 10.3390/su152014901
- Pathapati S.V.S.H., Free M.L., Sarswat P.K. A Comparative Study on Recent Developments for Individual Rare Earth Elements Separation // Processes. 2023. Vol. 11. Iss. 7. № 2070. DOI: 10.3390/pr11072070
- Yunping Ji, Ming-Xing Zhang, Huiping Ren. Roles of Lanthanum and Cerium in Grain Refinement of Steels during Solidi-fication // Metals. 2018. Vol. 8. Iss. 11. № 884. DOI: 10.3390/met8110884
- Dzhevaga N., Lobacheva O. Reduction in Technogenic Burden on the Environment by Flotation Recovery of Rare Earth Elements from Diluted Industrial Solutions // Applied Sciences. 2021. Vol. 11. Iss. 16. № 7452. DOI: 10.3390/app11167452
- Petrova T.A., Rudzisha E., Alekseenko A.V. et al. Rehabilitation of Disturbed Lands with Industrial Wastewater Sludge // Minerals. 2022. Vol. 12. Iss. 3. № 376. DOI: 10.3390/min12030376
- Chernysh Y., Yakhnenko O., Chubur V., Roubík H. Phosphogypsum Recycling: A Review of Environmental Issues, Current Trends, and Prospects // Applied Sciences. 2021. Vol. 11. Iss. 4. № 1575. DOI: 10.3390/app11041575
- Mukaba J.-L., Eze C.P., Pereao O., Petrik L.F. Rare Earths’ Recovery from Phosphogypsum: An Overview on Direct and Indirect Leaching Techniques // Minerals. 2021. Vol. 11. Iss. 10. № 1051. DOI: 10.3390/min11101051
- Xiaosheng Yang, Makkonen H.T., Pakkanen L. Rare Earth Occurrences in Streams of Processing a Phosphate Ore // Minerals. 2019. Vol. 9. Iss. 5. № 262. DOI: 10.3390/min9050262
- Cheremisina O., Ponomareva M., Sergeev V. et al. Extraction of Rare Earth Metals by Solid-Phase Extractants from Phosphoric Acid Solution // Metals. 2021. Vol. 11. Iss. 6. № 991. DOI: 10.3390/met11060991
- Митрофанова Г.В., Черноусенко Е.В., Компанченко А.А., Калугин А.И. Особенности действия реагента-собирателя из класса алкиловых эфиров фосфорной кислоты при флотации апатит-нефелиновых руд // Записки Горного института. 2024. Т. 268. С. 637-645.
- Bin Xu, Aodong Gao, Zhouxiang Chen et al. Mechanical Properties and Optimal Mix Design of Phosphogypsum Cement Mineral Admixture Foam Light Soil // Coatings. 2023. Vol. 13. Iss. 11. № 1861. DOI: 10.3390/coatings13111861
- Kaczorowska M.A. The Latest Achievements of Liquid Membranes for Rare Earth Elements Recovery from Aqueous Solutions – A Mini Review // Membranes. 2023. Vol. 13. Iss. 10. № 839. DOI: 10.3390/membranes13100839
- Lobacheva O.L. Ion Flotation of Ytterbium Water-Salt Systems – An Innovative Aspect of the Modern Industry // Water. 2021. Vol. 13. Iss. 24. № 3493. DOI: 10.3390/w13243493
- Brückner L., Elwert T., Schirmer T. Extraction of Rare Earth Elements from Phospho-Gypsum: Concentrate Digestion, Leaching, and Purification // Metals. 2020. Vol. 10. Iss. 1. № 131. DOI: 10.3390/met10010131
- Lütke S.F., Oliveira M.L.S., Waechter S.R. et al. Leaching of rare earth elements from phosphogypsum // Chemosphere. 2022. Vol. 301. № 134661. DOI: 10.1016/j.chemosphere.2022.134661
- Virolainen S., Repo E., Sainio T. Recovering rare earth elements from phosphogypsum using a resin-in-leach process: Se-lection of resin, leaching agent, and eluent // Hydrometallurgy. 2019. Vol. 189. № 105125. DOI: 10.1016/j.hydromet.2019.105125
- Соколов И.В., Антипин Ю.Г., Рожков А.А., Соломеин Ю.М. Экогеотехнология добычи бедных руд с созданием условий для попутной утилизации отходов горного производства // Записки Горного института. 2023. Т. 260. С. 289-296. DOI: 10.31897/PMI.2023.21
- Пашкевич М.А., Алексеенко А.В., Нуреев Р.Р. Формирование экологического ущерба при складировании суль-фидсодержащих отходов обогащения полезных ископаемых // Записки Горного института. 2023. Т. 260. С. 155-167. DOI: 10.31897/PMI.2023.32
- Ochiai A., Utsunomiya S. Crystal Chemistry and Stability of Hydrated Rare-Earth Phosphates Formed at Room Tempera-ture // Minerals. 2017. Vol. 7. Iss. 5. № 84. DOI: 10.3390/min7050084
- Castro L., Blázquez M.L., González F., Muñoz J.A. Bioleaching of Phosphate Minerals Using Aspergillus niger: Recovery of Copper and Rare Earth Elements // Metals. 2020. Vol. 10. Iss. 7. № 978. DOI: 10.3390/met10070978
- Srivastava S., Pandey N.K. Low-Cost Hydrothermally Synthesized Multifunctional Rare Earth Metal Yttrium Cerium Oxide // Materials Proceedings. 2023. Vol. 14. Iss. 1. № 26. DOI: 10.3390/IOCN2023-14542
- Луцкий Д.С., Игнатович А.С. Исследование гидрометаллургического извлечения меди и рения при переработке медных некондиционных концентратов // Записки Горного института. 2021. Т. 251. С. 723-729. DOI: 10.31897/PMI.2021.5.11
- Ferri D., Grenthe I., Hietanen S. et al. Studies on Metal Carbonate Equilibria. 5. The Cerium(III) Carbonate Complexes in Aqueous Perchlorate Media // Acta Chemica Scandinavica. 1983. Vol. 37a. P. 359-365. DOI: 10.3891/acta.chem.scand.37a-0359
- Yu-Ran Luo, Byrne R. Carbonate complexation of yttrium and the rare earth elements in natural waters // Geochimica et Cosmochimica Acta. 2004. Vol. 68. Iss. 4. P. 691-699. DOI: 10.1016/S0016-7037(03)00495-2
- Lee J.H., Byrne R.H. Complexation of trivalent rare earth elements (Ce, Eu, Gd, Tb, Yb) by carbonate ions // Geochimica et Cosmochimica Acta. 1993. Vol. 57. Iss. 2. P. 295-302. DOI: 10.1016/0016-7037(93)90432-V
- Wood S.A. The aqueous geochemistry of the rare-earth elements and yttrium: 1. Review of available low-temperature data for inorganic complexes and the inorganic REE speciation of natural waters // Chemical Geology. 1990. Vol. 82. P. 159-186. DOI: 10.1016/0009-2541(90)90080-Q
- Pyagai I., Zubkova O., Babykin R. et al. Influence of Impurities on the Process of Obtaining Calcium Carbonate during the Processing of Phosphogypsum // Materials. 2022. Vol. 15. Iss. 12. № 4335. DOI: 10.3390/ma15124335
- Chan-Ung Kang, Sang-Woo Ji, Hwanju Jo. Recycling of Industrial Waste Gypsum Using Mineral Carbonation // Sustainability. 2022. Vol. 14. Iss. 8. № 4436. DOI: 10.3390/su14084436
- Cheremisina O., Sergeev V., Ponomareva M. et al. Kinetics Study of Solvent and Solid-Phase Extraction of Rare Earth Metals with Di-2-Ethylhexylphosphoric Acid // Metals. 2020. Vol. 10. Iss. 5. № 687. DOI: 10.3390/met10050687
- Amirshahi S., Jorjani E. Preliminary Flowsheet Development for Mixed Rare Earth Elements Production from Apatite Leaching Aqueous Solution Using Biosorption and Precipitation // Minerals. 2023. Vol. 13. Iss. 7. № 909. DOI: 10.3390/min13070909
- Chuting Zhang, Chaoyang Chen, Zhibin Li, Andy H. Shen. Chemical Composition and Spectroscopic Characteristics of Alexandrite Effect Apatite from the Akzhailyau Mountains of Kazakhstan // Minerals. 2023. Vol. 13. Iss. 9. № 1139. DOI: 10.3390/min13091139
- Biying Lai, Bo Xu, Yi Zhao. U–Pb Dating, Gemology, and Chemical Composition of Apatite from Dara-e-Pech, Afghani-stan // Crystals. 2024. Vol. 14. Iss. 1. № 34. DOI: 10.3390/cryst14010034
- Litvinova T., Kashurin R., Zhadovskiy I., Gerasev S. The Kinetic Aspects of the Dissolution of Slightly Soluble Lanthanoid Carbonates // Metals. 2021. Vol. 11. № 1793. DOI: 10.3390/met11111793
- Lee J.H., Byrne R.H. Examination of comparative rare earth element complexation behavior using linear free-energy relationships // Geochimica et Cosmochimica Acta. 1992. Vol. 56. Iss. 3. P. 1127-1137. DOI: 10.1016/0016-7037(92)90050-S
