Сорбционная очистка вод кислотонакопителя от железа и титана на органических полимерных материалах
- 1 — д-р техн. наук заведующий кафедрой Санкт-Петербургский горный университет ▪ Orcid ▪ Scopus
- 2 — канд. техн. наук ассистент Санкт-Петербургский горный университет ▪ Orcid ▪ Scopus
- 3 — лаборант Санкт-Петербургский горный университет ▪ Orcid
- 4 — лаборант Санкт-Петербургский горный университет ▪ Orcid
- 5 — аспирант Санкт-Петербургский горный университет ▪ Orcid
Аннотация
Получение и производство металлов из природных минерально-сырьевых источников приводит к образованию большого количества жидких, твердых и газообразных отходов разных классов опасности, оказывающих негативное влияние на окружающую среду. В производстве диоксида титана из ильменитового концентрата образуется гидролизная серная кислота, в состав которой входят различные катионы металлов, их основную часть составляют катионы железа (III) и титана (IV). Отходы гидролизной кислоты направляют на хранение в кислотонакопители, которые оказывают высокую экологическую нагрузку на окружающую среду. В статье описана технология ионообменной очистки сточных вод кислотонакопителя от катионов железа (III) и титана (IV), образующих с сульфат-ионами и компонентами органических отходов в кислых средах соединения, которые подвергаются диспергации и пылеуносу при испарении водного техногенного объекта, особенно в летний сезон. Изучен процесс сорбции комплексных катионов железа (III) [FeSO4]+ и катионов титанила TiO2+ из сернокислых растворов на катионитах КУ-2-8, Puromet MTS9580 и Puromet MTS9560. Получены изотермы сорбции как индивидуальных катионов [FeSO4]+ и TiO2+, так и в совместном присутствии. Рассчитаны значения констант равновесия при температуре 298 K и изменения энергии Гиббса. Определены емкостные характеристики сорбента для отдельно взятых катионов и в совместном присутствии.
Введение
Титановое производство является источником большого количества жидких, твердых и газообразных отходов [1-3]. В рамках производственного экологического контроля предприятия проводят мониторинг атмосферы, почв и водных объектов для оценки негативного воздействия производства на окружающую природную среду (ОВОС) [4, 5]. В настоящее время особое внимание уделяется проблемам экологической безопасности производств и утилизации отходов [6, 7]. Мировым трендом является использование отходов производств в качестве альтернативного вторичного источника получения ценных компонентов [8-10].
Отходы производства утилизируются в кислотонакопитель, состав которого и объем техногенных сточных вод с низкими значениями рН оказывают значительное влияние на состояние окружающей среды [11, 12].
Наиболее известным крупнотоннажным отходом титановой промышленности является гидролизная серная кислота, содержащая в большом количестве катионы железа и титана, которая относится ко II классу опасности и является крайне токсичным веществом, раздражает кожный покров и вызывает отек легких.
В сернокислом растворе катионы железа и титана образуют химические соединения, характеризующиеся высокой степенью токсичности. По мере увеличения времени эксплуатации кислотонакопителя и сокращения количества пресных вод, способствующих разбавлению гидролизной серной кислоты, наблюдается тенденция к падению уровня воды в накопителе ниже критической отметки, что приводит к высыханию техногенного объекта, и, как следствие, к испарению серного и сернистого ангидридов, а также пылеобразованию соединений железа и титана. Химические соединения данных металлов, характеризующиеся высокой степенью дисперсности, относятся ко II классу опасности, вызывают поражение верхних дыхательных путей [13]. Повышение температуры окружающей среды в летнее время провоцирует интенсивное испарение и других токсичных соединений, не являющихся продуктами переработки ильменита. В атмосферу в газообразном состоянии попадают соединения, содержащие также хлор и фтор органического происхождения [14].
В 2018 г. в одном из городов России была зафиксирована экологическая авария, связанная с распространением сернистого ангидрида, хлористого титана и железа из кислотонакопителя титанового производства, которая привела к эвакуации жителей города. Причину экологической катастрофы объяснили наличием более 20 млн м3 сернокислотных сточных вод, содержащих не менее 864000 т технической серной кислоты [15].
Аэрозоль серной кислоты, образующийся в атмосфере с отходящими газами титанового производства на стадиях разложения сырья, в процессе сушки и прокаливания выпадает в виде кислотных дождей даже при низких значениях атмосферного давления. Содержащиеся в парах серной кислоты взвешенные частицы соединений железа и титана выполняют роль затравочной фазы, степень кривизны которой, согласно принципу изотермической перегонки, определяет рост капель и созревание кислотных осадков.
Учитывая концентрационную особенность кислотонакопителей, отработанные сточные воды со значением рН много меньше единицы являются потенциальными источниками крупномасштабных экологических проблем регионального и федерального уровня.
Оказываемое влияние вод кислотонакопителя на гидросферу оценивается путем мониторинга поверхностных водоемов, расположенных в районе объекта размещения отходов. При анализе данных по составу загрязняющих веществ, представленных за 2018 г., сделан вывод, что в подавляющем большинстве измерений обнаружены значительные превышения ПДК по сульфат-анионам, хлорид-анионам, марганцу, железу и титану. В некоторых случаях отмечаются превышения ПДК по мышьяку и свинцу.
Следует отметить неизбежные процессы, связанные с нейтрализацией вод кислотонакопителя технологическими щелочными водами, что приводит к осаждению гидроксидов железа и титана или их соединений в виде основных солей. Попадая в подобные условия, металлы скапливаются на дне водоемов.
Наиболее простым способом снижения кислотной нагрузки на окружающую среду является нейтрализация вод кислотонакопителя щелочными агентами, что экономически оправдано. Использование более экономичного компонента нейтрализации – карбоната кальция, или негашеной извести, способно повысить рН сточных вод, однако в результате образуется эквивалентное расходуемой кислоте количество практически нерастворимого в любых средах сульфата кальция. Тысячи тонн образующегося в процессе нейтрализации гидролизной серной кислоты нерастворимого гипса спровоцируют отчуждение прилегающих населенных территорий, поэтому технология нейтрализации не является прогрессивной, отвечающей принципам «зеленой химии». Именно поэтому задача утилизации кислых вод для предприятий переработки ильменитовых руд является крайне актуальной, а решение данной проблемы позволит предприятию создать замкнутый цикл водооборота.
В первую очередь необходимо очистить сточные воды от железа и титана, соединения которых в условиях повышенных температур окружающей среды и сбросов в кислотонакопитель органических отходов образуют летучие компоненты. Очищенную от примесных соединений серную кислоту рационально использовать в основной технологии вскрытия минеральных концентратов, что, в свою очередь, существенно повысит уровень ресурсосбережения на производстве.
Основными методами очистки технологических вод различного состава от металлов, используемых в промышленных масштабах, являются экстракционные [16, 17], сорбционные [18-21] (в частности, ионный обмен [22, 23]), флотационные процессы [24, 25]. Также широко используются мембранные методы очистки стоков [26] и коагуляция [27].
В работах [28, 29] изучен процесс экстракции титана и железа из кислых растворов титанового производства и переработки ильменита. В качестве экстрагентов использовались фосфорорганические кислоты. Максимальная степень извлечения титана (IV) составила 100 % при использовании экстрагентов Д2ЭГФК и EHEHPA, для железа степень извлечения составила 95,6 и 98,9 % соответственно. Экстракционный способ очистки любых технологических объектов является наиболее эффективным, однако использование органических экстрагентов и растворителей требует организации специальных мер безопасности эксплуатации легковоспламеняемых и взрывоопасных веществ [30].
Более комфортные и менее агрессивные по отношению к окружающей среде условия переработки техногенных объектов обеспечивает использование сорбционных методов. Применение твердых регенерируемых сорбционных материалов [31] исключает использование летучих растворителей и обеспечивает селективное извлечение компонентов, в том числе из сложносолевых систем с высоким или низким показателем рН [32]. В качестве сорбционных материалов используют как природные экономически доступные материалы, [33] так и синтезированные органические полимерные смолы, которые способны проявлять большую селективность по отношению к отдельным компонентам [34, 35].
Определение термодинамических параметров процесса сорбции ионов титана (IV) и железа (III) позволит прогнозировать процесс их извлечения и очистки кислотных растворов, что является научной основой разработки технологического процесса утилизации агрессивных компонентов кислотонакопителя и условием определения параметров сорбционных установок по очистке сточных вод от агрессивных компонентов с попутным извлечением ценных металлов [36, 37].
Методы
Исследование состава вод кислотонакопителя как источника загрязнения
Для исследования состава вод кислотонакопителя отбор проб проводили при температуре 30-32 °С. Подготовка жидких проб перед анализом заключалась в удалении взвешенных частиц путем фильтрации с применением вакуум-фильтра, при необходимости проводили дополнительные операции фильтрования.
Анализ химического состава, качественное и количественное определение содержащихся веществ проводили с использованием эмиссионного спектрометра с индуктивно связанной плазмой ICPE-9000 Shimadzu (Япония), предусматривая необходимое разбавление проб в 100 и 1000 раз.
Содержание анионов в пробах вод кислотонакопителя анализировали хроматографическим способом с применением жидкостного хроматографа LC-20 Shimadzu (Япония). При измерении исследуемые пробы разбавляли в 1000 раз дистиллированной водой, после чего их подвергали компрессионной фильтрации для удаления органических соединений на специальных фильтрах (Strata C18-E). Определение концентраций сульфат-анионов проводили при разбавлении в 20000 раз.
Для определения нитрат-ионов и катионов аммония использовали потенциометрический автоматический титратор АТП-02 производства НПК «Аквилон» (Россия) с ионселективными электродами.
Подготовка сорбционных органических полимерных материалов
Выбор катионообменной смолы обусловлен, в первую очередь, доступностью ионообменного материала на отечественном рынке смол, низкой стоимостью и удовлетворительной эффективностью использования. Этим критериям отвечает отечественный катионит КУ-2-8, который представляет собой сильнокислотную смолу с гелевой структурой, получаемую сульфированием сополимера стирола с дивинилбензолом, а также катиониты производства Purolite Ltd: Puromet MTS9580 и Puromet MTS9560, матрица которых представляет собой макропористые полистирольные сшитые с дивинилбензолом каркасы. Функциональная группа катионита MTS9560 представлена фосфоновой кислотой, в то время как катионит MTS9580 содержит селективные к катионам хелатные группы.
Перед проведением исследований катиониты переводили в Н+-форму путем погружения в раствор сульфата натрия концентрацией 2 моль/л на 24 ч, декантации и помещения в раствор серной 2 н. кислоты на 2-3 ч. После соответствующих процедур ионообменную смолу отделяли от раствора серной кислоты и промывали дистиллированной водой до рН = 5.
Сорбция в статических условиях
Процесс сорбции проводили из кислых растворов, моделирующих состав технологических вод кислотонакопителя при производстве диоксида титана.
Растворы соли железа (III) готовили из сульфата железа (III) марки х.ч., растворы соли титана (IV) – из 15 % раствора титана сернокислого (III). Раствор сульфата титана (III) оставляли на сутки в контакте с воздухом, в результате чего раствор обесцвечивался с образованием катионов титанила TiO2+.
Количественное содержание индивидуальных компонентов в модельных растворах: железа (III) 0,6-107,6 ммоль/л, титана (IV) в форме титанила – 0,4-215,7 ммоль/л. При исследовании сорбции железа (III) и титана (IV) в совместном присутствии соотношение концентраций металлов задавали равным 5:1 (железа (III) 5,8-591,1 ммоль/л и титана (IV) 1,3-118,5 ммоль/л) в соответствии с их количественным соотношением в реальном растворе. Значение рН исходных растворов составляло 0,3-0,5. Исходные растворы уравновешивали с катионитами в течение 2-3 ч до достижения равновесия, доказанного результатами кинетических исследований с постоянным перемешиванием 120 кач/мин при температуре 298 K.
Для определения оптимального соотношения твердой и жидкой фаз эксперименты проводили при т:ж, равными 1:1, 1:5, 1:10 и 1:25 для всех выбранных катионообменных смол. Согласно экспериментальным данным, наибольшая степень извлечения железа (III) 43,5 % и титана (IV) 94,9 % на катионите КУ-2-8 достигнута лишь при соотношении фаз 1:1, в то время как использование катионита MTS9580 обеспечивает высокую степень извлечения (Fe 84,9 %; Ti 96,8 %) при увеличении соотношения фаз до 1:5, а катионита MTS9560 (Fe 91,5 %; Ti 98,7 %) при десятикратном увеличении жидкой фазы (т:ж = 1:10).
Величину сорбции определяли методом переменных концентраций при постоянном соотношении т:ж
где C0, C∞– концентрации железа (III) или титана (IV) в исходном и равновесном растворе соответственно, моль/л; V – объем раствора, л; mkat – масса катионита, кг.
Регенерацию катионитов проводили раствором серной кислоты концентрацией 2 н. Концентрацию железа (III) и титана (IV) в сернокислых растворах определяли титриметрическим, фотометрическим и рентгенофлуоресцентным методами на приборе PANalytical Epsilon 3 (Нидерланды).
Обсуждение результатов
Исследование состава вод кислотонакопителя как источника загрязнения
По результатам полуколичественного анализа в составе гидролизной серной кислоты выявлено присутствие следующих элементов: Al, B, Ba, Ca, Cr, Cu, Fe, K, Mg, Mn, Na, Ni, P, S, Sc, Sr, Ti, V, Z.
Количественное содержание элементов в пробе воды кислотонакопителя, мг/дм3: Al 4440; Ca 1410; Fe 44400; K 1270; Mg 15700; Na 22500; S 91100; Ti 3250. Содержание всех элементов превышает установленные для них ПДК.
Содержание сульфат-ионов в пробе воды кислотонакопителя, г/л: SO42– 299,0; SO42– (в пересчете с ICPE) 273,3.
Содержание нитратов и ионов аммония по сравнению с макрокомпонентами не столь существенно и составляет 23,7 и 10,1 мг/дм3 соответственно.
Формы существования иона железа (3+) в растворах серной кислоты
Для оценки форм нахождения катионов железа (3+) и установления характера сорбции ионов определенным типом катионита проведен термодинамический расчет содержания сульфатных комплексов железа (3+) в растворе серной кислоты. Процесс образования комплексного иона железа первой ступени координации со значением константы нестойкости KN = 6,6∙10–5 выражается следующим уравнением [38]:
Общее содержание железа (III) в растворе составляет сумму катионов железа (3+) и комплексных катионов
В соответствии с уравнением реакции (1) выражается значение константы нестойкости:
где Пγ – соотношение коэффициентов активности соответствующих ионов; в квадратных скобках – равновесные концентрации ионов.
После ряда математических преобразований получается отношение содержания комплексных катионов к общему содержанию железа (III) в растворе:
в котором значение коэффициентов активности рассчитывается по уравнению Дебая при ионной силе раствора от 0,8 до 1 моль/кг, соответствующей ионной силе реального сернокислотного раствора.
На основании проведенного расчета установлено, что в сернокислом растворе практически отсутствует ион Fe3+, в то время как доля комплексных катионов [FeSO4]+ составляет 99,9 %.
Ионообменное извлечение комплексных катионов [FeSO4]+ в статических условиях
Изотермы сорбции комплексных катионов [FeSO4]+ на катионитах КУ-2-8, MTS9580 и MT9560 при соответствующем максимальной степени извлечения компонента соотношении фаз представлены на рис.1, а.
Термодинамическое описание изотерм сорбции проводили на основании линеаризованного закона действующих масс, адаптированного к уравнению ионного обмена, с допущениями идеальности твердой фазы, а также с учетом существенной зависимости коэффициентов активности от заряда иона, и незначительной – от его индивидуальной природы [39]. Уравнение ионного обмена имеет следующий вид:
закон действующих масс:
где K – константа равновесия; Г∞ – полная емкость сорбента, моль/кг; aH+ , a[FeSO4] – активность соответствующего катиона, моль/кг; γH+ , γ[FeSO4] – коэффициенты активности соответствующих катионов.
Линейную форму закона действующих масс получаем после ряда математических преобразований. Коэффициенты активности отдельно взятых ионов выражаются через среднеионные коэффициенты активности и рассчитываются на основании справочных данных при значении ионной силы от 0,75 до 0,97 моль/кг:
Выражение (2) имеет вид линейного уравнения и .
Линейные формы изотерм сорбции комплексного иона железа (III), представляющие собой зависимость концентрационного аргумента от обратной величины сорбции , представлены на рис.1, б.
Графическим решением данного уравнения определены термодинамические характеристики сорбционного процесса, а именно константа ионообменного равновесия и значение изменения энергии Гиббса, а также значение полной емкости органических полимерных материалов, представленных в табл.1.
Таблица 1
Термодинамические и емкостные характеристики сорбции [FeSO4]+ на катионитах
|
Катионит |
Уравнение аппроксимации |
R2 |
Гпред, моль/кг |
K |
–∆G298, кДж/моль |
|
КУ-2-8 |
1/Г = 0,0054f(c) + 8,0918 |
0,99 |
0,12±0,01 |
(1,25±0,06)∙108 |
46,16±2,31 |
|
MTS9580 |
1/Г = 0,0277f(c) + 1,8284 |
–"– |
0,54±0,03 |
66,01±3,30 |
10,38±0,52 |
|
MTS9560 |
1/Г = 0,0064f(c) + 1,098 |
–"– |
0,86±0,04 |
171,56±8,58 |
12,74±0,64 |
По результатам табличных данных можно сделать вывод, что наибольшей емкостью к комплексным ионам железа (III) обладает катионит MTS9560. Значение полной емкости и предельной сорбции в пределах удовлетворительной погрешности согласуются между собой для катионитов MTS9560 и MTS9580. Однако менее значимые емкостные характеристики соответствуют катиониту КУ-2-8.
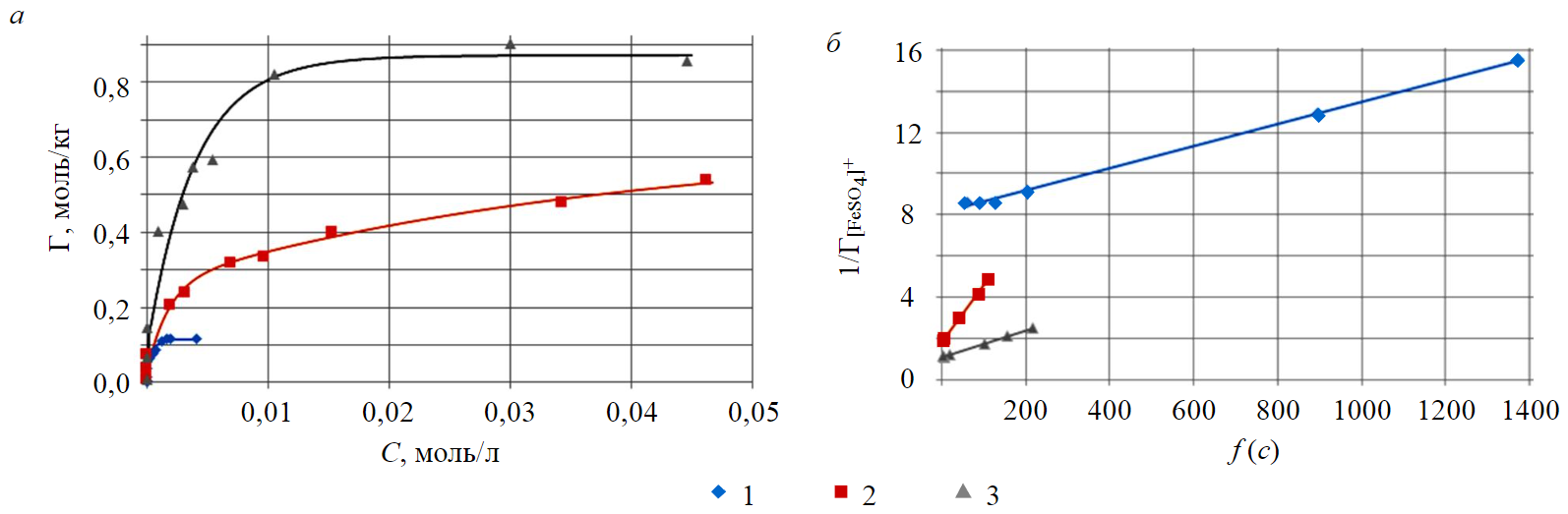
Рис.1. Изотермы сорбции [FeSO4]+ (а) и их линейные формы (б) на катионитах 1 – КУ-2-8 (т:ж = 1:1); 2 – MTS9580 (т:ж = 1:5); 3 – MTS9560 (т:ж = 1:10)
Ионообменное извлечение катионов TiO2+ в статических условиях
Изотермы сорбции титанил-иона на катионитах представлены на рис.2, а.
Описание изотерм сорбции проводилось с применение линеаризованного закона действующих масс, модифицированного к уравнению ионного обмена:
Выражение константы ионообменного равновесия имеет следующий вид:
линейная форма выражения представлена следующим уравнением:
По линейной графической зависимости концентрационного аргумента изотермы от обратной величины сорбции, изображенной на рис.2, б, рассчитаны константа и энергия Гиббса ионообменного равновесия, а также полная емкость сорбентов, представленных в табл.2.
Таблица 2
Термодинамические и емкостные характеристики сорбции TiO2+на катионитах
|
Катионит |
Уравнение аппроксимации |
R2 |
Гпред, моль/кг |
K |
–∆G298, кДж/моль |
|
КУ-2-8 |
1/Г = 0,0372f(c) + 2,8772 |
0,99 |
0,23±0,01 |
1495,53±74,78 |
18,10±0,91 |
|
MTS9580 |
1/Г = 0,0626f(c) + 0,935 |
–"– |
0,81±0,04 |
55,77±2,79 |
9,96±0,50 |
|
MTS9560 |
1/Г = 0,0017f(c) + 1,0242 |
–"– |
0,89±0,04 |
(9,07±0,45)∙104 |
28,27±1,41 |
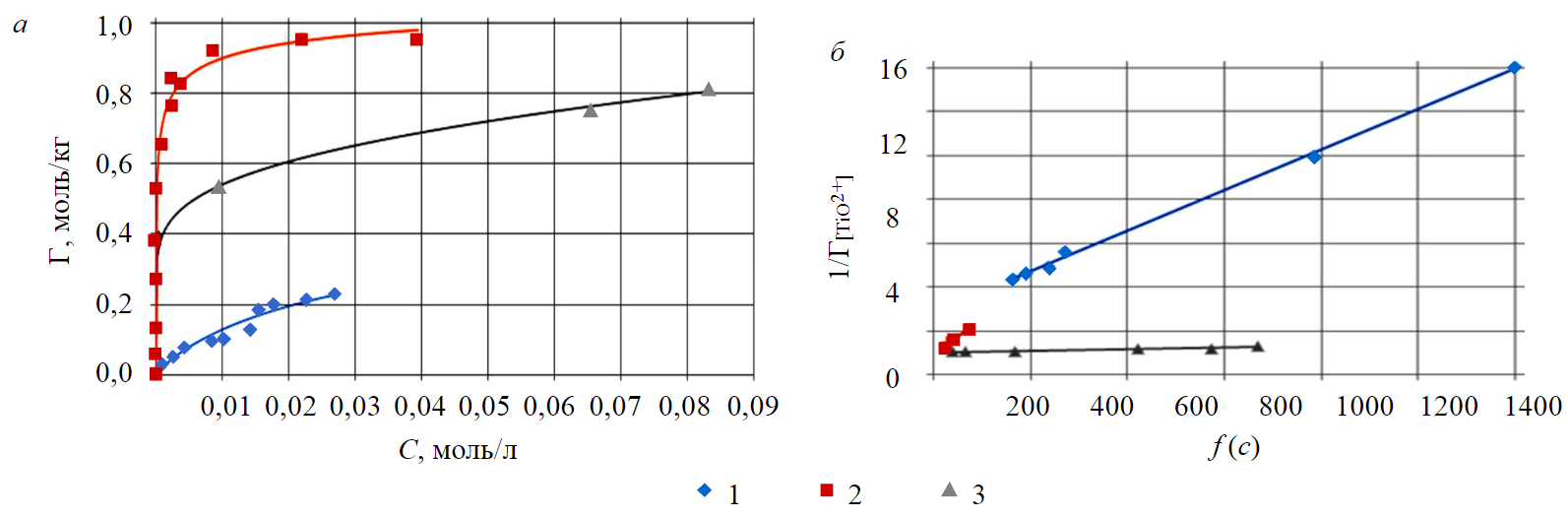
Рис.2. Изотермы сорбции TiO2+ на катионитах (а) и их линейные формы (б) на катионитах 1 – КУ-2-8 (т:ж = 1:1); 2 – MTS9580 (т:ж = 1:5); 3 – MTS9560 (т:ж = 1:10)
Из табл.2 следует, что наиболее эффективным катионитом для извлечения титана в форме титанил-иона является MTS9560.
Ионообменное извлечение смеси соединений титана (IV) и железа (III)
Рассчитаны характеристики совместной сорбции железа (III) и титана (IV) на катионитах, полученные линеаризацией изотерм сорбции с использованием модификации закона действующих масс для комплексных катионов железа (III) (2) и катиона оксотитана (IV) (3) (табл.3).
Таблица 3
Термодинамические и емкостные характеристики совместной сорбции [FeSO4]+ и TiO2+ на катионитах
|
Катионит |
Катион |
Уравнение аппроксимации |
R2 |
Гпред, моль/кг |
|
КУ-2-8 |
[FeSO4]+ |
1/Г = 0,1233f(c) + 0,3401 |
0,99 |
0,55±0,03 |
|
TiO2+ |
1/Г = 0,0432f(c) + 10,783 |
–"– |
0,10±0,01 |
|
|
MTS9580 |
[FeSO4]+ |
1/Г = 0,2449f(c) + 1,322 |
–"– |
1,29±0,06 |
|
TiO2+ |
1/Г = 0,0082f(c) + 3,848 |
–"– |
0,29±0,01 |
|
|
MTS9560 |
[FeSO4]+ |
1/Г = 0,066f(c) + 0,4209 |
–"– |
1,42±0,07 |
|
TiO2+ |
1/Г = 0,0024f(c) + 1,579 |
–"– |
0,77±0,04 |
При совместной сорбции титанила и комплексного иона железа (III) на всех катионитах наблюдается повышение предельной емкости по железу (III) и понижение по титанилу. Это, очевидно, связано с индивидуальными особенностями конкретных ионов в растворе и их коэффициентами активности. Катион оксотитана в водных растворах проявляет склонность к гидролизу: TiO2+ + H2O = TiOOH+ + H+. Частично гидролизованные ионы TiOOH+, имеющие более низкий заряд по сравнению с катионом сульфатожелеза (III), менее конкурентоспособны в процессе ионного обмена.
Более низкую сорбционную емкость имеет катионит КУ-2-8, что объясняется особенностью его строения. Несмотря на общность матрицы всех испытуемых полимерных смол, представляющих собой основу сополимера стирол-дивинилбензола, катиониты Puromet MTS9580 и Puromet MTS9560 являются макропористыми ионитами с размерами пор, превышающими размеры сорбируемых ионов. Ионообменная смола Puromet MTS9560 содержит биспиколиламиновую функциональную группу –H2N–CH2–C5H4N–, атомы азота которой создают дополнительный индуктивный эффект к сорбируемым катионам, в то время как ионообменный материал Puromet MTS9580 содержит функциональные группы, образующие тем более прочные хелаты с извлекаемыми катионами, чем большую массу они имеют.
Таким образом, для ионообменной очистки кислых водных сред, содержащих ионы железа и титана, предпочтительнее использование макропористых катионитов с губчатой структурой.
Заключение
Предприятия химической промышленности и, в частности, производители титановой продукции, как правило, являются градообразующими для любого региона, и следует учитывать, что поступление доходов в городские бюджеты обеспечивает активная деятельность предприятий, которая неразрывно сопряжена с образованием значительного количества отходов. Утилизация технологического резервуара с гидролизной серной кислотой возможна за счет поэтапного извлечения сопутствующих макрокомпонентов, что обеспечит последовательную очистку кислоты до технологических норм, установленных отраслевыми стандартами предприятия, а также позволит вторично использовать отработанные высококонцентрированные растворы серной кислоты в основной технологии производства титановой продукции.
Таким образом, возникает необходимость предотвращения негативного воздействия на окружающую среду путем применения мер по очистке сточных вод кислотонакопителя с использованием современных органических полимерных материалов.
Проведен анализ вод кислотонакопителя как источника загрязнения окружающей среды, определен их химический состав. Выявлены основные компоненты, содержащиеся в технологических водах: Al, Ca, Fe, K, Mg, Na, S и Ti.
Изучен процесс сорбции ионов железа (III) и титана (IV) из сернокислотных растворов со значением рН 0,3-0,5, соответствующим технологическим водам кислотонакопителя. В качестве сорбционного материала использованы ионообменные смолы КУ-2-8, Puromet MTS9580 и Puromet MTS9560, имеющие подобную стирол-дивинилбензольную матрицу.
Результатами термодинамического расчета обосновано существование ионных форм извлекаемых компонентов из раствора серной кислоты, имеющих состав [FeSO4]+ и TiO2+. Получены результаты ионообменного извлечения как индивидуальных ионов, так и их суммы из растворов, содержащих 0,10-10,55 мг/л железа (III), 0,03-2,47 мг/л титана (IV) и 0,3-0,5 моль/л серной кислоты.
Рассчитаны значения констант ионообменного равновесия, изменения энергии Гиббса, определяющие эффективное извлечение титана и железа из технологических растворов. Определены емкостные характеристики полимерных сорбентов. Наибольшей емкостью по отношению к железу и титану обладает катионит Puromet MTS9560: для титана величина сорбционной емкости составила 0,89±0,04 моль/кг, для железа 0,86±0,04 моль/кг. При совместном присутствии компонентов наблюдается увеличение величины сорбции железа до 1,42±0,07 моль/кг и незначительное уменьшение для титана –0,77±0,04 моль/кг.
Литература
- Чукаева М.А., Матвеева В.А., Сверчков И.П. Комплексная переработка высокоуглеродистых золошлаковых отходов // Записки Горного института. 2022. Т. 253. С. 97-104. DOI: 10.31897/PMI.2022.5
- Kudinova A.A., Poltoratckaya M.E., Gabdulkhakov R.R. et al. Parameters influence establishment of the petroleum coke genesis on the structure and properties of a highly porous carbon material obtained by activation of KOH // Journal of Porous Materials. 2022. Vol. 25. Iss. 5. P. 1599-1616. DOI: 10.1007/s10934-022-01287-1
- Иваник С.А., Илюхин Д.А. Флотационное выделение элементарной серы из золотосодержащих кеков // Записки Горного института. 2020. Т. 242. С. 202-208. DOI: 10.31897/PMI.2020.2.202
- Ahmed S.F., Mofijur M., Ahmed B. et al. Nanomaterials as a sustainable choice for treating wastewater // Environmental Research. 2022. Vol. 214. Part 1. № 113807. DOI: 10.1016/j.envres.2022.113807
- Tengfei Ma, Hanjin Luo, Kaibo Huang et al. Integrated ecological risk assessment of heavy metals in an oil shale mining area after restoration // Journal of Environmental Management. 2021. Vol. 300. № 113797. DOI: 10.1016/j.jenvman.2021.113797
- Литвинова Т.Е., Сучков Д.В. Комплексный подход к утилизации техногенных отходов минеральносырьевого комплекса // Горный информационно-аналитический бюллетень. 2022. № 6-1. С. 331-348. DOI: 10.25018/0236_1493_2022_61_0_331
- Пашкевич М.А., Коротаева А.Э. Анализ биологических методов для очистки карьерных сточных вод от азотных соединений // Геология и геофизика Юга России. 2021. Т. 11. № 4. С. 170-182. DOI: 10.46698/VNC.2021.87.18.014
- Pyagay I.N., Shaidulina A.A., Konoplin R.R. et al. Production of Amorphous Silicon Dioxide Derived from Aluminum Fluoride Industrial Waste and Consideration of the Possibility of Its Use as Al2O3-SiO2 Catalyst Supports // Catalysts. 2022. Vol. 12. № 2. № 162. DOI: 10.3390/catal12020162
- Луцкий Д.С., Игнатович А.С. Исследование гидрометаллургического извлечения меди и рения при переработке медных некондиционных концентратов // Записки Горного института. 2021. Т. 251. С. 723-729. DOI: 10.31897/PMI.2021.5.11
- Yiqian Ma, Stopic S., Xakalashe B. et al. A cleaner approach for recovering Al and Ti from coal fly ash via microwave-assisted baking, leaching, and precipitation // Hydrometallurgy. 2021. Vol. 206. № 105754. DOI: 10.1016/j.hydromet.2021.105754
- Pfaff G. Titanium dioxide pigments // Physical Sciences Reviews. 2021. Vol. 6. Iss. 11. P. 679-696. DOI: 10.1515/psr-2020-0199
- Congxue Tian, Shuanghua Huang, Ying Yang. Anatase TiO2 white pigment production from unenriched industrial titanyl sulfate solution via short sulfate process // Dyes and Pigments. 2013. Vol. 96. Iss. 2. P. 609-613. DOI: 10.1016/j.dyepig.2012.09.016
- Медведева М.С., Иванов С.В. Анализ негативного влияния загрязнения воздушного бассейна Республики Крым на увеличение заболеваний бронхолегочной патологии в данном регионе // Modern Science. 2020. № 5-3. С. 454-459.
- Дьяков Н.Н., Мальченко Ю.А., Липченко А.Е. и др. Кислотонакопитель завода «Крымский титан», экологический кризис в Северном Крыму (Армянск) и возможные пути его решения // Экологическая безопасность прибрежной и шельфовой зон моря. 2019. № 1. С. 83-95. DOI: 10.22449/2413-5577-2019-1-83-95
- Мишкова Д.В., Калайдов А.Н. Обоснование рисков на химически опасном объекте ПАО «Крымский титан» // Материалы III Международной научно-практической конференции, посвященной Всемирному дню гражданской обороны «Гражданская оборона на страже мира и безопасности», 1 марта 2019, Москва, Россия. М.: Изд-во «Академия Государственной противопожарной службы Министерства Российской Федерации по делам гражданской обороны, чрезвычайным ситуациям и ликвидации последствий стихийных бедствий», 2019. Т. 2. С. 249-256.
- Arman M.K., Srivastava B., Chatterjee M., Mandal B. Solid-phase extraction, separation and preconcentration of titanium(IV) with SSG-V10 from some other toxic cations: a molecular interpretation supported by DFT // RSC Advances. 2014. Vol. 4. Iss. 64. P. 33923-33934. DOI: 10.1039/c4ra04110k
- Petrov G.V., Fokina S.B., Nikitina T. Aspects of iridium extraction from chloride solutions // Non-ferrous Metals. 2021. № 1. P. 10-14. DOI: 10.17580/nfm.2021.01.02
- Blokhin A.A., Murashkin Yu.V., Mikhaylenko M.A. Ion Exchange Treatment of Cobalt Acetate Solutions to Remove Iron(III) Impurity // Russian Journal of Applied Chemistry. 2021. Vol. 94. Iss. 1. P. 116-121. DOI: 10.1134/S1070427221010171
- Petrov G., Zotova I., Nikitina T., Fokina S. Sorption recovery of platinum metals from production solutions of sulfate-chloride leaching of chromite wastes // Metals. 2021. Vol. 11. № 4. № 569. DOI: 10.3390/met11040569
- Нуреев Р.Р., Пашкевич М.А., Харько П.А. Оценка воздействия отходов обогащения медных руд на поверхностные и подземные воды // Геология и геофизика Юга России. 2022. № 12 (4). С. 169-179. DOI: 10.46698/VNC.2022.37.95.013
- Плохов А.С., Пашкевич М.А. Исследование очистки дренажных вод хвостового хозяйства медной обогатительной фабрики // Обогащение руд. 2022. № 3. С. 40-44. DOI: 10.17580/or.2022.03.07
- Aydin Ö., Özmetin C., Korkmaz M., Fil B.A. A semiempirical kinetic model for removal of iron (Fe3+) from saturated boric acid solution by ion exchange using amberlite IR-120 resin // Particulate Science and Technology. 2017. Vol. 35. Iss. 5. P. 505-511. DOI: 10.1080/02726351.2015.1076916
- Fernandes S., Romão I.S., Abreu C.M.R. et al. Selective separation of Cr(III) and Fe(III) from liquid effluents using a chelating resin // Water Science and Technology. 2012. Vol. 66. № 9. P. 1968-1976. DOI: 10.2166/wst.2012.406
- Lobacheva O.L. Ion Flotation of Ytterbium Water-Salt Systems – An Innovative Aspect of the Modern Industry // Water. 2021. Vol. 13. № 24. № 3493. DOI: 10.3390/w13243493
- Dzhevaga N.V., Lobacheva O.L. Reduction in Technogenic Burden on the Environment by Flotation Recovery of Rare Earth Elements from Diluted Industrial Solutions // Applied Sciences. 2021. Vol. 11. № 16. № 7452. DOI: 10.3390/app11167452
- Jafarian H., Firouzjaei M.D., Aktij S.A. et al. Synthesis of heterogeneous metal organic Framework-Graphene oxide nanocomposite membranes for water treatment // Chemical Engineering Journal. 2023. Vol. 455. № 140851. DOI: 10.1016/j.cej.2022.140851
- Jorge N., Teixeira A.R., Lucas M.S., Peres J.A. Combined organic coagulants and photocatalytic processes for winery wastewater treatment // Journal of Environmental Management. 2023. Vol. 326. Part B. № 116819. DOI: 10.1016/j.jenvman.2022.116819
- Lili Zhang, Ting-an Zhang, Guozhi Lv et al. Extraction Separation of Ti(IV) and Fe(II) Using D2EHPA from the Raffinate Obtained After Extraction of Scandium from Titanium Dioxide Waste Acid // The Journal of the Minerals, Metals & Materials Society. 2022. Vol. 74. P. 1061-1069. DOI: 10.1007/s11837-021-05118-7
- Keyu Zhu, Qifeng Wei, Huaquan Li, Xiulian Ren. Solvent extraction of titanium from ilmenite hydrochloric acid leachate: Optimization and investigation of extraction reactions of all contained metal ions // Minerals Engineering. 2022. Vol. 186. № 107744. DOI: 10.1016/j.mineng.2022.107744
- Xue Hua Mao, Dai Jun Liu. Solvent extraction and stripping of tetravalent titanium from acidic chloride solutions by trioctylphosphine oxide // Advanced Materials Research. 2012. Vol. 550-553. P. 616-621. DOI: 10.4028/www.scientific.net/AMR.550-553.616
- Asadu C.O., Anthony E.C., Elijah O.C. et al. Development of an adsorbent for the remediation of crude oil polluted water using stearic acid grafted coconut husk (cocos nucifera) composite // Applied Surface Science Advance. 2021. Vol. 6. № 100179. DOI: 10.1016/j.apsadv.2021.100179
- Izadi A., Mohebbi A., Amiri M., Izadi N. Removal of iron ions from industrial copper raffinate and electrowinning electrolyte solutions by chemical precipitation and ion exchange // Minerals Engineering. 2017. Vol. 113. P. 23-35. DOI: 10.1016/j.mineng.2017.07.018
- Billah R.E.K., Haddaji Y., Goudali O. et al. Removal and Regeneration of Iron(III) from Water Using New Treated Fluorapatite Extracted from Natural Phosphate as Adsorbent // Biointerface Research in Applied Chemistry. 2021. Vol. 11. Iss. 5. P. 13130-13140. DOI: 10.33263/BRIAC115.1313013140
- Wołowicz A., Wawrzkiewicz M. Screening of Ion Exchange Resins for Hazardous Ni(II) Removal from Aqueous Solutions: Kinetic and Equilibrium Batch Adsorption Method // Processes. 2021. Vol. 9. Iss. 2. № 285. DOI: 10.3390/pr9020285
- Ulloa L., Martínez-Minchero M., Bringas E. et al. Split regeneration of chelating resins for the selective recovery of nickel and copper // Separation and Purification Technology. 2020. Vol. 253. № 117516. DOI: 10.1016/j.seppur.2020.117516
- Víctor-Ortega M.D., Ochando-Pulido J.M., Martínez-Ferez A. Thermodynamic and kinetic studies on iron removal by means of a novel strong-acid cation exchange resin for olive mill effluent reclamation // Ecological Engineering. 2016. Vol. 86. P. 53-59. DOI: 10.1016/j.ecoleng.2015.10.027
- Abdolah R., Goodarzi V., Baghersad M.H. Introducing a new co-polymeric adsorbent with fast sorption rate and high sorption capacity for removing the heavy metal ions: A thermodynamic and kinetic study // Scientia Iranica. 2020. Vol. 28. Iss. 3. P. 1436-1451. DOI: 10.24200/sci.2020.54302.3691
- Cheremisina O.V., Chirkst D.E., Ponomareva M.A. Thermodynamic study of cerium sorption onto anionite from sulfate media // Russian Journal of Physical Chemistry A. 2013. Vol. 87. № 2. P. 288-295. DOI: 10.1134/S0036024413020349
- Черемисина О.В., Шенк Й., Черемисина Е.А., Пономарева М.А. Термодинамическая модель ионообменных процессов на примере сорбции церия из сложносолевых растворов // Записки Горного института. 2019. Т. 237. С. 307-316. DOI: 10.31897/PMI.2019.3.307
