Разработка состава и исследование свойств сорбента на основе сапонита
- 1 — канд. техн. наук научный сотрудник Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 2 — д-р техн. наук директор Научного центра Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 3 — лаборант-исследователь Санкт-Петербургский горный университет ▪ Orcid ▪ ResearcherID
- 4 — аспирант Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
Аннотация
В связи с высокими требованиями природоохранного законодательства к сбросу промышленных сточных вод необходима разработка комплексного подхода к предотвращению загрязнения природных объектов. В различных отраслях производства для извлечения тяжелых металлов из сточных вод применяются адсорбенты. В данном исследовании рассматривается возможность использования сапонитовой глины в качестве сырья для производства сорбента с целью извлечения ионов меди Cu2+ из промышленных стоков, разработана рецептура и технология получения сорбента, а также установлен его химический состав. Установлено, что оптимальная температура для термообработки сорбента соответствует 550 ºС, так как при данной температуре сапонитовые экструдаты приобретают прочностные (прочность 34,1 кг/мм2) и текстурные свойства (удельная поверхность гранулы 22,803 м2/г), позволяющие применять их в качестве сорбентов. Исследование кинетики молекулярной адсорбции проведено при использовании модельных растворов сульфата меди (II). Эффективность извлечения ионов меди (II) из модельных растворов составляет 93 %. Эффективность извлечения ионов меди (II) из стоков омеднения достигает 94 %. Результаты СЭМ подтверждают наличие металла на поверхности сорбента.
Введение
Предприятия, использующие гидрометаллургический процесс переработки руд цветных металлов, характеризуются высокой рентабельностью производств целевых товарных продуктов, вследствие чего гидрометаллургия достаточно широко распространена. Однако такие предприятия являются источником загрязнения сточных вод тяжелыми металлами, которые в большинстве случаев напрямую сбрасываются в открытые водные объекты [1]. Извлечение различных металлов и очистка сточных вод является одной из важнейших задач металлургической промышленности, для решения которой широко применяют сорбционные методы с использованием неорганических природных и синтетических минеральных сорбентов [2, 3]. Доля использования сорбентов природного происхождения для очистки промышленных сточных вод незначительна. В настоящее время активно ведутся исследования по разработке сорбционных материалов на основе природных алюмосиликатов: бентонита, монтмориллонита, кембрийской глины и т.д. [4, 5].
На территории РФ находятся невостребованные запасы сапонитовой глины в количестве 32,83 млн т. Применение данного сырья в качестве основы сорбента является мало изученной областью, исследования сапонитовой глины в основном направлены на изучение ее как мелиоранта, строительного материала [6-8].
Сапонит представляет собой глинистый минерал группы монтмориллонита, слоистый силикат с удельной поверхностью Sуд = 35-40 м2/г, объемом пор Vпор = 0,40 см3/г, пластичность глинистой основы равна 28,4 %. Сапонит обладает катионообменными свойствами, поэтому разработка специального состава сорбента и его применения для извлечения катионов Cu2+ и других тяжелых металлов является актуальной задачей.
Постановка проблемы
Анализ литературы показал, что основными характеристиками сорбента являются механическая прочность и химическая стойкость, а также эффективность сорбции и низкая себестоимость получения товарного продукта.
К сорбентам для очистки стоков предъявляют следующие требования: механическая и химическая стойкость; постоянство фракционного состава; растворимость сорбента в жидкости, выделение летучих компонентов, выделение поглощенного вещества на альтернативный материал, проницаемость; регенерационная способность с последующим использованием восстановленного сорбента в процессе очистки воды.
В межплоскостном расстоянии минерала сапонита находятся катионы Mg2+, Ca2+, которые отвечают за обменный комплекс, и молекулы воды [9]. Известно, что обменная емкость сапонита составляет 0,68 мг-экв/г [10]. Присутствие групп ОН– в структуре минерала способствует анионному обмену [11]. За счет кислотной активации глинистого минерала максимально увеличивается удельная поверхность сорбента, а ввод пептизаторов способствует проявлению лиофильных свойств [12].
Согласно проанализированным данным создание экологически чистого способа получения глинистого сорбента с целью его вовлечения в водоподготовительные процедуры после гидрометаллургических процессов является важной задачей.
Материалы и методы
В качестве основы сапонитового сорбента использовалась вязкопластичная масса декантированной сапонитовой глины одного из месторождений Архангельской обл. Основная минеральная составляющая согласно рентгенофазовому анализу представлена следующими минералами, мас.%: доломит (CaCO3·MgCO3) – 20, каолинит (Al4[Si4O10](OH)8) – 22, сапонит (Ca0,25(Mg,Fe)3((Si,Al)4O10)(OH)2·nH2O) – 45, бейделлит ((Na,Ca)0,5 – 0,3Al2(Si,Al)4O10(OH)2×nH2O) – 14 [10, 13, 14].
Сапонитовый глинистый шлам декантирован на установке Flottweg, карьерная влажность кека перед процедурой кислотной активации составляет 39 %. Процесс кислотной активации соляной кислотой концентрацией 0,1 Н, время воздействия 1 ч, щелочной нейтрализации цементом, пептизации хлоридом железа (III) глинистой вязкопластичной массы проводился в специализированном стационарном миксере [15]. Гранулы сорбента цилиндрической формы диаметром 6 мм, высотой 5-10 мм формовали экструзионным методом. Полученные гранулы подвергались удалению свободной влаги при температуре 21 °С в течение 24 ч. Затем проводилась термическая обработка гранул в муфельной печи в температурном диапазоне 400-550 °С [16].
Оценка текстурных характеристик сорбента – удельной поверхности, микро- и мезопористости, суммарного объема пор и распределения пор по размерам осуществлялась методом капиллярной конденсации на анализаторе сорбции газов NOVA 1000e Quantachrome при 77 К в среде азота как для сформованного сорбента, так и для сапонитовой основы [17]. Для подтверждения полученных результатов суммарное содержание пор по воде было определено по ГОСТ 17219-71 «Угли активные. Метод определения суммарного объема пор по воде». Радиальная прочность на раздавливание экструдатов определялась согласно ASTM D6175.
В рамках исследования кинетики ионообменной адсорбции был проведен расчет статической объемной емкости глинистого сорбента по извлекаемому иону титриметрическим методом в присутствии индикатора мурексида трилоном Б 0,05 М.
Определение адсорбционной активности полученного сорбента по отношению к катионам Cu2+ с расчетом изотермы сорбции проводилось в статических условиях [18]. В колбу емкостью 100 мл, заполненную модельным раствором, вносили навеску сорбента в соотношении, равном 1/50 [19]. В качестве модельного раствора использовался раствор сульфата меди концентрацией от 0,25 до 2,1 мг/дм3. Навески сорбентов интенсивно перемешивали в течение 20 мин на встряхивающем аппарате, затем оставляли в состоянии статики в течение 30 мин с периодическим встряхиванием от 1 до 2 мин. Время адсорбционного эксперимента – 50 мин. Эффективность извлечения катионов меди из растворов определялась согласно ГОСТ 4388-72 «Вода питьевая. Методы определения массовой концентрации меди» [20, 21].
С целью апробации сорбента были взяты медьсодержащие стоки после гальванической ванны омеднения электролитом на основе пирофосфата калия (K4P2O7).
Эксперименты проводили следующим образом: в лабораторные фильтрующие колонны с пластиной-фильтром (пор 100) объемом 300 мл загружался сорбент цилиндрической и полуцилиндрической формы диаметром 6 мм. Объeм медьсодержащего стока с исходной концентрацией Снач = 18,0 мг/дм3 и рН = 8,64 в фильтрующей колонне составлял 100 мл, время адсорбционного воздействия – 24 ч, масса сорбента в фильтрующей колонне – 20 г.
Исследование морфологии образцов гранул сорбента до и после сорбции выполнялось с помощью электронного растрового микроскопа фирмы TESCAN Vega 3 [22].
Результаты и обсуждение
Химический анализ сапонитовой глины и полученного сорбента приведен в табл.1. Результаты оксидного состава показали, что наиболее важными основными компонентами материала до и после обработки химическими веществами с последующей термообработкой глины являются соединения кремния, магния, кальция.
Таблица 1
Химический состав основы сорбента и сформованного сорбента после термообработки
|
Проба |
Содержание, мас.% |
||||||||
|
SiO2 |
MgO |
CaO |
Fe2O3 |
SO3 |
K2O |
TiO2 |
Al2O3 |
Прочее |
|
|
Сапонитовая глина перед формовкой сорбента |
52,73 |
22,14 |
4,58 |
9,91 |
– |
1,68 |
1,52 |
5,73 |
1,71 |
|
Сорбент после термообработки при 550 °С |
41,10 |
17,89 |
28,55 |
1,99 |
1,01 |
0,91 |
0,37 |
5,68 |
2,5 |
Текстурные и прочностные характеристики полученного сорбента в зависимости от термического режима представлены в табл.2.
Таблица 2
Результаты измерения пористости образцов сапонитовой основы после высокотемпературной обработки
|
Образец |
Удельная |
Общий объем пор Vпор, см3/г |
Распределение пор по диаметрам, % |
Прочность гранул, кг/мм2 |
||||
|
0-20 Å |
20-50 Å |
50-100 Å |
100-320 Å |
>320 Å |
||||
|
1. Сапонитовая основа |
30,352 |
0,21 |
0,081 |
12,57 |
10,67 |
11,9 |
64,76 |
14,1 |
|
2. Обработка при Т = 400 °С |
36,653 |
0,61 |
0 |
0,51 |
0,43 |
0,51 |
98,4 |
23,6 |
|
3. Обработка при Т = 500 °С |
21,192 |
0,48 |
0 |
0,44 |
0,92 |
0,5 |
98,54 |
22,3 |
|
4. Обработка при Т = 550 °С |
22,803 |
0,44 |
0 |
3,86 |
5,0 |
5,68 |
85,45 |
34,1 |
|
5. Обработка при Т = 600 °С |
18,497 |
0,49 |
0 |
3,06 |
4,9 |
4,49 |
87,55 |
44,96 |
Из полученных данных видно, что с повышением температуры обработки глинистой основы сорбента удельная площадь поверхности снижается [23], по распределению пор диаметр меняется незначительно. Механическая прочность сорбента, обработанного при температуре 400-500 °С, теряется при взаимодействии с модельным раствором, происходит набухание глины, что приводит к засорению модельного раствора частицами глины из-за того, что межкристаллическая вода из глинистой частицы выходит не в полной мере. Согласно измерениям механической прочности экструдатов на раздавливание можно сделать вывод, что самые прочные гранулы сорбента получены при температуре обжига 600 °С. Однако обработка сорбента при температуре 600 °С приводит к спеканию алюмосиликатных слоев, что снижает удельную поверхность сорбента, в свою очередь уменьшается адсорбционная емкость сорбента. Вследствие этого термическую обработку для получения сорбента принято проводить в диапазоне 500-550 °С.
Исследования кинетики молекулярной адсорбции и статической сорбционной емкости, лимитирующей стадии процесса ионного обмена
На рис.1 представлены кинетическая кривая сорбции ионов меди глинистым сорбентом, а также изменение их концентрации в зависимости от времени контакта твердой и жидкой фаз. Начальные концентрации модельных растворов не использовались при построении кинетической зависимости, они представлены на легенде гистограммы. График отображает зависимость кинетики молекулярной адсорбции начиная с момента титрования, за начальную точку построения кривых принимается обработанный начальный раствор (0 мин) с отличной концентрацией из-за наличия примесей (используемых для реакции титрования).
Из рис.1 видно, что адсорбционное равновесие достигается для концентрации 0,0281 моль/л – на 80-й минуте; для концентрации 0,0155 моль/л на 40-й минуте; для концентраций 0,043 и 0,022 моль/л – на 130-й минуте. Таким образом, к 130-й минуте опыта равновесие достигается всеми растворами с рассматриваемыми концентрациями ионов меди (II) при соотношении сорбента и модельного раствора 1:50 [24]. При этом величина сорбционной емкости достигает 1,2 моль/кг.
Статическая обменная емкость (СОЕ) и константы скорости (K) реакции ионного обмена, соответствующие тангенсу угла наклона зависимости для различных концентраций [25, 26], приведены в табл.3. Сорбция ионов меди из раствора глинистым сорбентом протекает в соответствии с кинетической моделью первого порядка, что продемонстрировано на примере зависимости lgC = f(t) для концентрации ионов меди 0,022 моль/л (рис.2), с коэффициентом детерминации, равным 0,966.
Таблица 3
Расчетные параметры модели адсорбции Cu2+ гранулами сапонитового сорбента в статических условиях
|
Cнач, моль/л |
Скон, моль/л |
α*, % |
СОЕ, моль/кг |
R2 |
K |
|
0,036 |
0,012 |
72,1 |
0,043 |
0,88 |
0,043 |
|
0,028 |
0,013 |
53,6 |
0,028 |
0,97 |
0,015 |
|
0,022 |
0,009 |
61,4 |
0,021 |
0,94 |
0,023 |
|
0,016 |
0,007 |
56,3 |
0,015 |
0,91 |
0,036 |
*a − текущая степень очистки воды.
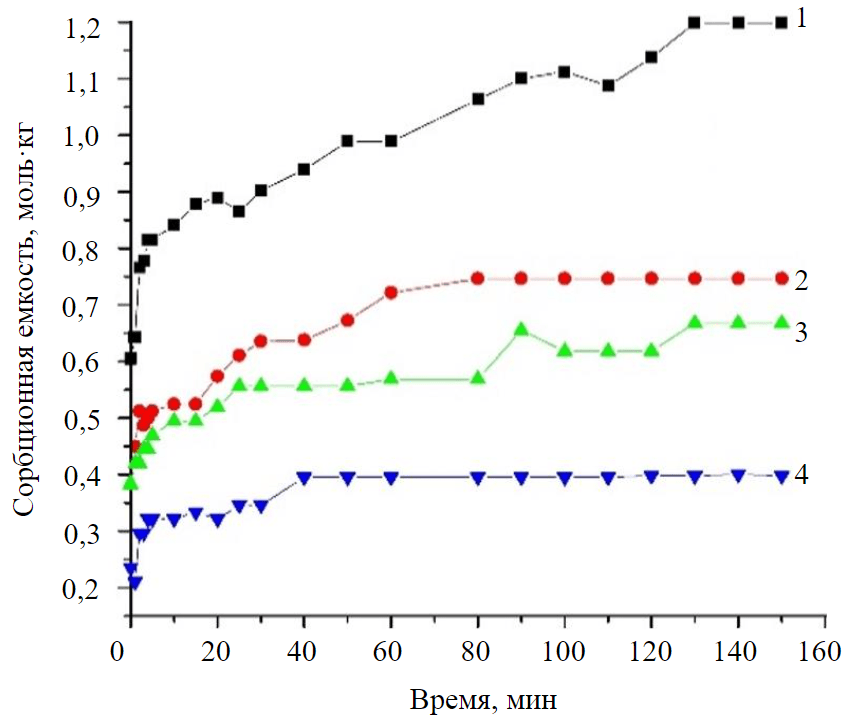
Рис.1. Кинетические кривые сорбции ионов меди на глинистом сорбенте при различных исходных концентрациях модельного раствора 1 – 0,043; 2 – 0,0281; 3 – 0,022; 4 – 0,0155 моль/л
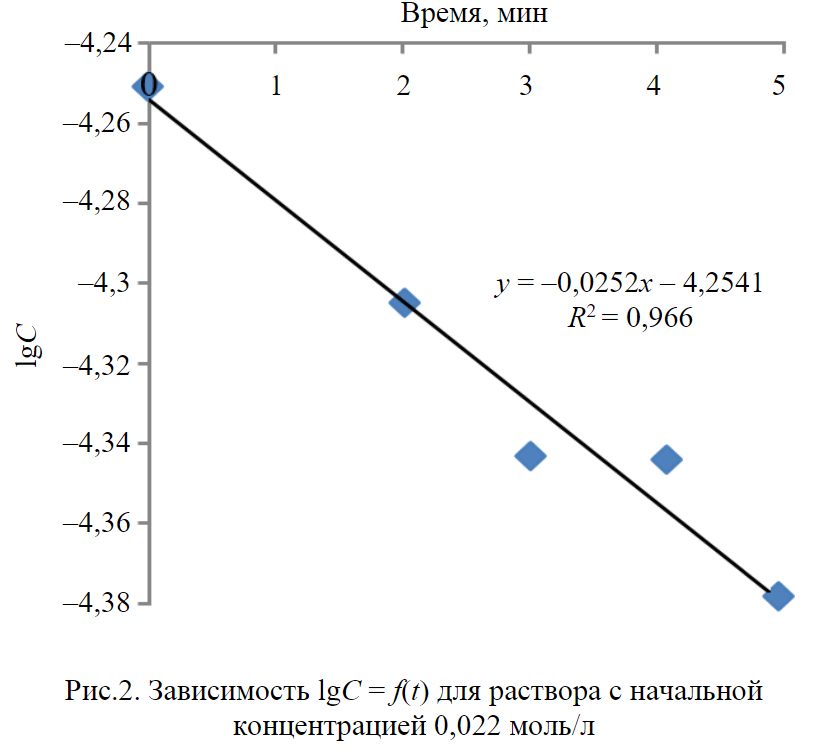
Рис.2. Зависимость lgC = f(t) для раствора с начальной концентрацией 0,022 моль/л

Рис.3. Процесс сорбции: исходный раствор гальванического стока (слева), очищенная вода с адсорбированной медью (справа)
Данные, полученные по лимитирующей стадии процесса, свидетельствуют о «пленочной» кинетике и указывают на внешнюю диффузию при высоких концентрация, что визуализируется по истечении сорбционного времени на поверхности гранул (рис.3). Снижение статической объемной емкости согласуется с зависимостью снижения СОЕ от концентрации ионов в воде [27].
Экспериментальные данные анализировали с использованием кинетической модели адсорбции первого порядка, где скорость химической реакции не зависит от концентрации ионов Cu2+ и определяется соотношением количества вносимого сорбента и раствора (ж:т), что характерно для гетерогенного процесса, идущего на поверхности раздела фаз [28, 29].
Согласно полученным данным осаждение CuSO4 на глинистом сорбенте можно описать по следующей схеме [30, 31]:
Таким образом, на поверхности сорбента наблюдается многослойная «пленочная» сорбция, сначала за счет Cu(OH)2 – голубой участок на сорбенте, а затем за счет малой растворимости CuO – черный участок на сорбенте.
Определение адсорбционной активности в статических условиях
Исследования сорбционной активности по отношению к катиону Cu2+ проводились с образцом сорбента после термической обработки при 550 °С, механическая прочность полученного образца 34,1 кг/мм2, Sуд = 22,8 м2/г.
При измерении удельной поверхности сформованного лабораторного образца, термически обработанного при 550 °С, наблюдается снижение удельной поверхности из-за ввода цемента, но при этом увеличиваются прочностные характеристики гранулы сорбента.
Степень извлечения ионов меди из модельного раствора с разной концентрацией в статических условиях на полученном сорбенте и эффективность очистки представлены в табл.4.
Установлено, что эффективность сорбционного извлечения ионов Cu2+ из модельного раствора составила 86,3-100 % в зависимости от концентрации. В табл.5 приведены параметры изотермы для полученного образца сорбента, по полученным данным построена изотерма сорбции (рис.4) [32].
Таблица 4
Степень извлечения ионов меди (II) из модельного раствора
|
Сисх, мг/дм3 |
Скон, мг/дм3 |
Эад, % |
|
0,25 |
0 |
100 |
|
0,5 |
0,05 |
99 |
|
1,25 |
0,07 |
94,6 |
|
1,75 |
0,17 |
86,3 |
|
2,1 |
0,23 |
89 |
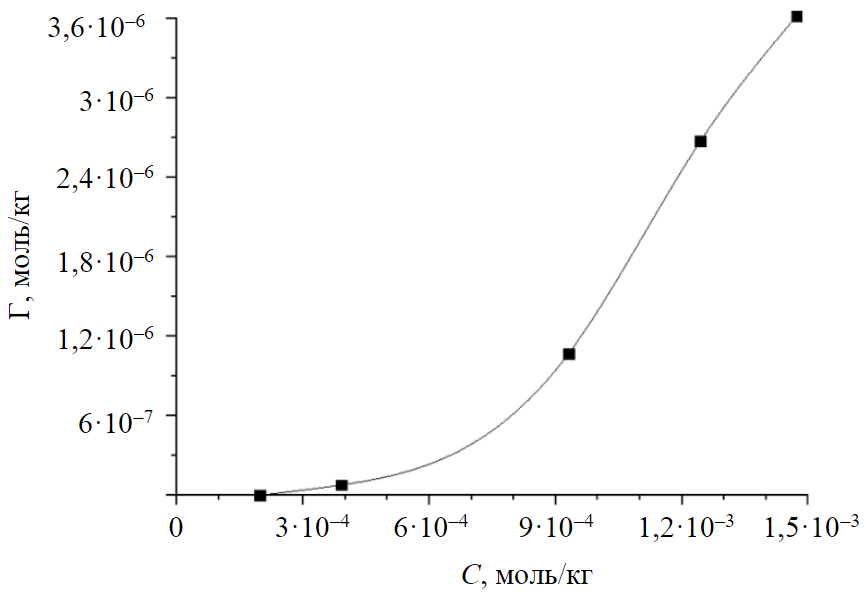
Рис.4. Изотерма сорбции ионов Cu2+ на глинистом сапонитовом сорбенте
Согласно данным, полученным на анализаторе Quantachrome NOVA, изотерма носит характер типа V-БЭТ (Брунауэр, Эммет и Теллер), коэффициент корреляции R = 0,99, KБЭТ = 7,176, представляет собой многослойную изотерму адсорбции, также относящуюся к изотермам типов II и III, в которых адсорбция ограничена мезопорами. В случае адсорбции модельного раствора на сапонитовой глине механизм адсорбции представляет собой моно- и многослойную адсорбцию плюс капиллярную конденсацию. Можно сделать вывод, что сорбция меди протекает сначала по модели Фрейндлиха и заключается в заполнении мономолекулярного слоя, далее процесс проходит по модели БЭТ и представляет образование полимолекулярных слоев.
Таблица 5
Экспериментальные данные сорбции Cu2+ на глинистом сапонитовом сорбенте
|
C0, моль/л |
C∞, моль/л |
Г, моль/кг |
lgC |
lgГ* |
1/C, моль/кг |
1/Г, моль/кг |
ns·10–5, г/л |
Уравнение |
Гмак, ммоль/г |
|
3,94·10–6 |
1,57·10–10 |
1,97·10–4 |
–9,80 |
–3,70 |
6,35·109 |
5,08·103 |
1,25 |
Г = 0,0143С0,1965 |
7,8·10–4 |
|
7,87·10–6 |
7,72·10–8 |
3,9·10–4 |
–7,11 |
–3,41 |
1,30·107 |
2,57·103 |
2,48 |
||
|
1,97·10–5 |
1,07·10–6 |
9,31·10–4 |
–5,97 |
–3,03 |
9,34·105 |
1,07·103 |
5,91 |
||
|
2,76·10–5 |
2,68·10–6 |
1,2·10–3 |
–5,57 |
–2,91 |
3,74·105 |
8,04·102 |
7,90 |
||
|
3,31·10–5 |
3,62·10–6 |
1,47·10–3 |
–5,44 |
–2,83 |
2,76·105 |
6,79·102 |
9,35 |
Примечания: ns – количество сорбированного вещества CuSO4 ; C∞ – текущая концентрация катиона металла в растворе, моль/л; С0 – исходная концентрация катиона металла в растворе, моль/л; Г – величина статической обменной емкости, моль/кг; Гмак – общая величина статической обменной емкости, ммоль/г.
Апробационные исследования в динамических условиях
Для определения адсорбционных свойств гранул сорбента, приближенных к промышленным условиям, были проведены эксперименты по адсорбции ионов Cu2+ из сточной воды после гальванических ванн омеднения с производственной площадки [33, 34]. Перед началом эксперимента с помощью рентгенофлуоресцентного анализатора определялся химический состав исходной воды, поступающий на очистку. Было проведено шесть экспериментальных серий. Результаты до (исходная концентрация) и после (образцы 1-5) сорбционной очистки сточных вод представлены на рис.5.
По результатам измерений можно сделать вывод, что активная адсорбция ионов меди из раствора осуществляется на вторые-третьи сутки эксперимента, помимо сорбции медьсодержащего вещества на поверхности сорбента происходит частичная сорбция фосфорсодержащего соединения, входящего в состав электролита [35]. Повышение содержания соединений железа в воде происходит после вымывания из сорбента хлорида железа, вводимого в состав сорбента как пептизирующая добавка.
Результаты спектрометрического анализа сточной воды и эффективности очистки после сорбции представлены в табл.6, исследования для точности результатов проводились параллельно. Номер серии соответствует модельному раствору, пропускаемому через колонны на протяжении 6 сут (с постоянным обновлением раствора). Одновременно с измерением содержания Cu2+ в очищенной сточной воде фиксировался рН водной среды после прохождения стока через слой сорбента. Начальная концентрация составляет 18 мг/дм3
Полученные данные согласуются с рис.3, адсорбция на поверхности сорбента осуществляется в первые 2-3 сут., далее процесс происходит менее интенсивно. Адсорбция увеличивается с увеличением рН, процент сорбированных ионов резко возрастает в узком диапазоне рН, полное насыщение сорбента достигается при рН выше 9. Выше этого диапазона рН и до рН, равного 11, растворы меди состоят из положительно заряженных ионов (Cu2+, CuOH+), а также нейтральных частиц (Cu(OH)20, CuSO40), сильнокислые растворы состоят из одиночных катионов Cu2+.
Таблица 6
Результаты исследований сорбционной очистки
|
Номер серии |
Скон после сорбции, мг/дм3 |
Эф, % |
рН |
|||
|
Колонна 1 |
Колонна 2 |
Колонна 1 |
Колонна 2 |
Колонна 1 |
Колонна 2 |
|
|
1 |
0,98 |
1,08 |
94,5 |
94 |
12,51 |
12,58 |
|
2 |
0,98 |
1,04 |
94,5 |
94,2 |
12,19 |
12,27 |
|
3 |
5,7 |
5,3 |
68,3 |
70,6 |
11,70 |
11,74 |
|
4 |
10,6 |
11,0 |
41,1 |
38,9 |
11,25 |
11,32 |
|
5 |
7,0 |
6,0 |
61,1 |
61,1 |
11,58 |
11,65 |
|
6 |
15,0 |
15,0 |
16,7 |
16,7 |
9,94 |
10,01 |
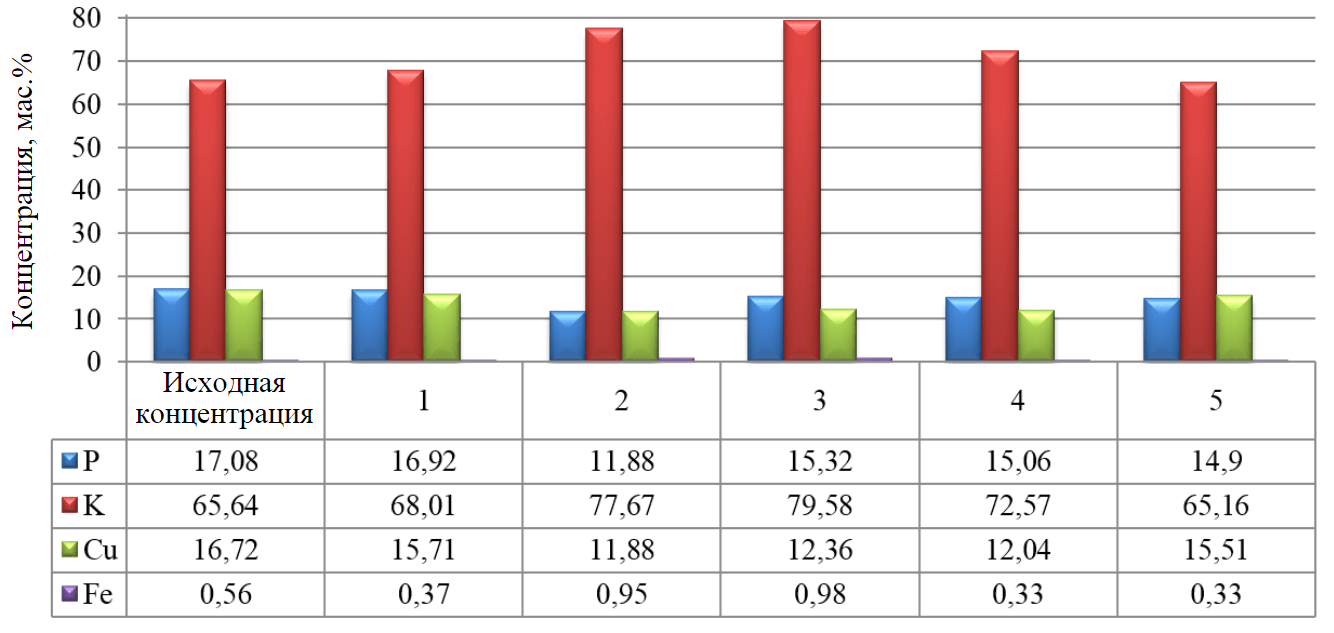
Рис.5. Гистограмма содержания оставшихся элементов в сточной воде (мас.%), полученных на XRF (Epsilon) 1-5 – номер образца

Рис.6. СЭМ-изображения: сапонитовый сорбент (а); сапонитовый сорбент после сорбции (б); внешний вид сорбента после сорбции ионов меди (в)
Морфологические исследования сорбента
Микрофотографии структур, представленные на рис.6, показывают, что на поверхности сорбента образовываются поры и после адсорбции поверхность сапонитового сорбента становится шероховатой и рыхлой в результате поверхностных реакций. Результаты СЭМ твердого продукта после адсорбции согласуются с результатами, полученными в предыдущем исследовании.
СЭМ-изображения исходного сапонитового сорбента и сапонитового сорбента, адсорбировавшего медь, представлены на рис.6. Свежесформованный сорбент имеет поры на поверхности (рис.6, а). На рис.6, б видно, что происходит массоперенос ионов меди на поверхность сапонитового сорбента, приводящий к уменьшению пор за счет заполнения пор адсорбированной медью.
Заключение
В статье рассмотрены перспективы применения глинистого сорбента на основе сапонитового декантированного шлама для извлечения меди из сточных вод промышленных предприятий. Наиболее значимые выводы исследований:
Декантированная сапонитовая глина представляет собой вязкопластичный материал, гранулам можно легко придать оптимальную форму экструзионным способом. Гранулы после термообработки при температуре 550 °С приобретают удовлетворительную стойкость (прочность 34,1 кг/мм2) при взаимодействии с водной средой, а также высокую относительную пористость, удельная поверхность гранул 22,803 м2/г, что позволяет использовать их в качестве адсорбента для очистки сточных вод.
Гранулы обладают достаточно высокой адсорбционной способностью в отношении ионов меди (72 % при статических условиях) и могут быть использованы для их удаления из водных растворов при температуре окружающей среды 21 °С. Кинетика адсорбции меди удовлетворительно описывается кинетической моделью первого порядка. Адсорбция металла гранулами сапонитового сорбента точно описывается изотермой V типа. Механизм адсорбции представляет собой моно- и многослойную адсорбцию и капиллярную конденсацию.
Эффективность удаления Cu2+ из сточной воды после ванн омеднения гальванического цеха наглядно продемонстрирована с помощью динамических испытаний, эффективность достигает 94 %. Результаты морфологических исследований свидетельствуют о присутствии металлов на поверхности глины.
Литература
- Каграманов Г.Г., Фарносова Е.Н., Лин М.М. и др. Удаление тяжелых металлов из шахтных сточных вод // Химическая промышленность сегодня. 2018. № 1. С. 44.
- Litvinenko V.S., Sergeev I.B. Innovations as a Factor in the Development of the Natural Resources Sector // Studies on Russian Economic Development. 2019. Vol. 30. Iss. 6. Р. 637-645. DOI: 10.1134/s107570071906011
- Jaspal D., Malviya A. Composites for Wastewater Purification: A Review // Chemosphere. 2019. Vol. 246. № 125788. DOI: 10.1016/j.chemosphere.2019.12
- Кошелев А.В., Веденеева Н.В., Заматырина В.А. и др. Разработка технологии получения сорбентов на основе бентонитовых глин для систем очистки воды // Вода и экология: проблемы и решения. 2018. № 2 (74). С. 32-39. DOI: 10.23968/2305-3488.2018.20.2.32-39
- Лебедев А.Б., Утков В.А., Халифа А.А. Использование спеченного сорбента для удаления сероводорода из отходящего промышленного газа при грануляции металлургических шлаков // Записки Горного института. 2019. Т. 237. С. 292-297. DOI: 10.31897/PMI.2019.3.292
- Pashkevich M.A., Alekseenko A.V. Reutilization Prospects of Diamond Clay Tailings at the Lomonosov Mine, Northwestern Russia // Minerals. 2020. Vol. 10. Iss. 6. № 517. DOI: 10.3390/min10060517
- Наквасина Е.Н., Романов Е.М., Шабанова Е.Н. и др. Применение сапонит-содержащих материалов в качестве минерального удобрения при выращивании картофеля в Архангельской области // Вестник Красноярского государственного аграрного университета. 2019. № 1. С. 60-68.
- Облицов А.Ю., Рогалев В.А. Перспективные направления утилизации отходов обогащения алмазоносной породы месторождения имени М.В.Ломоносова // Записки Горного института. 2012. Т. 195. С. 163-167.
- Besselink R., Stawski T.M., Freeman H.M. et al. Mechanism of saponite crystallization from a rapidly formed amorphous intermediate // Crystal Growth & Design. 2020. Vol. 20. Iss. 5. P. 3365-3373. DOI: 10.1021/acs.cgd.0c00151
- Миненко В.Г. Обоснование и разработка электрохимического метода извлечения сапонита из оборотных вод // Физико-технические проблемы разработки полезных ископаемых. 2014. № 3. С. 180-186.
- Иванов М.В., Чиркст Д.Э. Изучение ионного обмена в грунтах с целью их очистки от тяжелых металлов // Записки Горного института. 2002. № 1 (150). C. 116-119.
- Eren E. Removal of copper ions by modified Unye clay, Turkey // Journal of Hazardous Materials. 2008. Vol. 159. Iss. 2-3. P. 235-244. DOI: 10.1016/j.jhazmat.2008.02.035
- Smyshlyaeva K.I., Rudko V.A., Kuzmin K.A., Povarov V.G. Asphaltene genesis influence on the low-sulfur residual marine fuel sedimentation stability // Fuel. 2022. Vol. 328. № 125291. DOI: 10.1016/j.fuel.2022.125291
- Камешков А.В., Кондрашева Н.К., Габдулхаков Р.Р., Рудко В.А. Сравнительная характеристика нефтяных коксующих добавок из различных видов нефтяного сырья // Цветные металлы. 2020. № 10. С. 35-42. DOI: 10.17580/tsm.2020.10.05
- Атаманова О.В., Тихомирова Е.И., Касымбеков Ж.К., Подоксенов А.А. Повышение сорбционной способности модифицированного бентонита при очистке сточных вод путем его активации // Вода и экология: проблемы и решения. 2020. № 1(81). DOI: 10.23968/2305-3488.2020.25.1.3-12
- Petra L., Billik P., Melichová Z., Komadel P. Mechanochemically activated saponite as materials for Cu2+ and Ni2+ removal from aqueous solutions // Applied Clay Science. 2017. № 143. Р. 22-28. DOI: 10.1016/j.clay.2017.03.012
- Litvinova Т., Kashurin R., Zhadovskiy I., Gerasev S. The Kinetic Aspects of the Dissolution of Slightly Soluble Lanthanoid Carbonates // Metals. 2021. Vol. 11. Iss. 11. № 1793. DOI: 10.3390/met11111793
- Xiaoliang Qi, Ruona Liu, Mengyu Chen et al. Removal of copper ions from water using polysaccharide-constructed hydrogels // Carbohydrate Polymers. 2019. Vol. 209. Р. 101-110. DOI: 10.1016/j.carbpol.2019.01.015
- Феденко Ю.Н., Печончик И.Ю. Влияние дозы бентонита на сорбционное извлечение Pb{2+} и Cd{2+} // Современные тенденции в развитии водоснабжения и водоотведения: Материалы Международной конференции, посвященной 145-летию УП «Минскводоканал», 13-14 февраля 2019, Минск, Беларусь. Белорусский государственный технологический университет, 2019. Ч. 2. С. 118-119.
- Курдюмов В.Р., Тимофеев К.Л., Мальцев Г.И., Лебедь А.Б. Сорбционное извлечение ионов никеля (II) и марганца (II) из водных растворов // Записки Горного института. 2020. Т. 242. С. 209-217. DOI: 10.31897/PMI.2020.2.209
- Черемисина О.В., Черемисина Е.A., Пономарева М.А., Федоров А.Т. Сорбция координационных соединений редкоземельных элементов // Записки Горного института. 2020. Т. 244. С. 474-481. DOI: 10.31897/ PMI.2020.4.10
- Kudinova A.A., Poltoratckaya M.E., Gabdulkhakov R.R. et al. Parameters influence establishment of the petroleum coke genesis on the structure and properties of a highly porous carbon material obtained by activation of KOH // Journal of Porous Materials. 2022. Vol. 29. P. 1599-1616. DOI: 10.1007/s10934-022-01287-1
- Kanmani P., Rhim J.W. Nano and Nanocomposite Antimicrobial Materials for Food Packaging Applications, Progress in Nanomaterials for Food Packaging // Future Medicine. 2014. Р. 34-48. DOI: 10.4155/ebo.13.303
- Cheremisina O., Litvinova T., Sergeev V. et al. Application of the Organic Waste-Based Sorbent for the Purification of Aqueous Solutions // Water. 2021. Vol. 13. Iss. 21. № 3101. DOI: 10.3390/w13213101
- Povarov V.G., Kopylova T.N., Sinyakova M.A., Rudko V.A. Quantitative Determination of Trace Heavy Metals and Selected Rock-Forming Elements in Porous Carbon Materials by the X-ray Fluorescence Method // ACS omega. 2021. Vol. 6. Iss. 38. P. 24595-24601. DOI: 10.1021/acsomega.1c00691
- Chirkst D.E., Litvinova T.E., Cheremisina O.V. et al. Isotherm of Strontium Sorption on Clay // Russian Journal of Applied Chemistry. 2003. Vol. 76. Р. 727-730. DOI: 10.1023/A:1026053002075
- Bingjie Wang, Zhishan Bai, Haoran Jiang et al. Selective heavy metal removal and water purification by microfluidically-generated chitosan microspheres: Characteristics, modeling and application // Journal of Hazardous Materials. 2019. Vol. 364. P. 192-205. DOI: 10.1016/j.jhazmat.2018.10.024
- Alandis N.M., Mekhamer W., Aldayel O. et al. Adsorptive Applications of Montmorillonite Clay for the Removal of Ag(I) and Cu(II) from Aqueous Medium // Journal of Chemistry. 2019. № 7129014. DOI: 10.1155/2019/7129014
- Jianlong Wang, Xuan Guo. Adsorption kinetic models: Physical meanings, applications, and solving methods // Journal of Hazardous Materials. 2020. Vol. 390. № 122156. DOI: 10.1016/j.jhazmat.2020.122156
- Sen Gupta S., Bhattacharyya K.G. Adsorption of heavy metals on kaolinite and montmorillonite: a review // Physical Chemistry Chemical Physics. 2012. Vol. 14. Р. 6698-6723. DOI: 10.1039/c2cp40093f
- Uddin M.K. A review on the adsorption of heavy metals by clay minerals, with special focus on the past decade // Chemical Engineering Journal. 2017. Vol. 308. P. 438-462. DOI: 10.1016/j.cej.2016.09.029
- Tangaraj V., Janot J.-M., Jaber M. et al. Adsorption and photophysical properties of fluorescent dyes over montmorillonite and saponite modified by surfactant // Chemosphere. 2017. Vol. 184. Р. 1355-1361. DOI: 10.1016/j.chemosphere.2017.06.126
- Makisha N., Yunchina M. Methods and solutions for galvanic waste water treatment // International Science Conference SPbWOSCE-2016 «SMART City», 15-17 November 2016, St. Petersburg, Russia. MATEC Web of Conferences, 2017. Vol. 106. № 07016. DOI: 10.1051/matecconf/20171060701
- Cardinale A.M., Carbone C., Consani S. et al. Layered Double Hydroxides for Remediation of Industrial Wastewater from a Galvanic Plant // Crystals. 2020. Vol. 10. Iss. 6. № 443. DOI: 10.3390/cryst10060443
- Ciesielczyk F., Bartczak P., Klapiszewski Ł. et al. Treatment of model and galvanic waste solutions of copper(II) ions using a lignin/inorganic oxide hybrid as an effective sorbent // Journal of Hazardous Materials. 2017. Vol. 328. Р. 150-159. DOI: 10.1016/j.jhazmat.2017.01.009
