Подземное выщелачивание молибдена и урана с использованием перкарбонатных и хлоридно-гипохлоритных растворов
- 1 — д-р техн. наук директор Хабаровский Федеральный исследовательский центр ДВО РАН ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 2 — д-р техн. наук заместитель директора Институт горного дела ДВО РАН ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 3 — канд. техн. наук ведущий научный сотрудник Институт горного дела ДВО РАН ▪ Orcid
Аннотация
Подземное выщелачивание молибдена и урана становится все более распространенным процессом. Рассмотрены особенности вещественного состава руд, приводящие к снижению их фильтрационных характеристик. Исследованы процессы активационного выщелачивания рабочими растворами, прошедшими электрофотохимическую активацию до контактирования с рудной массой. Активационная подготовка выщелачивающих растворов способствует синтезу кластеризованных молекул воды с коллективизированными протонами и гидроксил-ионами, а также активных форм кислорода и водорода. Проведены экспериментальные исследования кюветного выщелачивания молибдена из лежалых хвостов Шахтаминского месторождения. После предокисления активным карбонатным раствором проведено модельное скважинное выщелачивание хлоридно-гипохлоритным раствором. Извлечение молибдена на смолу составило 85 % за 30 сут. В экспериментах по перколяционному выщелачиванию урана из руд месторождений Учкудук и Сугралы подтверждена потенциальная возможность существенного повышения извлечения урана электрофотоактивированными перкарбонатными растворами относительно водных растворов карбоната натрия и аммония. При выщелачивании карбонатными растворами без дополнительного окислителя извлечение урана из пробы руды месторождения Сугралы составляло 52 и 59 % (карбонатом натрия и карбонатом аммония). Использование пероксида водорода в качестве окислителя позволило достичь его 87-88 % извлечения в продуктивные растворы за 21 день без предварительного предокисления. Выполненные исследования подтверждают технологическую возможность извлечения урана и молибдена методами перколяционного выщелачивания в колоннах и скважинного выщелачивания.
Введение
При подземной разработке крупных рудных месторождений, в том числе молибдена и урана, в целиках, апофизах и маломощных рудных телах остаются неизвлеченными значительные запасы бедных и некондиционных руд [1]. В недовыпущенной разубоженной руде отработанных блоков, к которым сложно вернуться, остается значительные количество этих металлов [2].
Вследствие химических особенностей молибдена и урана, а также содержащих их минералов, в большинстве случаев возможно извлечение их из руд на месте залегания или из скоплений рудной массы в днище отработанных камер посредством выщелачивания [3-6]. Внедрение данных методов сдерживается сложностью оценки итоговой эффективности извлечения и добычи урана методами подземного выщелачивания [7].
Особенности извлечения урана с применением физико-химических геотехнологий
Уран с позиций растворимости его в сернокислотных и карбонатных средах имеет много общего с молибденом:
Главной гидрогеохимической особенностью урана в сравнении с молибденом, как и другими основными рудными элементами, является его радиоактивность, обуславливающая протекание ряда радиохимических процессов при взаимодействии продуктов распада с жидкой фазой и дефектообразование в твердой (минеральной) фазе системы технологический раствор – руда. В частности, гамма-кванты, излучаемые при распаде ядер атомов радона-226, являющихся дочерними продуктами распада урана-238, продуцируют в водной среде перекись водорода (эффект радиолиза) [8]. Перекись водорода и другие сильные окислители интенсифицируют процессы выщелачивания урана [9-11].
Кроме того, такая радиолитическая перекись водорода при поглощении гамма-квантов, диспропорционирует на два высокоактивных гидроксил-радикала, а при взаимодействии с двухвалентым железом распадается на гидроксил-ион и гидроксил-радикал. Гидроксил-радикал не только активно окисляет минералы, но образует в результате гидратации реакционно-активные водные кластеры, формирующие гидратные оболочки для комплексообразователей, тем самым повышая их растворяющую способность по отношению к урану. Вследствие таких радиохимических особенностей уран, находящийся в руде в виде простого окисла в составе таких минералов как уранинит (U,Th)O2 или настуран UO2, относительно просто выщелачивается из минерального вещества, первоначально в форме диоксоуран-иона UO2+2, который затем достаточно быстро связывается сульфатными или карбонатными анионами в соответствующие комплексы, в том числе полилигандные. Если в руде уран присутствует в составе широко распространенного силикатного минерала со слабосвязанной гидроксильной группой – коффинита U(SiO4)1-x·(OH)4x, скорость его растворения замедляется.
Наличие в руде уранофана – сложного кальциевого гидроксосиликата Ca(UO2)SiO3(OH)2·5H2О затрудняет выщелачивание урана в значительной степени. Поэтому для растворения таких минералов с высвобождением уранил-иона необходимо кроме радиолитической перекиси и гидроксил-радикала формировать в рабочих растворах пероксиды водорода, полученные посредством их электрохимической обработки.
При скважинном подземном выщелачивании урана из руд гидрогенных месторождений, кроме форм его нахождения, большое значение имеет содержание глинистых минералов, определяющее величину коэффициента фильтрации, а также содержание карбонатов кальция и магния [12]. Высокий карбонатный модуль гидрогенной урановой руды обуславливает не только повышенный расход серной кислоты, но и химическую кольматацию продуктивного пласта при переходе кальцита и доломита в гипс.
Применение поверхностно-активных веществ способно улучшить фильтрационные характеристики пласта [13, 14]. Одним из вариантов решений данной проблемы может быть использование хлоридсодержащих соединений для выщелачивания урана [15]. Поэтому извлекаемость в продуктивный раствор урана при использовании скважинного сернокислотного выщелачивания из руд гидрогенного генезиса, даже при локальном увеличении содержания карбонатов кальция и магния, может значительно снижаться. В связи с этим скважинное подземное выщелачивание урана, в зависимости от карбонатного модуля руд, при отработке отдельных «ядерных» областей роловых рудных тел гидрогенных месторождений или на отдельных пластовых участках их крыльев осуществляют сернокислотными или карбонатными растворами. Сернокислотные растворы для скважинного подземного выщелачивания урана используют при содержании CO2 в его рудах не более 2,5 %. Для выщелачивания руд с высоким содержанием кальцита и/или доломита, применяют растворы с карбонатной основой, включая карбонат и гидрокарбонат натрия, карбонат и гидрокарбонат аммония [16]. При содержании более 2,5 % СО2, рекомендуется переходить на карбонатное выщелачивание.
Современные технологии переработки молибденсодержащего сырья и концентратов
Для выщелачивания молибдена из руд со значительной долей повеллита и(или) ферримолибдита используют сернокислотные растворы [17], а для первичных руд, в которых молибден находится только в составе молибденита, в качестве выщелачивающих растворов может быть использован щелочной раствор гипохлорита натрия [18-22].
При гидрометаллургической переработке молибденовых концентратов используется содовое выщелачивание, которое отличается более высокой степенью извлечения молибдена из-за возможности разложения некоторых молибдатов [23, 24]. Новым поколением растворителей является флюидное СО2 выщелачивание [25]. Для минерального сырья, в составе которого содержится много нерастворимых молибдатов, содовая и аммиачная технологии выщелачивания малоэффективны. В этом случае для повышения извлечения молибдена может быть использован раствор соды с добавлением окислителя [26]. Так, при автоклавном выщелачивании извлечение молибдена из концентратов сложного состава составляет более 98 % [27].
Для извлечения молибдена из богатых руд и концентратов наиболее перспективным является способ выщелачивания с электрохимической обработкой приготовленной на его основе пульпы, жидкая фаза которой содержит хлорид и карбонат натрия с концентрациями от 10 г/л и более, которые при ее циркуляции через электролитическую ячейку преобразуются в прианодной зоне в систему высокоактивных окислителей серы и молибдена, что обеспечивает образование серной кислоты, снижение рН и переход его из кристаллической решетки молибденита в жидкую фазу пульпы [28].
Для извлечения молибдена из бедных и рядовых руд (когда измельчение не применимо по экономическим соображениям) электрохимический способ выщелачивания также может быть использован, но при условии отдельной, предварительной подготовки активных выщелачивающих сернокислотных или карбонатных растворов, т.е. до их взаимодействия с минеральной массой.
Теоретические аспекты активации рабочих растворов выщелачивания
Наиболее простым, но достаточно эффективным способом повышения активности технологических растворов, используемых для выщелачивания металлов из сульфидных минералов, является формирование в них гидратированных форм двухатомарного кислорода [29, 30]. Насыщение воды кислородом приводит к образованию метастабильных перекисных соединений, в которых водород периодически переходит в ионизированную форму:
Ионный комплекс (O·2-2·2H+)· при взаимодействии с продуктами индуцированной диссоциации окружающих его молекул воды становится центром их кластеризации. Анион кислорода индуцирует диссоциацию окружающих его молекул воды и взаимодействуя с образующимися при их диссоциации протонами, образует надмолекулярные структуры с уплотненными электронными оболочками. Протоны, в свою очередь, в составе этого комплекса при проникновении в электронные оболочки атомов кислорода ближайших молекул воды формируют ионы гидроксония. Такая активированная вода с локализованными в ее кластеризованных молекулах коллективизированными протонами и гидроксил-ионами, более интенсивно взаимодействует с растворяемыми в ней молекулами (ионами) реагентов. При использовании так называемых активных форм кислорода, под которыми в современной физической химии понимают озон и атомарную аллотропную форму, а также ион-радикал и радикальные соединения кислорода и водорода (перекись, диоксид водорода, гидроксил-радикал и др.), эффективность выщелачивания молибдена и сопутствующих ценных компонентов из руд, упорных для стандартных реагентных схем, существенно возрастает.
Поскольку озон, атомарный кислород и особенно гидроксил-радикал быстро рекомбинируют, то более эффективно формировать их гидратированные формы непосредственно в обрабатываемом растворе. Поэтому наиболее приемлемым методом генерации в растворе активных гидратированных форм кислорода является электролиз в комбинации с фотолизом. В этом случае диспергированные в обрабатываемом растворе молекулы электролитических газов (в первую очередь кислорода и водорода) и содержащиеся в газовых пузырьках пары воды трансформируются при поглощении квантов ультрафиолетового излучения в радикалы и ион-радикалы.
Окислительно-восстановительный потенциал гидроксил-радикала ОН• достигает значения 2,8 В [31], для атомарного кислорода составляет 2,42 В, для озона 2,07 В. Из этого следует, что не только неспаренный электрон атома кислорода, но и активный атом водорода или протон, образующийся при внутренней диссоциации гидроксил-радикала по ионному «механизму», не просто изменяет структурно-энергетические параметры электронных оболочек контактирующих с ним молекул воды, а проникает в них. В случае наличия в кластере воды двух активных центров ОН• такой комплекс будет содержать кластеризованные протоны 2Н+(2ОН−·nН2О). Растворы, а точнее газово-жидкие эмульсии, полученные в процессе электрохимической обработки исходных растворов, за счет наличия в них активных окисляющих и комплексообразующих компонентов начинают выщелачивать молибден в верхних слоях минеральных матриц молибденита с образованием молибденовой кислоты и окислением анионов серы, переходящей в элементную форму. Для последующего перевода серы в сульфатную форму целесообразно использовать надперекисные соединения надугольных кислот и надпероксидов щелочных металлов. Кластерные надуглекислотные соединения могут быть получены при электролизе растворов гидрокарбоната или карбоната натрия и фотохимической обработке прианодной зоны реактора. При электролизе и облучении ультрафиолетовым светом гидрокарбонатного (содового) раствора в прианодной зоне (в газовой фазе получаемой эмульсии) образуются следующие активные частицы:
При гидратации при контакте с пленочной водой, окружающей газовые пузырьки и с парами воды, находящимися внутри них, такие димерные кластерные соединения продуцируют надугольную кислоту:
С течением времени надугольная кислота диспропорционирует с образованием мононадугольной кислоты и углекислого газа
или пероксида водорода и углекислого газа
Образующаяся мононадугольная кислота Н2CO4 также с течением времени диспропорционирует с образованием пероксида водорода и угольной кислоты:
Важным свойством перкарбонатных соединений является их синергетическое (совместно с другими комплексообразователями) действие на металлы и окисляющее воздействие на серу и углистое вещество. Выщелачивание молибдена такими растворами, а точнее, водогазовыми эмульсиями, будет осуществляться по реакциям:
Образование дополнительных гидроксил-радикалов в минеральной среде, пропитанной активными растворами, осуществляется путем диспропорционирования перекиси водорода на гидроксил-ион и гидроксил-радикал при каталитическом воздействии Fe2+(реакция Фентона [32, 33]) и частично за счет поглощения фоновых квантов гамма-излучения, интенсивность которого для кислых пород и производных от них метасоматитов достаточно значительна.
Углеродистые включения в рудах при реакции с метастабильной мононадугольной кислотой окисляются до моноксида углерода:
Далее моноксид углерода доокисляется до СО2 перекисью водорода или гидроксил-радикалом:
Методика проведения экспериментальных исследований
Процесс электрофотохимического выщелачивания молибдена из минеральной массы пероксидно-карбонатными растворами предлагается осуществлять в два этапа.
Электрохимический синтез и активация рабочих растворов выщелачивания осуществляется в мембранном электролизере, в котором катодное и анодное пространство разделены. Параметры электролиза: напряжение на электродном блоке 15 В, рабочий ток 8 А. Фотохимическая активация рабочих растворов выполнялась УФ-облучением, длина волны 180-275 нм, лампа ДРТ-230, продолжительность 10 мин.
На первом этапе для продуцирования сульфат-анионов и двухвалентного железа осуществляется окисление сульфидных железосодержащих минералов католитом, представляющим собой полученный в катодной камере электролизера содово-щелочной раствор, содержащий карбонат, гидрокарбонат и гидроксид натрия и пероксид водорода. Причем перед вводом католита его насыщают кислородом, повышают концентрацию щелочи и подвергают УФ-облучению.
На втором этапе выщелачивание молибдена производится полученным при электрохимическом синтезе в анодной камере электролизера анолитом, представляющим собой облученную УФ-светом водно-газовую эмульсию, содержащую в диспергированных в жидкой фазе пузырьках углекислый газ, двухатомарный кислород, пары воды, переходящие при поглощении квантов УФ-излучения, соответственно, в атомарный кислород, озон, димерные карбоксильные катионы (C2O4)+, гидратированный гидроксил-радикал, а в жидкой фазе надугольные кислоты, пероксид водорода, гидроксил-радикал. Для повышения выхода активных форм кислорода в анодную камеру через 30-60 мин после начала электролиза добавляют серную кислоту до достижения pH = 3-3,5 и облучают прианодную зону источником УФ-излучения.
При выщелачивании молибдена отдельно подготовленными активированными растворами отпадает необходимость циркуляции пульпы через электрохимическую ячейку и возрастает доля активных, выщелачивающих молибден компонентов, синтезируемых в результате совместного использования электрохимических и фотохимических процессов.
Гидрометаллургическое тестирование урансодержащих руд выполнялось электрофотоактивированными растворами карбоната натрия и карбоната аммония. Исследовался метод перколяционного выщелачивания. В качестве окислителя применялись перманганат калия и нитрит натрия.
Анализ исходных проб, продуктивных растворов и кеков выщелачивания выполнялся методом атомно-адсорбционной спектроскопии с пламенной атомизацией (Shimadzu AA-6000).
Материалы для настоящего исследования – хвосты обогащения Шахтаминского месторождения с содержанием молибдена 0,01-0,03 %. В верхнем слое хвостохранилища минералы носители представлены ферримолибдитом и в повелитом. В нижних слоях молибден представлен молибденитом. В месторождении Учкудук основными рудными минералами являются уранинит и настуран, присутствует коффинит, содержание урана 0,17 %. Руда месторождения Сугралы содержит 0,4 % урана, урановая минерализация представлена коффинитом и уранофаном. Масса тестируемых представительных проб составляет 23 кг для каждого эксперимента.
Результаты и обсуждение. Извлечение молибдена из бедного техногенного сырья
Экспериментальные исследования процессов выщелачивания по пероксидно-карбонатной схеме проводили на смешанных пробах лежалых хвостов обогащения руд Шахтаминского месторождения, отобранных из поверхностного слоя с выраженными гипергенными изменениями и визуально малоизмененной минеральной массы. Содержание молибдена в хвостах обогащения Шахтаминского месторождения варьируется в пределах 0,01-0,03 %. В верхнем слое хвостохранилища молибденит практически полностью отсутствует, трансформировавшись в ферримолибдит и, в меньшей степени, в повелит. Начиная с глубины 1,5-2 м хвостохранилища, молибден преимущественно находится в составе переизмельченного в процессе рудоподготовки молибденита. Как показали входные анализы проб, отобранных из шурфов, попутно извлекаемыми компонентами шахтаминских хвостов могут быть золото, медь и вольфрам.
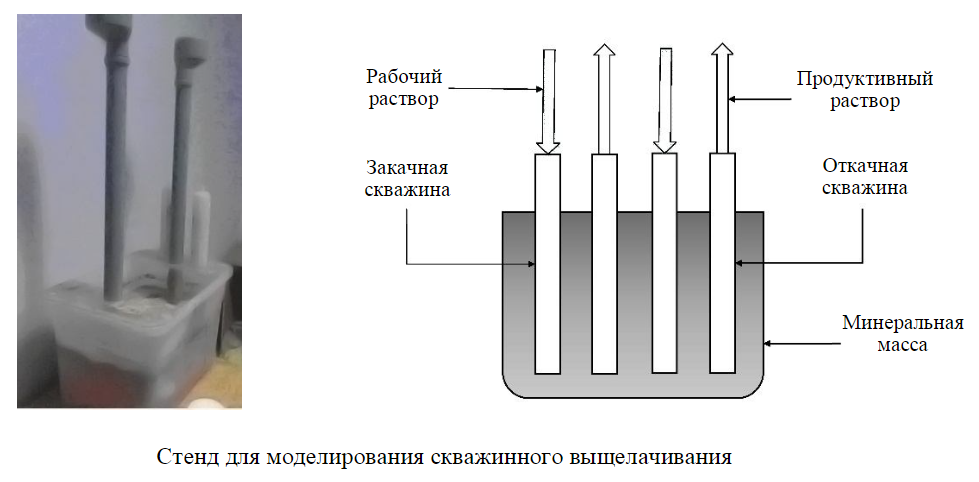
Стенд для моделирования скважинного выщелачивания
Для проведения эксперимента по кюветному выщелачиванию молибдена была выделена представительная проба массой 23 кг (объем кюветы составил 20 л). Рабочий раствор (1,0 % NaHCO3) был активирован путем электролиза и барботажа воздухом для насыщения кислородом в диафрагменном электрохимическом реакторе в течение 1 ч. После этого в анодную камеру добавляли серную кислоту до достижения pH = 3 и образования в анолите для повышения выхода активных гидратированных форм кислорода, облучали прианодную зону УФ-светом в диапазоне 180-275 нм лампами ДРТ-230 в течение 10 мин. Полученную активную водно-газовую смесь использовали для приготовления на основе хвостов вязкой суспензии (густой пульпы) обогащения Ж:Т = 1:3, выдерживали ее в кювете в течение трех суток, после чего добавляли в пульпу католит, дополнительно насыщенный кислородом и прошедшим УФ-облучение. Католит вводили в пульпу до достижения pH = 8,5 и Ж:Т = 1:1,2, барботировали ее 2 ч, после чего в пульпу вводили ионообменную смолу, селективную по молибдену, и продолжали барботаж еще в течение 13 ч. После этого насыщенную смолу отделяли на сите. Извлечение молибдена на смолу составило 75 %, что для переработки хвостов является достаточно высоким показателем.
Использование агитационного выщелачивания молибдена в кювете или в чанах эффективно для переработки минеральной массы верхней части хвостохранилища (глубиной до 4-5 м), для более глубоких слоев целесообразно использовать скважинное выщелачивание.
С целью моделирования подземного скважинного выщелачивания молибдена хвосты обогащения руд Шахтаминского месторождения в количестве 23 кг помещали в пластиковую кювету, оборудованную двумя перфорированными в нижней части пластиковыми трубами (см. рисунок).
Через одну из труб, моделирующую закачную скважину, подавали анолит, полученный при электрохимической обработке 1 %-ного содового раствора. Раствор готовили путем электролиза и барботажа воздухом для насыщения кислородом в диафрагменном электрохимическом реакторе в течение 1 ч, после этого в анодную камеру добавляли серную кислоту титрованием до достижения pH = 5 и активировали анолит облучением прианодной зоны УФ-светом в диапазоне 180-300 нм лампами ДРТ-230 в течение 10 мин. Через 4 ч через эту же трубку подавали католит, дополнительно насыщенный кислородом и также прошедшим УФ-облучение. После выдержки в течение трех суток через трубку, моделирующую закачную скважину, подавали хлоридно-гипохлоритный раствор, полученный путем электрофотохимической обработки по запатентованной технологии [34]. После появления продуктивного раствора во второй трубке, моделирующей откачную скважину, производили его забор и анализ на растворенные элементы: молибден, золото и железо. Общий расход рабочих растворов на выщелачивание составил Т:Ж = 1:1,7.
Извлечение молибдена за 30 суток составило 82 %. Расчет извлечения производился согласно формуле
где Сисх – содержание ценного компонента в исходной руде, %; Скек – концентрация ценного компонента в кеках выщелачивания, %.
Также в продуктивном растворе было выявлено золото в промышленной (более 0,3 мг/л) концентрации. Таким образом, как кюветное, так и скважинное выщелачивание молибдена перкарбонатными и хлоридно-гипохлоритными растворами, содержащими активные формы кислорода, обеспечивает приемлемый уровень его извлечения.
Результаты извлечения урана методом перколяционного активационного выщелачивания
В многочисленных экспериментах по перколяционному выщелачиванию урана в колонках, проведенных в лабораториях Навоийского горно-металлургического комбината, из руд гидрогенных осадочных месторождений Учкудук и Сугралы подтверждена потенциальная возможность извлечения урана как карбонатом натрия, так и карбонатом аммония. Содержание карбонатов и глинистых минералов в этих рудных пробах примерно одинаково. В рудах месторождении Учкудук превалирует легкорастворимые уранинит и настуран с подчиненно входящим в рудный парагенезис коффинитом при общем содержании урана 0,17 %. В пробе существенно более богатой руды месторождения Сугралы с содержанием урана 0,4 % коффинит и уранофан присутствуют в существенно большем количестве. Поэтому при выщелачивании карбонатными растворами без дополнительного окислителя извлечение урана из пробы руды месторождения Сугралы составляло 52 и 59 % (соответственно карбонатом натрия и карбонатом аммония) при пиковых содержаниях урана в продуктивном растворе 1,5 г/л. Извлечение урана из пробы руды месторождения Учкудук составило 76 и 81 % (карбонатом натрия и карбонатом аммония). Использование в качестве окислителя перманганата калия с расходом около 2 г/л обеспечило достижение высоких уровней извлечения урана из обеих проб (соответственно 95 и 96 % с расчетом по твердой фазе). Несмотря на полученный результат, использование такого дорогостоящего окислителя как перманганат калия при существующих ценах на уран оказалось экономически не оправдано. Использование другого эффективного окислителя – нитрита натрия при наличии в продуктивном пласте Сугралинского месторождения сульфидных минералов, в первую очередь пирита, может привести к выделению сероводорода и газовой кольматации продуктивного пласта.
Замена перманганата калия на менее дорогие окислители, в частности пиролюзит или перекись водорода, несущественно снизят эксплуатационные затраты. Применение химически чистого кислорода, подаваемого в продуктивный пласт через скважины, как показали проведенные испытания на Сугралах фирмой «Кожема» (Франция), существенно улучшает кинетику выщелачивания урана и снижает расход серной кислоты, но требует организации бесперебойной доставки кислородного оборудования или монтаж крупной кислородной станции с большим потреблением электроэнергии. Поэтому объективно целесообразно использовать для скважинного подземного выщелачивания урана эффективный окислитель, производимый непосредственно на производственном участке, но при этом использовать некапиталоемкое и энергоемкое оборудование. Нами был рассмотрен и экспериментально протестирован в центральной физико-химической лаборатории Северного рудоуправления Навоийского ГМК вариант электрофотохимического выщелачивания урана из руд месторождения Сугралы пероксидно-карбонатными растворами, подготовка которых осуществляется в проточных электрохимических реакторах. В этом случае, как и для выщелачивания молибдена, возможно использование относительно дешевого исходного реагента – гидрокарбоната натрия, при гидратации молекул которого в обрабатываемом растворе формируется метастабильная мононадугольная кислота, выполняющая функцию как окислителя, так и комплексообразователя для урана. Пероксидно-карбонатные растворы могут быть получены на месте производства добычных работ путем электрохимической обработки технологического раствора.
При этом перекись водорода выполняет роль окислителя, а угольная кислота при взаимодействии с оксидом урана – комплексообразователя, формируя комплексное соединение [UO2(CO3)3]. На стадии электроактивационной обработки исходного гидрокарбонатного раствора содержание растворенного кислорода после электрохимической обработки пластовой воды Сугралинского месторождения увеличилось с 5 до 9 мг/л, что при последующей фотохимической обработке раствора позволяет генерировать в ней и перекись водорода. Таким образом, при использовании перкарбонатных и пероксидных комплексов осуществляется достаточно полное выщелачивание урана и из такого сложнорастворимого минерала как уранофан.
Эксперимент по перколяционному выщелачиванию урана пероксидно-карбонатными растворами, полученными путем электрофотохимической обработки исходного гидрокарбонатного раствора из двух параллельных навесок проб руды месторождения Сугралы со значительной долей в ней коффинита и уранофана, позволил достичь 87-88 %-ного извлечения в продуктивные растворы за три недели. При этом предварительное закисление навесок не проводилось. Расчеты по данным анализов твердой фазы показали практически такой же результат (84,5 % по первой навеске, 87,3 % по второй). Суммарное Ж:Т составило 1,7:1. Подачу перкарбонатных растворов прекратили при падении содержания урана в продуктивном растворе до 50 мг/л. Таким образом, перкарбонатные растворы потенциально могут быть использованы при разработке гидрогенных урановых руд, залегающих в осадочных породах как скважинным способом, так и другими методами физико-химической геотехнологии.
Выводы
Проведены лабораторные эксперименты и опытно-промышленные испытания активационного выщелачивания молибдена и урана из руд осадочного и гидротермального генезиса, техногенно-трансформированного минерального сырья перкарбонатными и перкарбонатно-хлоридными растворами, подготовленными в электрофотохимических реакторах.
По лежалым хвостам Шахтаминского месторождения достигнуто 75 % извлечения на смолу в кюветном варианте (электрофотоактивированный карбонатный рабочий раствор, кондиционированный серной кислотой) и 82 % извлечения молибдена при моделировании подземного скважинного выщелачивания последовательной комбинацией активного карбонатного и хлоридно-гипохлоритных рабочих растворов.
Для руд месторождения Сургалы тестовые агитационные испытания показали 52-59 % извлечения урана, введение окислителя (KMnO4) позволило увеличить данный показатель до 95 %; моделирование подземного выщелачивания с применением активного карбонатного раствора и в качестве окислителя пероксида водорода позволило достигнуть 87-88 % извлечения. На рудах месторождения Учкудук извлечение урана по соответствующим реагентным схемам в агитационном варианте составило 76 %.
Предлагаемый способ подземной разработки комплексных месторождений урановых и молибденовых руд с активационным выщелачиванием повысит технологический уровень освоения, улучшит эксплуатационные показатели по обслуживанию процесса, повысит рентабельность производства и экологическую безопасность.
Литература
- Балихин А.В. Минерально-сырьевая база урана: современное состояние и перспективы развития. Обзор // Комплексное использование минерального сырья. 2019. № 1. С.36-50. DOI: 10.31643/2019/6445.05
- Xie H., Zhao J.W., ZhouW. et al. Secondary utilizations and perspectives of mined underground space // Tunnelling and Underground Space Technology. 2020. Vol. 96. № 103129. DOI: 10.1016/j.tust.2019.103129
- Orrego P., Hernandez J., Reyes A. Uranium and molybdenum recovery from copper leaching solutions using, ion exchange // 2019. Vol. 184. P. 116-122. DOI: 10.1016/j.hydromet.2018.12.02
- Oryngozhin E.S., Fedorov E.V., Alisheva Z.N., Mitishova N.A. In-situ leaching technology for uranium deposits // Eurasian Mining. №2. P. 31-35. DOI: 10.17580/em.2021.02.07
- Yipeng Zhou, Guangrong Li, Lingling Xu et al. Uranium recovery from sandstone-type uranium deposit by acid in-situ leaching – an example from the Kujieertai // 2020. Vol. 191. № 105209. DOI: 10.1016/j.hydromet.2019.105209
- Толстов Д.Е., Толстов Е.А. Физико-химические геотехнологии освоения месторожений урана и золота в Кызылкумском регионе. М.: Геоинформцентр, 2002. 277 с.
- Langanay J., Romary T., Freulon et al. Uncertainty quantification for uranium production in mining exploitation by In Situ Recovery // Computational Geosciences. 2021. Vol. 25. № 3. P. 831-850. DOI: 10.1007/s10596-020-10018-x
- Brown S.H. Radiological aspects of in situ uranium recovery // ICEM 2007: Proceedings of the 11th International Conference on Environmental Remediation and Radioactive Waste Management, 2-6 September 2007, Bruges, Belgium. ASME, 2009. 1465-1477.
- PanB., Liao W.S., Wai C.M. et al. Carbonate-H2O2 leaching for sequestering uranium from seawater // Dalton Transactions. 2014. Vol. 43. Iss. 28. P. 10713-10718. DOI: 10.1039/c3dt53404a
- Lasheen T.A., El-Ahmady M.E., Hassib H.B., Helal A.S. Oxidative leaching kinetics of molybdenum-uranium ore in H2SO4 using H2O2 as an oxidizing agent // Frontiers of Chemical Science and Engineering. Vol.7. Iss.1. P. 95-102. DOI: 10.1007/s11705-013-1317-6
- Umanskii A.B., Klyushnikov A.M. Development of NaNO2-O2 system as an oxidant at uranium leaching processes // Journal of Radioanalytical and Nuclear Chemistry. 2012. Vol. 293. P. 193-198. DOI: 10.1007/s10967-012-1658-5
- Qi-Cheng Li, Ju Zhou. Research on character of solute transport in in-situ leaching of uranium in sandstone uranium deposit // International Conference on Design, Manufacturing and Mechatronics (ICDMM2015), 17-18 April 2015, Wuhan, China. World Scientific, 2016. P. 1086-1094.
- Rakishev B., Mataev M., Kenzhetaev et al. Research into leaching of uranium from core samples in tubes using surfactants // Mining of mineral deposits. 2020. Vol. 14. Iss. 4. P. 97-104. DOI: 10.33271/mining14.04.097
- Chunguang Li, Kaixuan Tan, Zhenzhong Liu et al. Prediction model of uranium concentration for in-situ leaching pregnant solution based on uranium chemical fractions of ores // Journal of radioanalytical and nuclear chemistry. Vol. 318. № 2. P. 1379-1387. DOI: 10.1007/s10967-018-6190-9
- Titova, Skripchenko S., Smirnov A., Rychkov V. Processing of Chloride-Containing Productive Solutions after Uranium in-situ Leaching by Ion Exchange Method // Indonesian Journal of Chemistry. 2019. Vol. 19. № 1. P. 231-238. DOI: 10.22146/ijc.34460
- Wei Guang Wang, Kai Xuan Tan, Er Ju Xie et al. Supercritical CO2 fluid leaching of uranium from sandstone type ores // Advances in Chemical, Material and Metallurgical Engineering. Vol.634-638. P.3517-3521. DOI: 10.4028/www.scientific.net/AMR.634-638.3517
- Валиев Х.Х., Бугубаева А.У., Амандыкова А.Б., Булаев А.Г. Выщелачивание урана и молибдена из руды месторождения «Восток» // Известия Тульского государственного университета. Науки о Земле. 2019. №. 4. С. 92-99.
- Fu J.G., Zhong H., Bu X.M., Wang F.L. Electro-oxidation process for molybdenum concentrates // Journal of Central South University of Technology. Vol. 12. № 2. P. 134-139 (in Chinese).
- Weiping Liu, Hui Xu, Xiyun Yang, Xichang Shi. Extraction of molybdenum from low-grade Ni-Mo ore in sodium hypochlorite solution under mechanical activation // Minerals Engineering. Vol. 24. Iss. 14. P. 1580-1585. DOI: 10.1016/j.mineng.2011.08.010
- Warren I.H., Mounsey D.M. Factors influencing the selective leaching of molybdenum with sodium-hypochlorite from copper molybdenum sulfide minerals // 1983. Vol. 10. Iss. 3. P. 343-357. DOI: 10.1016/0304-386X(83)90064-6
- Warren I.H., Mounsey D.M. Fundamentals of the selective leaching with sodium-hypochlorite of molybdenum from copper-molybdenum sulfide concentrations // Journal of Metals. Vol. 31. Iss. 12. P. 84-85.
- Hesami R., Ahmadi A., Hosseini M.R., Torabi M. Effect of mechanical activation on the hypochlorite leaching of Sarcheshmeh molybdenite concentrate // Separation Science and Technology. Vol.57. Iss.12. P. 1966-1977. DOI: 10.1080/01496395.2021.2018712
- Медведев А.С., Малочкина Н.В., Балгаева Ф.Ш. Способы переработки отработанных катализаторов // Цветные металлы. 2007. № 6. С. 78-82.
- Shijie Zhao, Zhiqin Liao, Yu Xie, Xisong Li et al. Extraction of Molybdenum from Spent HDS Catalyst by Pressure Alkaline Leaching // Journal of Sustainable Metallurgy. Vol. 7. Iss. 3. P. 773-782. DOI: 10.1007/s40831-021-00420-9
- Yun Yang, Wenjie Qiu, Zhengbang Liu et al. Quantifying the impact of mineralogical heterogeneity on reactive transport modeling of CO2 + O2 in-situ leaching of uranium // Acta Geochimica. 2022. Vol. 41. P. 50-63. DOI: 1007/s11631-021-00502-1
- Sung-Ho Joo, Young-Uk Kim, Jin-Gu Kang et al. Recovery of Molybdenum and Rhenium Using Selective Precipitation Method from Molybdenite Roasting Dust in Alkali Leaching Solution // Materials Transactions. Vol. 53. № 11. P. 2038-2042. DOI: 10.2320/matertrans.M2012209
- Kaixi Jiang, Yufang Wang, Xiaoping Zou et al. Extraction of Molybdenum from Molybdenite Concentrates with Hydrometallurgical Processing // 2012. Vol. 64. Iss. 11. P. 1285-1289. DOI: 10.1007/s11837-012-0457-3
- Секисов А.Г., Лавров А.Ю., Рассказова А.В. Фотохимические и электрохимические процессы в геотехнологии. Чита: Забайкальский государственный университет, 2019. 306 с.
- Patent № 4.752.412 USA. Method for recovery of precious metals using Ozone / Van Antverp, Ph. Lincoln. 20.07.1987.
- Sekisov A., Rasskazova A. Assessment of the possibility of hydrometallurgical processing of low-grade ores in the oxidation zone of the malmyzh Cu-Au porphyry deposit // Minerals. 2021. Vol. 11. Iss.1. № 69. DOI: 10.3390/min11010069
- Liu Miao, Diao Wei-Li, Wu Di et al. Forming law of hydroxyl radical during electrolysis process // Chemical Journal of Chinese Universities. Vol. 26. Iss. 12. P. 2223-2226.
- Jia Zhishen, Wu Jianmin, Tang Mengcheng. Colorimetric determination of hydroxyl radicals from Fenton reaction // Progress in Biochemistry and Biophysics. Vol. 23. № 2. P. 184-186.
- Ren FL., Wu N., Si SH. Fluorimetry assay of hydroxyl radical by cobalt (II)-hydrogen peroxide-salicylfluorone system // Chinese Journal of Analytical Chemistry. Vol. 29. № 1. P. 60-62.
- Патент № 2689487 РФ. Способ извлечения благородных металлов из руд и концентратов / А.Г.Секисов, Н.П.Хрунина, К.В.Прохоров, А.В.Рассказова. Опубл. 05.2019.
