ą×čüąŠą▒ąĄąĮąĮąŠčüčéąĖ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąŠą╣ ą┐čĆąŠą┤čāą║čåąĖąĖ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ čéą▓ąĄčĆą┤ąŠč鹥ą╗čīąĮąŠą│ąŠ ą│ąĖą┤čĆąĖą┤ąĮąŠą│ąŠ čüąĖąĮč鹥ąĘą░
- 1 ŌĆö ą┤-čĆ č鹥čģąĮ. ąĮą░čāą║ ą┐čĆąŠč乥čüčüąŠčĆ ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│čüą║ąĖą╣ ą│ąŠčĆąĮčŗą╣ čāąĮąĖą▓ąĄčĆčüąĖč鹥čé Ō¢¬ Orcid
- 2 ŌĆö ą░čüą┐ąĖčĆą░ąĮčé ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│čüą║ąĖą╣ ą│ąŠčĆąĮčŗą╣ čāąĮąĖą▓ąĄčĆčüąĖč鹥čé Ō¢¬ Orcid
ąÉąĮąĮąŠčéą░čåąĖčÅ
ą¤čĆąŠą▓ąĄą┤ąĄąĮąŠ ąĮą░čāčćąĮąŠąĄ ąŠą▒ąŠčüąĮąŠą▓ą░ąĮąĖąĄ ą▓čŗą▒ąŠčĆą░ ąĖ ą┐ąŠą┤ą│ąŠč鹊ą▓ą║ąĖ čéą▓ąĄčĆą┤ąŠčäą░ąĘąĮąŠą│ąŠ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ, ą┐čĆąŠą░ąĮą░ą╗ąĖąĘąĖčĆąŠą▓ą░ąĮčŗ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖąĄ ąĖ ą║ąĖąĮąĄčéąĖč湥čüą║ąĖąĄ ą░čüą┐ąĄą║čéčŗ čéą▓ąĄčĆą┤ąŠč鹥ą╗čīąĮąŠą│ąŠ ą│ąĖą┤čĆąĖą┤ąĮąŠą│ąŠ čüąĖąĮč鹥ąĘą░ (ąóąōąĪ) ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ąĮą░ ą┐čĆąĖą╝ąĄčĆąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ. ą×ą┐ąĖčüą░ąĮčŗ čĆąĄąČąĖą╝čŗ ą┐čĆąĄą┤ą▓ą░čĆąĖč鹥ą╗čīąĮąŠą│ąŠ ąŠą▒ąĄąĘą▓ąŠąČąĖą▓ą░ąĮąĖčÅ ąĖ ą╝ąĄč鹊ą┤ąĖą║ąĖ ą║ąŠąĮčéčĆąŠą╗čÅ ą┐ąŠą╗ąĮąŠą│ąŠ čāą┤ą░ą╗ąĄąĮąĖčÅ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čéąĮąŠą╣ ą▓ąŠą┤čŗ ąĖąĘ čģą╗ąŠčĆąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ąĖ ąŠą╗ąĄąĮąĄą│ąŠčĆčüą║ąŠą│ąŠ čüčāą┐ąĄčĆą║ąŠąĮčåąĄąĮčéčĆą░čéą░ ŌĆō ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ąŠą║čüąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ. ąŻčüčéą░ąĮąŠą▓ą╗ąĄąĮčŗ čāčüą╗ąŠą▓ąĖčÅ, ą▓ą║ą╗čÄčćą░čÅ čĆą░ąĘą╝ąĄčĆčŗ čćą░čüčéąĖčå ąĖčüčģąŠą┤ąĮąŠą│ąŠ čéą▓ąĄčĆą┤ąŠą│ąŠ čģą╗ąŠčĆąĖą┤ą░, ą┐čĆąĖ ą║ąŠč鹊čĆčŗčģ ą╝ąĖąĮąĖą╝ąĖąĘąĖčĆčāčÄčéčüčÅ ą┤ąĖčäčäčāąĘąĖąŠąĮąĮčŗąĄ ąŠčüą╗ąŠąČąĮąĄąĮąĖčÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą▓ ą┐ą░čĆą░čģ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░. ą¤čĆąŠą▓ąĄą┤ąĄąĮčŗ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖąĄ ąŠčåąĄąĮą║ąĖ ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą▓ čĆą░ą▓ąĮąŠą▓ąĄčüąĮčŗčģ čāčüą╗ąŠą▓ąĖčÅčģ čģą╗ąŠčĆąĖą┤ąŠą▓ ąĖ ąŠą║čüąĖą┤ąŠą▓ ąĮąĖą║ąĄą╗čÅ, ąČąĄą╗ąĄąĘą░ ąĖ ą╝ąĄą┤ąĖ ą░ą╝ą╝ąĖą░ą║ąŠą╝ ąĖ ą╝ąĄčéą░ąĮąŠą╝ ą┐čĆąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ 400-1000 ąÜ. ą¤ąŠą║ą░ąĘą░ąĮąŠ, čćč鹊 čĆą░čüčüčćąĖčéą░ąĮąĮčŗąĄ ą╝ąĄč鹊ą┤ąŠą╝ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ ą▒čĆčāčéč鹊-čĆąĄą░ą║čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčé 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗą╝ ą┤ą░ąĮąĮčŗą╝. ąÆ ąŠčéą╗ąĖčćąĖąĄ ąŠčé ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ą╝ąĄą┤ąĖ ą┤ą╗čÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ąĮąĄčģą░čĆą░ą║č鹥čĆąĮąŠ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą╝ąŠąĮąŠčģą╗ąŠčĆąĖą┤ą░ ą╝ąĄčéą░ą╗ą╗ą░ ąĮą░ ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮąŠą╣ čüčéą░ą┤ąĖąĖ, čćč鹊 čüą▓čÅąĘčŗą▓ą░ąĄčéčüčÅ čü ą▒ąŠą╗čīčłąĄą╣ č鹥čĆą╝ąŠčāčüč鹊ą╣čćąĖą▓ąŠčüčéčīčÄ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ. ąĀą░čüčüą╝ąŠčéčĆąĄąĮčŗ ąŠčüąĮąŠą▓ąĮčŗąĄ ą║ąĖąĮąĄčéąĖč湥čüą║ąĖąĄ ąĘą░ą║ąŠąĮąŠą╝ąĄčĆąĮąŠčüčéąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĮąĖą║ąĄą╗čÅ, ą╝ąĄą┤ąĖ ąĖ ąČąĄą╗ąĄąĘą░ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ą▓ čüčĆąĄą┤ąĄ ą░ą╝ą╝ąĖą░ą║ą░, ą╝ąŠąĮąŠčüąĖą╗ą░ąĮą░ ąĖ ą╝ąĄčéą░ąĮą░, ą░ čéą░ą║ąČąĄ ą┐ąŠčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą┐ą░čĆą░ą╝ąĖ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░ ąĖ ą╝ąĄčéą░ąĮąŠą╝. ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÅ čŹą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗčģ ą┤ą░ąĮąĮčŗčģ č鹊ą┐ąŠčģąĖą╝ąĖč湥čüą║ąĖą╝ąĖ čāčĆą░ą▓ąĮąĄąĮąĖčÅą╝ąĖ ą▓ ą╗ąĖąĮąĄą╣ąĮąŠą╣ č乊čĆą╝ąĄ ą┐ąŠą║ą░ąĘą░ą╗ą░, čćč鹊 ą┤ą╗čÅ čüč鹥ą┐ąĄąĮąĄą╣ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ a ą┤ąŠ 0,7-0,8 čŹčéąĖ ą┤ą░ąĮąĮčŗąĄ čāą┤ąŠą▓ą╗ąĄčéą▓ąŠčĆąĖč鹥ą╗čīąĮąŠ ąŠą┐ąĖčüčŗą▓ą░čÄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ ąĀąŠą│ąĖąĮčüą║ąŠą│ąŠ ŌĆō ą©čāą╗čīčå. ą¤čĆąĖ a > 0,8 ą╗čāčćčłąĄ čĆą░ą▒ąŠčéą░ąĄčé ą╝ąŠą┤ąĄą╗čī ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗, ą║ąŠč鹊čĆą░čÅ ą┐ąŠą┤čéą▓ąĄčƹȹ┤ą░ąĄčé ą╗ąŠą║ą░ą╗ąĖąĘą░čåąĖčÄ čéą▓ąĄčĆą┤ąŠč鹥ą╗čīąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĮą░ ą│čĆą░ąĮąĖčåąĄ čĆą░ąĘą┤ąĄą╗ą░, ą┐čĆąŠą┤ą▓ąĖą│ą░ąĄčéčüčÅ ą▓ą│ą╗čāą▒čī ą║čĆąĖčüčéą░ą╗ą╗ą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ čüą╗ąŠčÅ čüąŠą╝ą║ąĮčāą▓čłąĖčģčüčÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ąĘą░čĆąŠą┤čŗčłąĄą╣. ą×ą▒čüčāąČą┤ąĄąĮčŗ ą▓ą░ąČąĮąŠčüčéčī ąĖ ą┐ąĄčĆčüą┐ąĄą║čéąĖą▓čŗ ą┐ąŠą╗čāč湥ąĮąĮčŗčģ čĆąĄąĘčāą╗čīčéą░č鹊ą▓ ą┤ą╗čÅ čĆą░ąĘą▓ąĖčéąĖčÅ č鹥ąŠčĆąĖąĖ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓, ą│ą╗čāą▒ąŠą║ąŠą╣ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąŠą╣ ą┐ąĄčĆąĄčĆą░ą▒ąŠčéą║ąĖ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ąČąĄą╗ąĄąĘąŠąŠą║čüąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ, ą┐ąŠą╗čāč湥ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąŠą┐čĆąŠą┤čāą║čåąĖąĖ ąĖ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ ąĮąŠą▓ąŠą│ąŠ ą┐ąŠą║ąŠą╗ąĄąĮąĖčÅ, ą▓ą║ą╗čÄčćą░čÅ čüčāą┐ąĄčĆą│ąĖą┤čĆąŠč乊ą▒ąĮčŗąĄ. ą×čéą╝ąĄč湥ąĮą░ ą░ą║čéčāą░ą╗čīąĮąŠčüčéčī ą┐čĆąŠą▓ąĄą┤ąĄąĮąĮąŠą│ąŠ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖčÅ čü č鹊čćą║ąĖ ąĘčĆąĄąĮąĖčÅ ą┐čĆąĖą╝ąĄąĮąĄąĮąĖčÅ ą╝ąĄč鹊ą┤ą░ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░ ą┤ą╗čÅ ąĖąĘčāč湥ąĮąĖčÅ čüą╗ąŠąČąĮčŗčģ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮčŗčģ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓.
ąÆą▓ąĄą┤ąĄąĮąĖąĄ
ąĀą░ąĘčĆą░ą▒ąŠčéą║ą░ 菹ĮąĄčĆą│ąŠ- ąĖ čĆąĄčüčāčĆčüąŠčüą▒ąĄčĆąĄą│ą░čÄčēąĖčģ č鹥čģąĮąŠą╗ąŠą│ąĖą╣ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ą▓čŗčüąŠą║ąŠą│ąŠ ą║ą░č湥čüčéą▓ą░ čÅą▓ą╗čÅąĄčéčüčÅ ąŠą┤ąĮąĖą╝ ąĖąĘ ą┐ąĄčĆčüą┐ąĄą║čéąĖą▓ąĮčŗčģ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖą╣ čüąŠą▓čĆąĄą╝ąĄąĮąĮąŠą╣ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖąĖ [1, 2]. ą¤čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ą░, ą▓ ą║ąŠč鹊čĆčŗčģ ą┤ą╗čÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ą░ ąĖąĘ čĆčāą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ąĖčüą┐ąŠą╗čīąĘčāčÄčé ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗąĄ čĆąĄą░ą│ąĄąĮčéčŗ, ą║ą░ą║ ą┐čĆą░ą▓ąĖą╗ąŠ, ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčé čüąŠą▒ąŠą╣ ą▒ąŠą╗ąĄąĄ 菹║ąŠą╗ąŠą│ąĖč湥čüą║ąĖ ą┐čĆąĖąĄą╝ą╗ąĄą╝čŗąĄ ą┐čĆąŠčåąĄčüčüčŗ, č湥ą╝ č鹥, ą▓ ą║ąŠč鹊čĆčŗčģ ą┐čĆąĖą╝ąĄąĮčÅčÄčé čéą▓ąĄčĆą┤čŗąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗ąĖ (čāą│ąŠą╗čī, čłčāąĮą│ąĖčé ąĖ ą┤čĆ.) [3, 4]. ą¤čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠ ąĖčüą┐ąŠą╗čīąĘčāąĄą╝čŗą╣ ą╝ąĄč鹊ą┤ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąČąĄą╗ąĄąĘąŠąŠą║čüąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ą║ąŠąĮą▓ąĄčĆčéąĖčĆąŠą▓ą░ąĮąĮčŗą╝ ą┐čĆąĖčĆąŠą┤ąĮčŗą╝ ą│ą░ąĘąŠą╝ (ą▓čŗčłąĄ 700 ┬░ąĪ) čÅą▓ą╗čÅąĄčéčüčÅ ą┤ąŠčüčéą░č鹊čćąĮąŠ ą▓ąĘčĆčŗą▓ąŠ- ąĖ ą┐ąŠąČą░čĆąŠąĮąĄą▒ąĄąĘąŠą┐ą░čüąĮčŗą╝ ą┐čĆąŠčåąĄčüčüąŠą╝, čüą┐ąŠčüąŠą▒ąĮčŗą╝ ą▓čŗąĘą▓ą░čéčī ąĮąĄąČąĄą╗ą░č鹥ą╗čīąĮčāčÄ ą│ą░ąĘąŠą▓čāčÄ ą║ąŠčĆčĆąŠąĘąĖčÄ ą╝ąĄčéą░ą╗ą╗ą░ [5]. ąöą╗čÅ čüąĮąĖąČąĄąĮąĖčÅ čŹąĮąĄčĆą│ąŠąĄą╝ą║ąŠčüčéąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ą░, 菹║ąŠąĮąŠą╝ąĖąĖ ą╝ą░č鹥čĆąĖą░ą╗čīąĮčŗčģ čĆąĄčüčāčĆčüąŠą▓, čāą╝ąĄąĮčīčłąĄąĮąĖčÅ ąĮą░ą│čĆčāąĘą║ąĖ ąĮą░ ąŠą║čĆčāąČą░čÄčēčāčÄ čüčĆąĄą┤čā ąĖ ą┐ąŠą▓čŗčłąĄąĮąĖčÅ čŹą║ąŠą╗ąŠą│ąĖčćąĮąŠčüčéąĖ ą┐ąŠą╗čāčćą░ąĄą╝čŗčģ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ąĘąĮą░čćąĖč鹥ą╗čīąĮčŗą╣ ąĖąĮč鹥čĆąĄčü ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčé ą┐čĆąŠčåąĄčüčüčŗ čéą▓ąĄčĆą┤ąŠč鹥ą╗čīąĮąŠą│ąŠ ą│ąĖą┤čĆąĖą┤ąĮąŠą│ąŠ čüąĖąĮč鹥ąĘą░ (ąóąōąĪ) ą╝ąĄčéą░ą╗ą╗ąŠą▓ [6, 7]. ąŁčéąĖ ą┐čĆąŠčåąĄčüčüčŗ ąŠčüčāčēąĄčüčéą▓ą╗čÅčÄčéčüčÅ, ą║ą░ą║ ą┐čĆą░ą▓ąĖą╗ąŠ, ą┐čĆąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ą╝čÅą│ą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ ą▓ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ 300-600 ┬░ąĪ. ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąŠčüąĮąŠą▓ą░ąĮ ąĮą░ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ ą▓ ąŠčéą║čĆčŗč鹊ą╣ ą┐čĆąŠč鹊čćąĮąŠą╣ čüąĖčüč鹥ą╝ąĄ čéą▓ąĄčĆą┤čŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ (čĆčāą┤) ą╝ąĄčéą░ą╗ą╗ąŠą▓ ą╗ąĄčéčāčćąĖą╝ąĖ 菹╗ąĄą╝ąĄąĮč鹊ą▓ąŠą┤ąŠčĆąŠą┤ą░ą╝ąĖ (ąŁ = N, C, Si ąĖ ą┤čĆ.) ą▓ ąŠą▒ą╗ą░čüčéąĖ č鹥čĆą╝ąŠčüčéą░ą▒ąĖą╗čīąĮąŠčüčéąĖ. ąÆ ąĮą░čüč鹊čÅčēąĄąĄ ą▓čĆąĄą╝čÅ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖčÅ ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ąŠą▓ čĆą░ąĘą▓ąĖą▓ą░čÄčéčüčÅ ą▓ čĆą░ą╝ą║ą░čģ ąĮą░čāčćąĮąŠą│ąŠ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖčÅ ąōąŠčĆąĮąŠą│ąŠ čāąĮąĖą▓ąĄčĆčüąĖč鹥čéą░. ą¤ąŠą╗čāč湥ąĮčŗ ąĖ ąĖą┤ąĄąĮčéąĖčäąĖčåąĖčĆąŠą▓ą░ąĮčŗ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖąĄ ą┐čĆąŠą┤čāą║čéčŗ, čüąĖąĮč鹥ąĘąĖčĆąŠą▓ą░ąĮąĮčŗąĄ ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖčÅ čģą╗ąŠčĆąĖą┤ąŠą▓ ąĮąĖą║ąĄą╗čÅ (II) ąĖ ą╝ąĄą┤ąĖ (II) čü ą░ą╝ą╝ąĖą░ą║ąŠą╝ [8]; čģą╗ąŠčĆąĖą┤ąŠą▓ Ni, Cu, ąĖ Fe c ą╝ąŠąĮąŠčüąĖą╗ą░ąĮąŠą╝ [6, 9]; čģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ (II) ąĖ ąŠą║čüąĖą┤ąŠą▓ Ni (II), Cu (II) ąĖ Fe (II) čü ą╝ąĄčéą░ąĮąŠą╝ (ąŠčćąĖčēąĄąĮąĮčŗą╝ ą┐čĆąĖčĆąŠą┤ąĮčŗą╝ ą│ą░ąĘąŠą╝) [8, 10]. ą×čüąŠą▒čŗą╣ ąĖąĮč鹥čĆąĄčü ą┤ą╗čÅ čüąŠąĘą┤ą░ąĮąĖčÅ ą┤ąĖčüą┐ąĄčĆčüąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ čü ąĘą░čēąĖčéąĮąŠą╣ ą║čĆąĄą╝ąĮąĖą╣ą║ą░čĆą▒ąĖą┤ąĮąŠą╣ ąĖą╗ąĖ ą║ą░čĆą▒ąŠčüąĖą╗ąŠą║čüą░ąĮąŠą▓ąŠą╣ ąĮą░ąĮąŠą┐ą╗ąĄąĮą║ąŠą╣ ąĮą░ ą╝ąĄčéą░ą╗ą╗ąĄ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčé ą┐čĆąŠčåąĄčüčüčŗ ą┐ąŠčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ čģą╗ąŠčĆąĖą┤ąĮąŠą│ąŠ ąĖą╗ąĖ ąŠą║čüąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ą┐ą░čĆą░ą╝ąĖ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░ (ą░ą╗ą║ąĖą╗ą│ąĖą┤čĆąĖą┤čüąĖą╗ąŠą║čüą░ąĮą░) ąĖ ą╝ąĄčéą░ąĮą░ [7]. ąÆ 2015 ą│. ą▒čŗą╗ čĆą░ąĘčĆą░ą▒ąŠčéą░ąĮ ąĖ ąĘą░čēąĖčēąĄąĮ ą┐ą░č鹥ąĮč鹊ą╝ ąĀąż Ōä¢ 2570599 čüą┐ąŠčüąŠą▒ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠ-ąĮą░ąĮąŠčüčéčĆčāą║čéčāčĆąĖčĆąŠą▓ą░ąĮąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą│ąŠ ą╝ą░č鹥čĆąĖą░ą╗ą░ [10, 11]. ą×čüąŠą▒ąĄąĮąĮąŠčüčéčīčÄ ą┐čĆąĄą┤ą╗ąŠąČąĄąĮąĮąŠą│ąŠ ą┐čĆąŠčåąĄčüčüą░ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ čÅą▓ąĖą╗ąŠčüčī č鹊, čćč鹊 čüčéą░ą┤ąĖąĖ čüčāčłą║ąĖ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čéą▓ąĄčĆą┤ąŠčäą░ąĘąĮąŠą│ąŠ čüčŗčĆčīčÅ ąĖ ą┐ąĄčĆą▓ąŠą│ąŠ čŹčéą░ą┐ą░ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĄą│ąŠ ą▓ ą┐ą░čĆą░čģ ą║čĆąĄą╝ąĮąĖą╣ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą│ąŠ ą│ąĖą┤čĆąĖą┤ąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ ąŠčüčāčēąĄčüčéą▓ą╗čÅą╗ąĖ ą▓ č鹊ą║ąĄ ą╝ąĄčéą░ąĮą░. ąśąĘčāč湥ąĮąĖąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą▓ čĆą░ą╝ą║ą░čģ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖą╣ ą┐ąŠ ąóąōąĪ ą░ą║čéčāą░ą╗čīąĮąŠ, ą┐ąŠąĘą▓ąŠą╗čÅąĄčé čĆąĄą░ą╗ąĖąĘąŠą▓ą░čéčī ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéąĖ ą┐ąĄčĆčüą┐ąĄą║čéąĖą▓ąĮčŗčģ ą╝ąĄč鹊ą┤ąŠą▓ čģą╗ąŠčĆąĮąŠą╣ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖąĖ [12, 13] ą┤ą╗čÅ čüąĮąĖąČąĄąĮąĖčÅ čŹą║ąŠą╗ąŠą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠą▒ą╗ąĄą╝ ą┐čĆąĖ ą┐ąŠą╗čāč湥ąĮąĖąĖ ąĮąĖą║ąĄą╗čÅ ąĖąĘ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ąŠčüčāą╗čīčäąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ. ą×ą▒čĆą░čéąĖą╝ ą▓ąĮąĖą╝ą░ąĮąĖąĄ, čćč鹊 ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖčéčī čģą╗ąŠčĆąĖą┤čŗ ą╝ąĄčéą░ą╗ą╗ą░ (Ni, Fe) ą╗ąĄą│č湥 [6, 14], č湥ą╝ ąĮąĖą║ąĄą╗čīčüąŠą┤ąĄčƹȹ░čēąĖąĄ čüčāą╗čīčäąĖą┤ąĮčŗąĄ ąĖą╗ąĖ ąŠą║čüąĖą┤ąĮčŗąĄ ą║ąŠąĮčåąĄąĮčéčĆą░čéčŗ [3, 13]. ąŁč鹊 ą┤ą░ąĄčé ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéčī čüąŠą║čĆą░čéąĖčéčī 菹ĮąĄčĆą│ąŠąĘą░čéčĆą░čéčŗ ą┐ąŠ čüčĆą░ą▓ąĮąĄąĮąĖčÄ čü čéčĆą░ą┤ąĖčåąĖąŠąĮąĮčŗą╝ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ąŠą╝. ąÆ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéąĖ ą┤ą░ą▓ąĮąŠ ąŠčéčĆą░ą▒ąŠčéą░ąĮčŗ čāčüą╗ąŠą▓ąĖčÅ ą┐ąĄčĆąĄčģąŠą┤ą░ ąŠčé ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ąČąĄą╗ąĄąĘąŠąĮąĖą║ąĄą╗ąĄą▓ąŠą│ąŠ ą║ąŠą╗č湥ą┤ą░ąĮą░, čüčāą╗čīčäąĖą┤ąĮąŠą│ąŠ ą╝ąĄą┤ąĮąŠ-ąĮąĖą║ąĄą╗ąĄą▓ąŠą│ąŠ ą║ąŠąĮčåąĄąĮčéčĆą░čéą░ ą║ čģą╗ąŠčĆąĖą┤ą░ą╝ ą╝ąĄčéą░ą╗ą╗ąŠą▓: čģą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖąĄ čüčāą╗čīčäąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ą▓ čüčĆąĄą┤ąĄ Cl2, HCl ąĖą╗ąĖ čüą┐ąĄą║ą░ąĮąĖąĄ čü čģą╗ąŠčĆąĖą┤ą░ą╝ąĖ ą┤čĆčāą│ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓ (Na, Fe ąĖ ą┤čĆ.) [13]. ąśčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖąĄ čüčéčĆčāą║čéčāčĆčŗ ąĖ čüą▓ąŠą╣čüčéą▓ ą┐ąŠą╗čāč湥ąĮąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ąóąōąĪ, ąŠą┐čŗčé ąĖčģ ą▓ąĮąĄą┤čĆąĄąĮąĖčÅ ąĮą░ ą┐čĆąĄą┤ą┐čĆąĖčÅčéąĖčÅčģ ą╝ąĖąĮąĄčĆą░ą╗čīąĮąŠ-čüčŗčĆčīąĄą▓ąŠą│ąŠ ą║ąŠą╝ą┐ą╗ąĄą║čüą░ ą┐ąŠą┤čĆąŠą▒ąĮąŠ ąŠą┐ąĖčüą░ąĮčŗ ą▓ čĆą░ą▒ąŠčéą░čģ [6-8]. ą×ą┤ąĮą░ą║ąŠ ą▓ąŠą┐čĆąŠčüčŗ ąĮą░čāčćąĮąŠą│ąŠ ąŠą▒ąŠčüąĮąŠą▓ą░ąĮąĖčÅ ą▓čŗą▒ąŠčĆą░ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ (ą╝ąĄčéą░ą╗ą╗ąŠčüąŠą┤ąĄčƹȹ░čēąĄą╣ čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ, ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗ąĄą╣, ąĖčüą┐ąŠą╗čīąĘčāąĄą╝čŗčģ ą│ą░ąĘąŠą▓), ą░ čéą░ą║ąČąĄ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖą║ąĖ ąĖ ą║ąĖąĮąĄčéąĖą║ąĖ ą┐čĆąŠčåąĄčüčüąŠą▓ ąóąōąĪ ąĮąĄą┤ąŠčüčéą░č鹊čćąĮąŠ ąŠčüą▓ąĄčēąĄąĮčŗ ą▓ ąĮą░čāčćąĮąŠą╣ ą╗ąĖč鹥čĆą░čéčāčĆąĄ. ąŚąĮą░č湥ąĮąĖąĄ ąĖ ą░ą║čéčāą░ą╗čīąĮąŠčüčéčī ą░ąĮą░ą╗ąĖąĘą░ ą┐ąĄčĆąĄčćąĖčüą╗ąĄąĮąĮčŗčģ ą░čüą┐ąĄą║č鹊ą▓ čéą▓ąĄčĆą┤ąŠč鹥ą╗čīąĮąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąŠą┐čĆąĄą┤ąĄą╗čÅčÄčéčüčÅ ąĖčģ ą▓ą░ąČąĮąŠčüčéčīčÄ ą┤ą╗čÅ čĆą░ąĘą▓ąĖčéąĖčÅ č鹥ąŠčĆąĖąĖ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ [15, 16] ąĖ ą▓ą╗ąĖčÅąĮąĖąĄą╝ ąĮą░ ą║ą░č湥čüčéą▓ąŠ ąĖ 菹║čüą┐ą╗čāą░čéą░čåąĖąŠąĮąĮčŗąĄ čüą▓ąŠą╣čüčéą▓ą░ (ąČą░čĆąŠčüč鹊ą╣ą║ąŠčüčéčī, ą│ąĖą┤čĆąŠč乊ą▒ąĮąŠčüčéčī, ą┐čĆąŠčćąĮąŠčüčéčī) ą┐ąŠą╗čāčćą░ąĄą╝ąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ą░ [17-20].
ą”ąĄą╗čī čĆą░ą▒ąŠčéčŗ ŌĆō ą░ąĮą░ą╗ąĖąĘ čĆąĄąČąĖą╝ąŠą▓ ą┐ąŠą┤ą│ąŠč鹊ą▓ą║ąĖ ąĖ čģą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ čéą▓ąĄčĆą┤ąŠčäą░ąĘąĮąŠą│ąŠ čüčŗčĆčīčÅ, ą│ąĖą┤čĆąĖą┤ąĮčŗčģ čĆąĄą░ą│ąĄąĮč鹊ą▓ ąĖ ąĖąĮąĄčĆčéąĮčŗčģ ą│ą░ąĘąŠą▓, č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ ąŠčåąĄąĮąŠą║ ąĖ ą║ąĖąĮąĄčéąĖą║ąĖ ą┐čĆąŠč鹥ą║ą░čÄčēąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ąĮą░ ą┐čĆąĖą╝ąĄčĆąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ąĖ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ąČąĄą╗ąĄąĘąŠąŠą║čüąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ.
ą£ąĄč鹊ą┤čŗ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖčÅ
ąĪčĆą░ą▓ąĮąĖč鹥ą╗čīąĮčŗą╣ (ą▓ čĆą░ąĘąĮčŗčģ ą│ąĖą┤čĆąĖą┤ąĮčŗčģ čüčĆąĄą┤ą░čģ), ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ąŠą▓, čĆąĄąĮčéą│ąĄąĮąŠčäą░ąĘąŠą▓čŗą╣ ąĖ čģąĖą╝ąĖč湥čüą║ąĖą╣ ą░ąĮą░ą╗ąĖąĘ, ą║ąŠąĮčéčĆąŠą╗čī ąĖąĘą╝ąĄąĮąĄąĮąĖčÅ ą╝ą░ą│ąĮąĖčéąĮąŠą│ąŠ ą┐ąŠč鹊ą║ą░ ą▓ čģąŠą┤ąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĮąĖą║ąĄą╗čÅ, ąĀążąŁ-čüą┐ąĄą║čéčĆąŠčüą║ąŠą┐ąĖąĖ, č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ, ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ą▓čĆąĄą╝ąĄąĮąĮąŠą╣ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ čüč鹥ą┐ąĄąĮąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ č鹊ą┐ąŠčģąĖą╝ąĖč湥čüą║ąĖą╝ąĖ čāčĆą░ą▓ąĮąĄąĮąĖčÅą╝ąĖ. ąŻą┤ą░ą╗ąĄąĮąĖąĄ ą▓ąŠą┤čŗ ąĖąĘ ąĖčüčģąŠą┤ąĮąŠą│ąŠ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čéą░ NiCl2┬Ę6H2O (čģčć) ąĖą╗ąĖ čģą╗ąŠčĆąĖą┤ąŠą▓ ąĖ ąŠą║čüąĖą┤ąŠą▓ ą┤čĆčāą│ąĖčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ (Cu, Fe) ą┐čĆąŠą▓ąŠą┤ąĖą╗ąĖ ą▓ ąĖąĮąĄčĆčéąĮąŠą╣ čüčĆąĄą┤ąĄ ą┐čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ ą┤ąŠ ą┤ąŠčüčéąĖąČąĄąĮąĖčÅ ą┐ąŠčüč鹊čÅąĮąĮąŠą╣ ą╝ą░čüčüčŗ ąĮą░ą▓ąĄčüą║ąĖ ą▓ ą┐čĆąŠč鹊čćąĮąŠą╝ čĆąĄą░ą║č鹊čĆąĄ. ąÉčĆą│ąŠąĮ ąĖ ą╝ąĄčéą░ąĮ ą▓čŗčüąŠą║ąŠą╣ čćąĖčüč鹊čéčŗ ąĖąĘ ą▒ą░ą╗ą╗ąŠąĮąŠą▓ čüčāčłąĖą╗ąĖ ąĖ ąŠčćąĖčēą░ą╗ąĖ ąŠčé ą╝ąĖą║čĆąŠą┐čĆąĖą╝ąĄčüąĄą╣ ą║ąĖčüą╗ąŠčĆąŠą┤ą░ ą┐ąŠ čüčéą░ąĮą┤ą░čĆčéąĮčŗą╝ ą╝ąĄč鹊ą┤ąĖą║ą░ą╝ [8-10] čü ąĘą░ą▓ąĄčĆčłą░čÄčēąĄą╣ čüčéą░ą┤ąĖąĄą╣ ąŠčćąĖčüčéą║ąĖ ą│ą░ąĘą░ ąĮą░ ąĮąĖąĘą║ąŠč鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą╣ (ŌĆō160 ┬░ąĪ) čåąĄąŠą╗ąĖč鹊ą▓ąŠą╣ ą╗ąŠą▓čāčłą║ąĄ. ą× čüč鹥ą┐ąĄąĮąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ (╬▒) ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ čüčāą┤ąĖą╗ąĖ ą┐ąŠ čāą▒čŗą╗ąĖ čģą╗ąŠčĆą░ ą▓ ąŠą▒čĆą░ąĘčåąĄ, ą┐ąŠ čāą▓ąĄą╗ąĖč湥ąĮąĖčÄ ą╝ą░ą│ąĮąĖčéąĮąŠą│ąŠ ą┐ąŠč鹊ą║ą░ in situ, ą┐ąŠą╝ąĄčēą░čÅ čĆąĄą░ą║č鹊čĆ čü ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░ąĄą╝čŗą╝ ąŠą▒čĆą░ąĘčåąŠą╝ ą▓ ą║ą░čéčāčłą║čā ąĖąĮą┤čāą║čéąĖą▓ąĮąŠčüčéąĖ ą╝ąĖą║čĆąŠą▓ąĄą▒ąĄčĆą╝ąĄčéčĆą░ ąż5050 [8, 10]. ążą░ą║čé ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ NiCl2 ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą┤ąŠą┐ąŠą╗ąĮąĖč鹥ą╗čīąĮąŠ ą║ąŠąĮčéčĆąŠą╗ąĖčĆąŠą▓ą░ą╗ąĖ čĆąĄąĮčéą│ąĄąĮąŠčäą░ąĘąŠą▓čŗą╝ ą░ąĮą░ą╗ąĖąĘąŠą╝ ąĖ ą╝ąĄč鹊ą┤ąŠą╝ ąĀążąŁ-čüą┐ąĄą║čéčĆąŠčüą║ąŠą┐ąĖąĖ, ąŠčéą▒ąĖčĆą░čÅ ą┐čĆąŠą▒čŗ ąĮą░ čĆą░ąĘąĮčŗčģ čüčéą░ą┤ąĖčÅčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ čéą▓ąĄčĆą┤ąŠą╣ ąĮą░ą▓ąĄčüą║ąĖ. ąĪč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ ą▒čĆčāčéč鹊-čĆąĄą░ą║čåąĖą╣ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ąŠčåąĄąĮąĖą▓ą░ą╗ąĖ ą╝ąĄč鹊ą┤ąŠą╝ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ, ąŠčüąĮąŠą▓ą░ąĮąĮąŠą│ąŠ ąĮą░ ą╝ąĖąĮąĖą╝ąĖąĘą░čåąĖąĖ 菹ĮąĄčĆą│ąĖąĖ ąōąĖą▒ą▒čüą░, čü ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĄą╝ ą┐čĆąŠą│čĆą░ą╝ą╝ąĮąŠą│ąŠ ą║ąŠą╝ą┐ą╗ąĄą║čüą░ ASTICS [6, 17, 21]. ąöą╗čÅ ąŠčåąĄąĮą║ąĖ ą┐čĆąĖą╝ąĄąĮąĖą╝ąŠčüčéąĖ č鹥čģ ąĖą╗ąĖ ąĖąĮčŗčģ ą╝ąŠą┤ąĄą╗ąĄą╣ č鹊ą┐ąŠčģąĖą╝ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ą╗ąĖ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖąĄ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ą▓ ą╗ąĖąĮąĄą╣ąĮąŠą╣ č乊čĆą╝ąĄ [8].
ą×ą▒čüčāąČą┤ąĄąĮąĖąĄ
ąśąĘ č鹥ąŠčĆąĖąĖ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ąĖąĘą▓ąĄčüčéąĮąŠ, čćč鹊 ą┐čĆąĖčüčāčéčüčéą▓ąĖąĄ ą▓ą╗ą░ą│ąĖ ą▓ čüąĖčüč鹥ą╝ąĄ čéą▓ąĄčĆą┤ąŠąĄ č鹥ą╗ąŠ (čĆčāą┤ą░) ŌĆō ą│ą░ąĘ-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čī ą╝ąĄčłą░ąĄčé ą│ą╗čāą▒ąŠą║ąŠą╝čā ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÄ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░; ą┐ąŠ ąóčĆąĄą┐ąĮąĄą╗čā, čüąŠą┤ąĄčƹȹ░ąĮąĖąĄ ą▓ąŠą┤čŗ ąĮąĄ ą╝ąĄąĮąĄąĄ 0,1 ąŠą▒čŖąĄą╝ąĮąŠą│ąŠ ą┐čĆąŠčåąĄąĮčéą░ ą▓ čüąĖčüč鹥ą╝ąĄ čüčāčēąĄčüčéą▓ąĄąĮąĮąŠ čüąĮąĖąČą░ąĄčé čüą║ąŠčĆąŠčüčéčī ą┐čĆąŠčåąĄčüčüą░. ą¤ąŠčŹč鹊ą╝čā ą┐čĆąĖ čĆą░ąĘčĆą░ą▒ąŠčéą║ąĄ ą╝ąĄč鹊ą┤ą░ ąóąōąĪ ąĘąĮą░čćąĖč鹥ą╗čīąĮąŠąĄ ą▓ąĮąĖą╝ą░ąĮąĖąĄ ą▒čŗą╗ąŠ čāą┤ąĄą╗ąĄąĮąŠ ą╝ąĖąĮąĖą╝ąĖąĘą░čåąĖąĖ čüąŠą┤ąĄčƹȹ░ąĮąĖčÅ ą▓ą╗ą░ą│ąĖ ą▓ ąĖčüčģąŠą┤ąĮąŠą╝ ą╝ąĄčéą░ą╗ą╗ąŠčüąŠą┤ąĄčƹȹ░čēąĄą╝ čüčŗčĆčīąĄ ąĖ ą│ą░ąĘąŠą▓ąŠą╣ čäą░ąĘąĄ. ą¤čĆąĖ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĖ ą▓ ą║ą░č湥čüčéą▓ąĄ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ č鹊ą▓ą░čĆąĮąŠą│ąŠ ą┐čĆąŠą┤čāą║čéą░ NiCl2ŌłÖ6H2O (čģąĖą╝ąĖč湥čüą║ąĖ čćąĖčüč鹊ą│ąŠ) ąŠą▒ąĄąĘą▓ąŠąČąĖą▓ą░ąĮąĖąĄ ąŠą▒čĆą░ąĘčåą░ ą┤ąŠčüčéąĖą│ą░ą╗ąŠčüčī čüčéčāą┐ąĄąĮčćą░čéčŗą╝ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĄą╝ ą▓ č鹊ą║ąĄ ą░čĆą│ąŠąĮą░ (čĆą░čüčģąŠą┤ 0,25 ą╗/ą╝ąĖąĮ), čüąŠą│ą╗ą░čüąĮąŠ čĆąĄąČąĖą╝ą░ą╝, ą║ąŠč鹊čĆčŗąĄ ą┐ąŠą║ą░ąĘą░ąĮčŗ ąĮą░ čĆąĖčü.1. ąĀąĄąČąĖą╝čŗ I ąĖ II, ąŠą▒ąĄčüą┐ąĄčćąĖą▓ą░čÄčēąĖąĄ čāą┤ą░ą╗ąĄąĮąĖąĄ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čéąĮąŠą╣ ą▓ąŠą┤čŗ, ąŠą▒ąŠčüąĮąŠą▓čŗą▓ą░čÄčéčüčÅ čŹą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ą┐ąŠą╗čāč湥ąĮąĮąŠą╣ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčīčÄ čāą▒čŗą╗ąĖ ą╝ą░čüčüčŗ ąŠčé ą▓čĆąĄą╝ąĄąĮąĖ (čĆąĖčü.1). ąØą░ą▒ą╗čÄą┤ą░ąĄą╝ą░čÅ čāą▒čŗą╗čī ą╝ą░čüčüčŗ č湥čĆąĄąĘ 5-6 čć č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĖ ą┐čĆą░ą║čéąĖč湥čüą║ąĖ čüąŠą▓ą┐ą░ą┤ą░ąĄčé čü čĆą░čüčüčćąĖčéą░ąĮąĮčŗą╝ ą║ąŠą╗ąĖč湥čüčéą▓ąŠą╝ ą▓ąŠą┤čŗ, čüąŠą┤ąĄčƹȹ░čēąĖą╝čüčÅ ą▓ ąĖčüčģąŠą┤ąĮąŠą╣ ąĮą░ą▓ąĄčüą║ąĄ (0,5 ą│). ąĀąĄąČąĖą╝ II ą┐ąŠąĘą▓ąŠą╗čÅąĄčé ą▒čŗčüčéčĆąĄą╣ ą▓čŗčģąŠą┤ąĖčéčī ąĮą░ čāčćą░čüč鹊ą║ ąĮą░čüčŗčēąĄąĮąĖčÅ, č湥ą╝ čĆąĄąČąĖą╝ I. ąĀąĄąČąĖą╝ II čüąŠčüč鹊ąĖčé ą▓ ą▒čŗčüčéčĆąŠą╝ ąĮą░ą│čĆąĄą▓ąĄ, ą┐čĆąĖą╝ąĄčĆąĮąŠ ą┤ąŠ 220 ┬░ąĪ ąĘą░ 0,5 čć. ąŚą░č鹥ą╝ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā ą┐ąŠą┤ąĮąĖą╝ą░čÄčé ą┤ąŠ 450 ┬░ąĪ ąĖ ą▓čŗą┤ąĄčƹȹĖą▓ą░čÄčé ą▓ č鹊ą║ąĄ ą░čĆą│ąŠąĮą░ ąĮąĄčüą║ąŠą╗čīą║ąŠ čćą░čüąŠą▓ ą┤ąŠ ą▓čŗčģąŠą┤ą░ ╬öm ąĮą░ ą┐ąŠčüč鹊čÅąĮąĮąŠąĄ ąĘąĮą░č湥ąĮąĖąĄ. ąæąŠą╗ąĄąĄ ą╝ąĄą┤ą╗ąĄąĮąĮčŗą╣ čĆąĄąČąĖą╝ I ą▓ą║ą╗čÄčćą░ąĄčé čāą┤ą░ą╗ąĄąĮąĖąĄ čäąĖąĘąĖč湥čüą║ąĖ čüąŠčĆą▒ąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą▓ąŠą┤čŗ ą▓ č鹥č湥ąĮąĖąĄ 1,5 čć ą┐čĆąĖ 80-120 ┬░ąĪ. ąöą░ą╗ąĄąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā ą┐ąŠą┤ąĮąĖą╝ą░čÄčé ą┤ąŠ 220 ┬░ąĪ, ą▓čŗą┤ąĄčƹȹĖą▓ą░čÄčé ąŠą▒čĆą░ąĘąĄčå ąĮąĄ ą▒ąŠą╗ąĄąĄ 0,5 čć ąĖ ąĘą░č鹥ą╝ ą▓čŗčģąŠą┤čÅčé ąĮą░ ąĘą░ą║ą╗čÄčćąĖč鹥ą╗čīąĮčŗą╣ čŹčéą░ą┐ č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĖ ą┐čĆąĖ 450 ┬░ąĪ. ą¦ąĄčĆąĄąĘ ąĮąĄčüą║ąŠą╗čīą║ąŠ čćą░čüąŠą▓, ą║ą░ą║ ą▓ąĖą┤ąĮąŠ ąĖąĘ čĆąĖčü.1, čāą┤ą░ą╗ąĄąĮąĖąĄ čłąĄčüčéąĖ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ ąĖąĘ ą║ą░ąČą┤ąŠą╣ ą╝ąŠą╗ąĄą║čāą╗čŗ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ąĘą░ą▓ąĄčĆčłą░ąĄčéčüčÅ. ąÆčŗą▒ąŠčĆ ą║ąŠąĮąĄčćąĮąŠą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĖ ąŠą┐čĆąĄą┤ąĄą╗čÅąĄčéčüčÅ ą▓ąĖą┤ąŠą╝ ąĖčüą┐ąŠą╗čīąĘčāąĄą╝ąŠą│ąŠ ą│ąĖą┤čĆąĖą┤ąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ ąĮą░ ą┐ąŠčüą╗ąĄą┤čāčÄčēąĄą╣ čüčéą░ą┤ąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ. ąÆ ą┐čĆąĖą▓ąĄą┤ąĄąĮąĮąŠą╝ ą┐čĆąĖą╝ąĄčĆąĄ ą┤ąĖčģą╗ąŠčĆąĖą┤ ąĮąĖą║ąĄą╗čÅ ą┤ąŠčüčāčłąĖą▓ą░ą╗ąĖ ą┐čĆąĖ 450 ┬░ąĪ, čćč鹊ą▒čŗ ą┐ąŠč鹊ą╝ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖčéčī ąĄą│ąŠ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮčŗą╝ ą░ą╝ą╝ąĖą░ą║ąŠą╝ ą┐čĆąĖ 440 ┬░ąĪ.

ąĀąĖčü.1. ąÆčĆąĄą╝ąĄąĮąĮą░čÅ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī čāą▒čŗą╗ąĖ ą╝ą░čüčüčŗ čłąĄčüčéąĖą▓ąŠą┤ąĮąŠą│ąŠ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą┐čĆąĖ č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĄ ą▓ č鹊ą║ąĄ ą░čĆą│ąŠąĮą░ ąŠčüąŠą▒ąŠą╣ čćąĖčüč鹊čéčŗ 1 ŌĆō ąĮą░ą│čĆąĄą▓ 80-120 ┬░ąĪ; 2 ŌĆō 220 ┬░ąĪ; 3 ŌĆō 450 ┬░ąĪ
ą¤ąŠčüą╗ąĄ 6 čć č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĖ ą▓ čüčĆąĄą┤ąĄ ą░čĆą│ąŠąĮą░ ą▓ ą┐ąŠą╗čāč湥ąĮąĮčŗčģ ąŠą▒čĆą░ąĘčåą░čģ, ą║ą░ą║ ą┐ąŠą║ą░ąĘą░ą╗ čģąĖą╝ąĖč湥čüą║ąĖą╣ ą░ąĮą░ą╗ąĖąĘ, ą░č鹊ą╝ąĮąŠąĄ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĄ Cl/Ni čüąŠčüčéą░ą▓ą╗čÅą╗ąŠ ą▓ąĄą╗ąĖčćąĖąĮčā 2,01┬▒0,02, ąĮą░ą╣ą┤ąĄąĮąĮąŠąĄ ą╝ąĄč鹊ą┤ąŠą╝ čĆąĄąĮčéą│ąĄąĮąŠč乊č鹊菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ čüą┐ąĄą║čéčĆąŠčüą║ąŠą┐ąĖąĖ ąŠčéąĮąŠčłąĄąĮąĖąĄ Cl/Ni ą▓ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą╝ čüą╗ąŠąĄ ąĮą░čģąŠą┤ąĖą╗ąŠčüčī ąĮą░ čāčĆąŠą▓ąĮąĄ 2,2┬▒0,1. ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, 菹╗ąĄą╝ąĄąĮčéąĮčŗą╣ ą░ąĮą░ą╗ąĖąĘ ą┐ąŠą║ą░ąĘčŗą▓ą░ąĄčé, čćč鹊 ą▓čŗčüčāčłąĄąĮąĮąŠąĄ čéą▓ąĄčĆą┤ąŠąĄ čüčŗčĆčīąĄ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé čüąŠą▒ąŠą╣ ą┤ąĖčģą╗ąŠčĆąĖą┤ ąĮąĖą║ąĄą╗čÅ, čćč鹊 ą┐ąŠą┤čéą▓ąĄčƹȹ┤ą░ąĄčéčüčÅ čĆąĄąĮčéą│ąĄąĮąŠčäą░ąĘąŠą▓čŗą╝ ą░ąĮą░ą╗ąĖąĘąŠą╝. ąĀąĄąĘčāą╗čīčéą░čéčŗ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░ ą┤ąĄą╝ąŠąĮčüčéčĆąĖčĆčāčÄčé ┬½ą┤ąĄą╗ąĖą║ą░čéąĮąŠčüčéčī┬╗ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĮąŠą╣ č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĖ. ąĪčāą┤čÅ ą┐ąŠ čüąŠčüčéą░ą▓čā ą▓čŗčüčāčłąĄąĮąĮčŗčģ ąŠą▒čĆą░ąĘčåąŠą▓, čāą┤ą░ą╗ąĄąĮąĖąĄ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ ąĖąĘ čüčéčĆčāą║čéčāčĆčŗ ą│ą░ą╗ąŠą│ąĄąĮąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ąĮąĄ ą▓čŗąĘą▓ą░ą╗ąŠ ąĘą░ą╝ąĄčéąĮąŠą│ąŠ čĆą░ąĘčĆčāčłąĄąĮąĖčÅ čüą▓čÅąĘąĄą╣ Ni-Cl ąĘą░ čüč湥čé čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖčÅ čģą╗ąŠčĆąĖą┤ą░ ą╝ąĄčéą░ą╗ą╗ą░ čü ą┤ąĄčüąŠčĆą▒ąĖčĆčāčÄčēąĄą╣čüčÅ ą▓ąŠą┤ąŠą╣ čü ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄą╝ ą╝ąŠą╗ąĄą║čāą╗ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░, čćč鹊 ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ čćą░čüčéąĖčćąĮąŠą╣ ą┐ąŠč鹥čĆąĄ čģą╗ąŠčĆą░ ą▓ ąŠą▒čĆą░ąĘčåą░čģ. ą¤ąŠą┤ąŠą▒ąĮčŗčģ ą┐čĆąŠčåąĄčüčüąŠą▓ čéčĆčāą┤ąĮąŠ ąĖąĘą▒ąĄąČą░čéčī ą┐čĆąĖ ą▓čŗčüčāčłąĖą▓ą░ąĮąĖąĖ ąŠą▒ą▓ąŠą┤ąĮąĄąĮąĮčŗčģ ą▓ąĄčüčīą╝ą░ ą│ąĖą│čĆąŠčüą║ąŠą┐ąĖčćąĮčŗčģ čģą╗ąŠčĆąĖą┤ąŠą▓ Fe (III) ąĖ Fe (II), ą║ąŠą│ą┤ą░ ąĄčüčéčī čĆąĄą░ą╗čīąĮą░čÅ ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéčī ą┐ąĄčĆąĄčģąŠą┤ą░ čćą░čüčéąĖ čģą╗ąŠčĆąĖą┤ą░ ą╝ąĄčéą░ą╗ą╗ą░ ą▓ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖą╣ ąŠą║čüąĖčģą╗ąŠčĆąĖą┤ [22, 23].
ą¤ąŠ ą┤ą░ąĮąĮčŗą╝ ą▒ąŠą╗ąĄąĄ čĆą░ąĮąĮąĖčģ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖą╣ [9] čüąĮąĖąČąĄąĮąĖąĄ ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮąŠą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ čüčāčłą║ąĖ ą┤ąŠ 230-400 ┬░ąĪ čüčāčēąĄčüčéą▓ąĄąĮąĮąŠ ą┐ąŠą▓čŗčłą░ąĄčé ą┤ą╗ąĖč鹥ą╗čīąĮąŠčüčéčī ąŠą▒ąĄąĘą▓ąŠąČąĖą▓ą░ąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ: ą┐čĆąĖ 230 ┬░ąĪ ą┤ąŠ 12 čć, ą┐čĆąĖ 300 ┬░ąĪ ą┤ąŠ 10 čć, ą┐čĆąĖ 350 ┬░ąĪ ą┤ąŠ 8,5 čć, ą┐čĆąĖ 400 ┬░ąĪ ą┤ąŠ 7,5 čć. ąÆčŗčüčāčłąĖą▓ą░ąĮąĖąĄ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čéą░ čģą╗ąŠčĆąĖą┤ą░ Ni (II) čéčĆąĄą▒čāąĄčé ąĮąĄ č鹊ą╗čīą║ąŠ čāą┤ą░ą╗ąĄąĮąĖčÅ čäąĖąĘąĖč湥čüą║ąĖ čüąŠčĆą▒ąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą▓ąŠą┤čŗ, ąĮąŠ ąĖ ą▓ąŠą┤čŗ, čāą┤ąĄčƹȹĖą▓ą░ąĄą╝ąŠą╣ ą▓ čüčéčĆčāą║čéčāčĆąĄ čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ ą║ąŠąŠčĆą┤ąĖąĮą░čåąĖąŠąĮąĮčŗą╝ąĖ čģąĖą╝ąĖč湥čüą║ąĖą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ. ą¤ąŠčŹč鹊ą╝čā č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā čüčāčłą║ąĖ ąĮą░ą┤ąŠ ą┐ąŠą┤ąĮąĖą╝ą░čéčī ą▓čŗčłąĄ 220 ┬░ąĪ. ąóąĄą╝ą┐ąĄčĆą░čéčāčĆą░ ą┤ąŠčüčāčłąĖą▓ą░ąĮąĖčÅ ąŠą▒čĆą░ąĘčåą░ ąĮą░ čāčĆąŠą▓ąĮąĄ 450 ┬░ąĪ ąĮąĄ č鹊ą╗čīą║ąŠ ą╝ąĖąĮąĖą╝ąĖąĘąĖčĆčāąĄčé ą▓čĆąĄą╝čÅ ą┐ąŠą╗ąĮąŠą│ąŠ čāą┤ą░ą╗ąĄąĮąĖčÅ ą▓ąŠą┤čŗ (ą┤ąŠ 6 čć), ąĮąŠ ąĖ ą┐ąŠąĘą▓ąŠą╗čÅąĄčé čüąŠčģčĆą░ąĮąĖčéčī čéčĆą░ąĮčüą┐ąŠčĆčéąĮčŗąĄ ą┐ąŠčĆčŗ čéą▓ąĄčĆą┤ąŠą│ąŠ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ, ąĮąĄąŠą▒čģąŠą┤ąĖą╝čŗąĄ ą┤ą╗čÅ ą┤ąŠčüčéčāą┐ą░ ą╝ąŠą╗ąĄą║čāą╗ ą│ąĖą┤čĆąĖą┤ąĮčŗčģ čĆąĄą░ą│ąĄąĮč鹊ą▓ ąĖ ą│ą╗čāą▒ąŠą║ąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĮą░ ą┐ąŠčüą╗ąĄą┤čāčÄčēąĄą╣ čüčéą░ą┤ąĖąĖ ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ą░.
ą£ąĄč鹊ą┤ąĖą║ąĖ, ąŠčüąĮąŠą▓ą░ąĮąĮčŗąĄ ąĮą░ ą│čĆą░ą▓ąĖą╝ąĄčéčĆąĖč湥čüą║ąĖčģ ąĖąĘą╝ąĄčĆąĄąĮąĖčÅčģ ą┐ąŠč鹥čĆąĖ ą╝ą░čüčüčŗ ąŠą▒čĆą░ąĘčåąŠą▓ ą┐čĆąĖ ą▓čŗčüčāčłąĖą▓ą░ąĮąĖąĖ ąĖ ą║ąŠąĮčéčĆąŠą╗ąĄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ąĖ čäą░ąĘąŠą▓ąŠą│ąŠ čüąŠčüčéą░ą▓ą░ ąŠą▒čĆą░ąĘčåąŠą▓ ą▓ ą┐čĆąŠčåąĄčüčüąĄ č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĖ, ą┐čĆąĖą╝ąĄąĮčÅą╗ąĖ čéą░ą║ąČąĄ ą┐čĆąĖ ą┐ąŠą┤ą│ąŠč鹊ą▓ą║ąĄ ą┤čĆčāą│ąĖčģ ą▓ąĖą┤ąŠą▓ ąĖčüčģąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ąŠčüąŠą┤ąĄčƹȹ░čēąĄą│ąŠ čüčŗčĆčīčÅ: ąŠą║čüąĖą┤ą░ Ni (II), čģą╗ąŠčĆąĖą┤ąŠą▓ ąĖ ąŠą║čüąĖą┤ąŠą▓ Cu (II) ąĖ Fe (II), ą░ čéą░ą║ąČąĄ ąŠą╗ąĄąĮąĄą│ąŠčĆčüą║ąŠą│ąŠ čüčāą┐ąĄčĆą║ąŠąĮčåąĄąĮčéčĆą░čéą░, ą▒ą╗ąĖąĘą║ąŠą│ąŠ ą┐ąŠ čüąŠčüčéą░ą▓čā ą║ Fe3O4 (ą┤ąŠ 99,5 ą╝ą░čü.%) [8-10].
ąĀą░čüčüą╝ąŠčéčĆąĖą╝ ą┐čĆąĖą╝ąĄčĆ čüčāčłą║ąĖ ąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąŠą╗ąĄąĮąĄą│ąŠčĆčüą║ąŠą│ąŠ čüčāą┐ąĄčĆą║ąŠąĮčåąĄąĮčéčĆą░čéą░. ą×ą╗ąĄąĮąĄą│ąŠčĆčüą║ąĖą╣ čüčāą┐ąĄčĆą║ąŠąĮčåąĄąĮčéčĆą░čé (ą×ąĪąÜ) ŌĆō ą┐čĆąŠą┤čāą║čé ąŠą▒ąŠą│ą░čēąĄąĮąĖčÅ ą╝ą░ą│ąĮąĄčéąĖč鹊ą▓ąŠą│ąŠ ą║ąŠąĮčåąĄąĮčéčĆą░čéą░, ą┐ąŠą╗čāčćą░ąĄą╝čŗą╣ ąĖąĘ ą╝ąĄčüč鹊čĆąŠąČą┤ąĄąĮąĖą╣ čĆčāą┤čŗ ąĮą░ ąĪąĄą▓ąĄčĆąŠ-ąŚą░ą┐ą░ą┤ąĄ ąĀąż. ą×čüąĮąŠą▓ąĮąŠą╣ ą║ąŠą╝ą┐ąŠąĮąĄąĮčé ą×ąĪąÜ ŌĆō Fe3O4 (ą┤ąŠ 99,5 ą╝ą░čü.%), čéąĖą┐ąĖčćąĮčŗąĄ ą┐čĆąĖą╝ąĄčüąĖ ŌĆō ą░ą╗čÄą╝ąĖąĮąĖą╣ ąĖ ą║čĆąĄą╝ąĮąĖą╣ (ą┤ąĄčüčÅčéčŗąĄ ą┤ąŠą╗ąĖ ą┐čĆąŠčåąĄąĮčéą░). ą×ąĪąÜ ŌĆō ą┐ąŠčĆąŠčłąŠą║ č湥čĆąĮąŠą│ąŠ čåą▓ąĄčéą░, čāą┤ąĄą╗čīąĮą░čÅ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéčī ąŠą║ąŠą╗ąŠ 10 ą╝2/ą│. ąŻą┤ą░ą╗ąĄąĮąĖąĄ čüąŠčĆą▒ąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą▓ą╗ą░ą│ąĖ ąĖąĘ ą×ąĪąÜ ą▓ąĄą┤čāčé ą▓ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą╝ čĆąĄąČąĖą╝ąĄ II (čĆąĖčü.1), ą▓ čüčĆąĄą┤ąĄ ąŠčćąĖčēąĄąĮąĮąŠą│ąŠ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ą│ą░ąĘą░, ą┐ąŠą┤ąĮąĖą╝ą░čÅ ąĘą░ą║ą╗čÄčćąĖč鹥ą╗čīąĮčāčÄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā čüčéą░ą┤ąĖąĖ čüčāčłą║ąĖ ą┤ąŠ 400 ┬░ąĪ. ą¤čĆąĖ čŹč鹊ą╣ ąČąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĄ ąŠą▒čĆą░ą▒ą░čéčŗą▓ą░čÄčé ą▓čŗčüčāčłąĄąĮąĮčŗą╣ ą×ąĪąÜ ą▓ ą┐ą░čĆą░čģ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░ ąĖą╗ąĖ ą│ąĖą┤čĆąŠč乊ą▒ąĖąĘąĖčĆčāčÄčēąĄą╣ ą║čĆąĄą╝ąĮąĖą╣ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ ąČąĖą┤ą║ąŠčüčéąĖ ąōąÜą¢-94 ąĮąĄ ą╝ąĄąĮąĄąĄ 1,0-1,5 čć. ą¤ąŠčüą╗ąĄ čŹč鹊ą│ąŠ ąŠčéą║ą╗čÄčćą░čÄčé ą┐ąŠą┤ą░čćčā ą║čĆąĄą╝ąĮąĖą╣ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ ąĖ ą┐ąŠą┤ąĮąĖą╝ą░čÄčé č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā ą┤ąŠ 500 ┬░ąĪ. ąÆ č鹊ą║ąĄ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ą│ą░ąĘą░ ą│ą╗čāą▒ąŠą║ąŠą╣ ąŠčüčāčłą║ąĖ ąĖ ąŠčćąĖčüčéą║ąĖ ąŠą▒čĆą░ąĘąĄčå ą▓čŗą┤ąĄčƹȹĖą▓ą░čÄčé ąĮąĄ ą╝ąĄąĮąĄąĄ 3 čć ą┤ąŠ ą┐čĆąĄą║čĆą░čēąĄąĮąĖčÅ ą▓čŗą┤ąĄą╗ąĄąĮąĖčÅ CO2 ąĮą░ ą▓čŗčģąŠą┤ąĄ ąĖąĘ čĆąĄą░ą║č鹊čĆą░. ą¤čĆąŠą▓ąŠą┤ąĖčéčī ąĘą░ą║ą╗čÄčćąĖč鹥ą╗čīąĮčŗą╣ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čīąĮčŗą╣ ąŠčéąČąĖą│ ą┐čĆąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ, ą┐čĆąĄą▓čŗčłą░čÄčēąĖčģ 500 ┬║ąĪ, ąĮąĄ čĆąĄą║ąŠą╝ąĄąĮą┤čāąĄčéčüčÅ, čéą░ą║ ą║ą░ą║ čŹč鹊 ą┐čĆąĖą▓ąŠą┤ąĖčé ąĮąĄ č鹊ą╗čīą║ąŠ ą║ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÄ ą╝ąĄčéą░ą╗ą╗ą░, ąĮąŠ ąĖ ą║ čćą░čüčéąĖčćąĮąŠą╣ ą║ą░čĆą▒ąĖą┤ąĖąĘą░čåąĖąĖ ąČąĄą╗ąĄąĘą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ Fe2C. ąĪąŠčüčéą░ą▓ ą┐ąŠą╗čāč湥ąĮąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą│ąŠ ąŠą▒čĆą░ąĘčåą░, ą╝ą░čü.%: 94,5┬▒0,5 Fe; 0,8┬▒0,4 Si; 1,5┬▒0,3 ąĪ; 3,2┬▒0,8 ą×. ąÆ čĆąĄąĮčéą│ąĄąĮąŠą│čĆą░ą╝ą╝ąĄ ąŠą▒čĆą░ąĘčåą░ ą┐čĆąĖčüčāčéčüčéą▓čāčÄčé ą░ąĮą░ą╗ąĖčéąĖč湥čüą║ąĖąĄ ą╝ą░ą║čüąĖą╝čāą╝čŗ ą┤ąĖčäčĆą░ą║čåąĖąĖ ą▓čŗčüąŠą║ąŠą╣ ąĖąĮč鹥ąĮčüąĖą▓ąĮąŠčüčéąĖ čü d = 2,04; 1,43; 1,16, čģą░čĆą░ą║č鹥čĆąĮčŗąĄ ą┤ą╗čÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą│ąŠ ╬▒-ąČąĄą╗ąĄąĘą░. ąŁąĮąĄčĆą│ąĖčÅ čüą▓čÅąĘąĖ čāčĆąŠą▓ąĮčÅ Si2p ą▓ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą╝ čüą╗ąŠąĄ ąŠą▒čĆą░ąĘčåą░ čüąŠčüčéą░ą▓ą╗čÅąĄčé 102,5 菹Æ. ą¢ą░čĆąŠčüč鹊ą╣ą║ąŠčüčéčī ąŠą▒čĆą░ąĘčåą░ ąĮą░ ą▓ąŠąĘą┤čāčģąĄ 0,0001 ą╝ą│/čüą╝2 (900 ┬░C, 100 čć).
ą¤ąŠą▓čŗčłąĄąĮąĮčŗą╣ ąĖąĮč鹥čĆąĄčü ą░ą▓č鹊čĆąŠą▓ ą║ ą┤ąĖčģą╗ąŠčĆąĖą┤čā ąĮąĖą║ąĄą╗čÅ ą▓ čĆą░ą╝ą║ą░čģ ą┤ą░ąĮąĮąŠą╣ čüčéą░čéčīąĖ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮ ą▓čŗčüąŠą║ąŠą╣ č鹥čĆą╝ąĖč湥čüą║ąŠą╣ čāčüč鹊ą╣čćąĖą▓ąŠčüčéčīčÄ, čüč鹊ą╣ą║ąŠčüčéčīčÄ ą║ ą┐ą░čĆą░ą╝ ą▓ąŠą┤čŗ ą┐čĆąĖ ąŠą▒ąĄąĘą▓ąŠąČąĖą▓ą░ąĮąĖąĖ, ą║čĆą░ą╣ąĮąĄ ąĮąĖąĘą║ąŠą╣ ą╗ąĄčéčāč湥čüčéčīčÄ ą▓ ąĖąĮč鹥čĆą▓ą░ą╗ąĄ 350-550 ┬░ąĪ (ą┤ą░ą▓ą╗ąĄąĮąĖąĄ ą┐ą░čĆąŠą▓ ąĮąĄ ą▒ąŠą╗ąĄąĄ 0,1 ą╝ą║ą¤ą░) ą┐ąŠ čüčĆą░ą▓ąĮąĄąĮąĖčÄ čü čģą╗ąŠčĆąĖą┤ą░ą╝ąĖ ą┤čĆčāą│ąĖčģ ąĮąĄą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓. ąĪąŠą│ą╗ą░čüąĮąŠ č鹥ąŠčĆąĖąĖ, čŹč鹊 ą│ą░čĆą░ąĮčéąĖčĆčāąĄčé ą┐čĆąŠč鹥ą║ą░ąĮąĖąĄ čĆąĄą░ą║čåąĖą╣ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ą▓ čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘąĄ.
ąöčĆčāą│ą░čÅ ąŠčüąŠą▒ąĄąĮąĮąŠčüčéčī ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ čüąŠčüč鹊ąĖčé ą▓ č鹊ą╝, čćč鹊 ąĄą│ąŠ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čé ąĖą╝ąĄąĄčé čüą░ą╗ą░čéąĮčāčÄ ąŠą║čĆą░čüą║čā, ą░ ą▒ąĄąĘą▓ąŠą┤ąĮčŗą╣ ą┐čĆąĄą┐ą░čĆą░čé ŌĆō ąČąĄą╗čéčāčÄ. ąŁč鹊 ą┐ąŠąĘą▓ąŠą╗čÅąĄčé ą▓ąĖąĘčāą░ą╗čīąĮąŠ ąŠčéčüą╗ąĄąČąĖą▓ą░čéčī, ąĮą░ą▒ą╗čÄą┤ą░čÅ ąĘą░ ąŠą▒čĆą░ąĘčåąŠą╝ č湥čĆąĄąĘ čüč鹥ąĮą║čā ą┐čĆąŠč鹊čćąĮąŠą│ąŠ čĆąĄą░ą║č鹊čĆą░ ąĖąĘ čüč鹥ą║ą╗ą░ ┬½ą┐ąĖčĆąĄą║čü┬╗, ą┐čĆąŠčåąĄčüčü ąŠą▒ąĄąĘą▓ąŠąČąĖą▓ą░ąĮąĖčÅ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čéą░ ą▓ ą┐čĆąŠčåąĄčüčüąĄ č鹥čĆą╝ąŠąŠą▒čĆą░ą▒ąŠčéą║ąĖ, ą░ čéą░ą║ąČąĄ ą║ąŠąĮčéčĆąŠą╗ąĖčĆąŠą▓ą░čéčī ąĮą░čćą░ą╗ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĖ ąĖąĮč鹥ąĮčüąĖą▓ąĮąŠčüčéčī ą┐čĆąĄą▓čĆą░čēąĄąĮąĖą╣ ąĖčüčģąŠą┤ąĮąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ ąĮą░ ą┐ąŠčüą╗ąĄą┤čāčÄčēąĖčģ čüčéą░ą┤ąĖčÅčģ ąŠą▒čĆą░ą▒ąŠčéą║ąĖ ą│ąĖą┤čĆąĖą┤ąĮčŗą╝ąĖ čĆąĄą░ą│ąĄąĮčéą░ą╝ąĖ. ą¤čĆąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ NiCl2 č湥čĆąĮąĄąĄčé, ą┐ąŠčŹč鹊ą╝čā ą╝ąŠąČąĮąŠ ąĮą░ą│ą╗čÅą┤ąĮąŠ ąĮą░ą▒ą╗čÄą┤ą░čéčī ą┐čĆąŠą┤ą▓ąĖąČąĄąĮąĖąĄ čäčĆąŠąĮčéą░ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ čéą▓ąĄčĆą┤ąŠą│ąŠ čģą╗ąŠčĆąĖą┤ą░ ą┐ąŠ ąŠą▒čŖąĄą╝čā ąĖčüčģąŠą┤ąĮąŠą╣ ąĮą░ą▓ąĄčüą║ąĖ. ą×čüąŠą▒ąĄąĮąĮąŠ ą┐ąŠą╗ąĄąĘąĮčŗą╝ čŹč鹊 ąŠą║ą░ąĘą░ą╗ąŠčüčī (ą┐ąŠ ąŠą┐čŗčéčā ą░ą▓č鹊čĆąŠą▓) ą┤ą╗čÅ ą┐ąŠą┤ą▒ąŠčĆą░ ą│ą░ąĘąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čĆąĄąČąĖą╝ąŠą▓ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĮąĖą║ąĄą╗čÅ ą▓ čāą║čĆčāą┐ąĮąĄąĮąĮčŗčģ ą┐čĆąŠč鹊čćąĮčŗčģ čĆąĄą░ą║č鹊čĆą░čģ, ą│ą┤ąĄ ąĮą░ čüąĄčéą║čā čĆąĄą░ą║č鹊čĆą░ ą┐ąŠą╝ąĄčēą░ą╗ąĖ ąĮąĄ ą│čĆą░ą╝ą╝čŗ ą▒ąĄąĘą▓ąŠą┤ąĮąŠą│ąŠ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ, ą░ ą▒ąŠą╗čīčłąĖąĄ ąĄą│ąŠ ą║ąŠą╗ąĖč湥čüčéą▓ą░ ą▓ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ 0,5-1,0 ą║ą│. ąĢčēąĄ ąŠą┤ąĮąĖą╝ ą┤ąŠčüč鹊ąĖąĮčüčéą▓ąŠą╝ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ, čÅą▓ą╗čÅąĄčéčüčÅ čģąŠčĆąŠčłą░čÅ ą┐čĆąĄčüčüčāąĄą╝ąŠčüčéčī ą▓ č乊čĆą╝ąĄ čåąĖą╗ąĖąĮą┤čĆąŠą▓ ą▓čŗčüąŠč鹊ą╣ 0,05 ą╝ ąĖ ą┤ąĖą░ą╝ąĄčéčĆąŠą╝ 0,03 ą╝ ąĮą░ čüčéą░ąĮą┤ą░čĆčéąĮčŗčģ ą┐čĆąĄčüčüą░čģ. ąÆąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĮą░čÅ ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ čåąĖą╗ąĖąĮą┤čĆąĖč湥čüą║ą░čÅ ą▒ąŠą╗ą▓ą░ąĮą║ą░ ą▓čŗą┤ąĄčƹȹĖą▓ą░ą╗ą░ čĆą░ąĘą┤ą░ą▓ą╗ąĖą▓ą░čÄčēąĄąĄ čāčüąĖą╗ąĖąĄ ą▓ 4ąó (ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĮą░čÅ ąĖąĘ NiCl2 ą▓ ą▓ąŠą┤ąŠčĆąŠą┤ąĄ ŌĆō ą╝ąĄąĮąĄąĄ 2ąó), ąŠą▒ą╗ą░ą┤ą░ą╗ą░ čéą▓ąĄčĆą┤ąŠčüčéčīčÄ ą┐ąŠ ąæčĆąĖąĮąĄą╗ą╗čÄ HB ąŠą║ąŠą╗ąŠ 800, ą┐čĆąŠčćąĮąŠčüčéčīčÄ ąĮą░ čĆą░čüčéčÅąČąĄąĮąĖąĄ Žā = 450 ą£ą¤ą░, čćč鹊 ąĮąĄ čāčüčéčāą┐ą░ąĄčé ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠą╝čā ą╗ąĖč鹊ą╝čā ąŠč鹊ąČąČąĄąĮąĮąŠą╝čā ąĮąĖą║ąĄą╗čÄ (HB = 740, Žā = 400 ą£ą¤ą░). ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ą┐čĆąĖą╝ąĄąĮąĄąĮąĖąĄ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą▓ ą║ą░č湥čüčéą▓ąĄ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé ąĖąĮč鹥čĆąĄčü ąĮąĄ č鹊ą╗čīą║ąŠ ą┤ą╗čÅ ą┐čĆčÅą╝ąŠą│ąŠ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą┤ąĖčüą┐ąĄčĆčüąĮąŠą│ąŠ ąĮąĖą║ąĄą╗čÅ ąĖąĘ ąĄą│ąŠ ą│ą░ą╗ąŠą│ąĄąĮąĖą┤ą░, ąĮąŠ ąĖ ą┤ą╗čÅ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą┐čĆąŠčüč鹥ą╣čłąĖčģ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ąĖąĘą┤ąĄą╗ąĖą╣ čü čüčāčēąĄčüčéą▓ąĄąĮąĮčŗą╝ čüąĮąĖąČąĄąĮąĖąĄą╝ 菹ĮąĄčĆą│ąŠąĘą░čéčĆą░čé, ą╝ąĖąĮčāčÅ ą┐ą╗ą░ą▓ą║čā ąĖ ą╝ąĖąĮąĖą╝ąĖąĘąĖčĆčāčÅ ąĮąĄąŠą▒čģąŠą┤ąĖą╝ąŠčüčéčī ąŠą▒čĆą░ą▒ąŠčéą║ąĖ ą╝ąĄčéą░ą╗ą╗ą░.

ąĀąĖčü.2. ąŚą░ą▓ąĖčüąĖą╝ąŠčüčéčī čüč鹥ą┐ąĄąĮąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ (čäčĆą░ą║čåąĖčÅ 0,6-0,8 ą╝ą╝) ąŠčé čĆą░čüčģąŠą┤ą░ ą░čĆą│ąŠąĮą░
ąöą╗čÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ NiCl2 ą▓ čüčĆąĄą┤ąĄ NH3, SiH4, CH4 ą▓čŗą▒ąĖčĆą░ą╗ąĖ čäčĆą░ą║čåąĖąĖ čü čĆą░ąĘą╝ąĄčĆąŠą╝ čćą░čüčéąĖčå čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ ą▓ ąĖąĮč鹥čĆą▓ą░ą╗ąĄ 0,3-1,0 ą╝ą╝ [3], ą┐čĆąĖ čéą░ą║ąŠą╝ čĆą░ąĘą╝ąĄčĆąĄ čćą░čüčéąĖčå ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ąĮąĄą▒ąŠą╗čīčłąĖą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ ą│ą░ąĘąŠą▓ (H2, CO, čüą╝ąĄčüčī H2 ąĖ CO) ą┐čĆąŠąĖčüčģąŠą┤ąĖčé čü ą╝ąĖąĮąĖą╝ą░ą╗čīąĮčŗą╝ąĖ ą┤ąĖčäčäčāąĘąĖąŠąĮąĮčŗą╝ąĖ ąŠčüą╗ąŠąČąĮąĄąĮąĖčÅą╝ąĖ.
ąØą░ą╝ąĖ ą▓ą┐ąĄčĆą▓čŗąĄ čāčüčéą░ąĮąŠą▓ą╗ąĄąĮąŠ, čćč鹊 ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ NiCl2 ą▓ ą┐ą░čĆą░čģ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░ (ą£ąöąźąĪ), ąŠą▒ą╗ą░ą┤ą░čÄčēąĄą│ąŠ ą▒ąŠą╗čīčłąĖą╝ąĖ ą┐ąŠ čĆą░ąĘą╝ąĄčĆčā ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ, č湥ą╝ čā ą┐ąĄčĆąĄčćąĖčüą╗ąĄąĮąĮčŗčģ ą│ą░ąĘąŠą▓, čģą░čĆą░ą║č鹥čĆąĖąĘčāąĄčéčüčÅ ą┐čĆą░ą║čéąĖč湥čüą║ąĖ ą┐ąŠčüč鹊čÅąĮčüčéą▓ąŠą╝ čüč鹥ą┐ąĄąĮąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą┐čĆąĖ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĖ čĆą░ąĘąĮčŗčģ čäčĆą░ą║čåąĖą╣ čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ. ąÆą╗ąĖčÅąĮąĖąĄ čĆą░ąĘą╝ąĄčĆą░ čćą░čüčéąĖčå ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ąĮą░ čüč鹥ą┐ąĄąĮčī ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ (╬▒) ą┐čĆąĖ čĆą░čüčģąŠą┤ąĄ ą│ą░ąĘą░-ąĮąŠčüąĖč鹥ą╗čÅ ą┐ą░čĆąŠą▓ ą£ąöąźąĪ 300 ą╝ą╗/ą╝ąĖąĮ ąĘą░ 100 ą╝ąĖąĮ: čäčĆą░ą║čåąĖčÅ 0,3-0,5 ą╝ą╝ ŌĆō ╬▒ = 0,58; 0,5-0,8 ą╝ą╝ ŌĆō ╬▒ = 0,60; 0,8-1,0 ŌĆō ╬▒ = 0,63.
ąŚą░ą▓ąĖčüąĖą╝ąŠčüčéčī ąĮą░ čĆąĖčü.2 čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāąĄčé, čćč鹊 ą┐čĆąĖ čĆą░ąĘą╝ąĄčĆąĄ čćą░čüčéąĖčå ąĖąĘ čāą║ą░ąĘą░ąĮąĮąŠą│ąŠ ą┤ąĖą░ą┐ą░ąĘąŠąĮą░ čāą▓ąĄą╗ąĖč湥ąĮąĖąĄ čĆą░čüčģąŠą┤ą░ čüą▓čŗčłąĄ 200 ą╝ą╗/ą╝ąĖąĮ ą┤ą╗čÅ ą│ą░ąĘą░-ąĮąŠčüąĖč鹥ą╗čÅ (Ar), ą▓ č鹊ą║ąĄ ą║ąŠč鹊čĆąŠą│ąŠ ą┐ą░čĆčŗ ą£ąöąźąĪ ą┐ąŠą┤ą░čÄčéčüčÅ ą▓ čĆąĄą░ą║č鹊čĆ, ąĮąĄ ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ čĆąŠčüčéčā čüč鹥ą┐ąĄąĮąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░.
ą¤čĆąĖ ą▓čŗą▒čĆą░ąĮąĮčŗčģ ąĮą░ą╝ąĖ čģą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ą░čģ ą┤ąĖčüą┐ąĄčĆčüąĮąŠčüčéąĖ čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ ąĖ čĆą░čüčģąŠą┤ąĄ ą░čĆą│ąŠąĮą░ ą▒ąŠą╗ąĄąĄ 200 ą╝ą╗/ą╝ąĖąĮ ą┐čĆąŠčåąĄčüčü ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ąĮąĄ ą╗ąĖą╝ąĖčéąĖčĆčāąĄčéčüčÅ ą┤ąŠčüčéą░ą▓ą║ąŠą╣ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ ą║ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ ąĖ ą┐čĆą░ą║čéąĖč湥čüą║ąĖ čüąĮąĖą╝ą░čÄčéčüčÅ ąŠčüą╗ąŠąČąĮąĄąĮąĖčÅ, čüą▓čÅąĘą░ąĮąĮčŗąĄ čü ą▓ąĮąĄčłąĮąĄą╣ ą┤ąĖčäčäčāąĘąĖąĄą╣. ą¤ąŠ ą┤ą░ąĮąĮčŗą╝ ą░ą┤čüąŠčĆą▒čåąĖąŠąĮąĮąŠ-čüčéčĆčāą║čéčāčĆąĮčŗčģ ąĖąĘą╝ąĄčĆąĄąĮąĖą╣ ąĖčüčģąŠą┤ąĮą░čÅ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéčī ą┐ąŠą╗čāč湥ąĮąĮąŠą│ąŠ ą▒ąĄąĘą▓ąŠą┤ąĮąŠą│ąŠ NiCl2 čüąŠčüčéą░ą▓ą╗čÅąĄčé ąŠą║ąŠą╗ąŠ 10 ą╝2/ą│, ąŠą▒čēą░čÅ ą┐ąŠčĆąĖčüč鹊čüčéčī čüąŠčüčéą░ą▓ą╗čÅąĄčé 27,4 %, ąŠčéą║čĆčŗčéą░čÅ ą┐ąŠčĆąĖčüč鹊čüčéčī 26,8 %, ąĘą░ą║čĆčŗčéą░čÅ ą┐ąŠčĆąĖčüč鹊čüčéčī (ąĮąĄą┤ąŠčüčéčāą┐ąĮčŗąĄ ą┐ąŠčĆčŗ) ŌĆō ą╝ąĖąĮąĖą╝ą░ą╗čīąĮą░ (0,6 %). ą¤čĆąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ ą▓ SiH4 (350 ┬░ąĪ) ąŠčéą║čĆčŗčéą░čÅ ą┐ąŠčĆąĖčüč鹊čüčéčī čāą▓ąĄą╗ąĖčćąĖą▓ą░ąĄčéčüčÅ ą┤ąŠ 44 %, ą░ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéčī čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ ą┤ąŠ 40 ą╝2/ą│. ąÉąĮą░ą╗ąŠą│ąĖčćąĮčŗąĄ čģą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ąĖ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą│ąŠ ą┐čĆąŠą┤čāą║čéą░, ą┐ąŠą╗čāč湥ąĮąĮąŠą│ąŠ ą▓ čüčĆąĄą┤ąĄ NH3 (450 ┬░ąĪ), ąĖą╝ąĄčÄčé ąĘąĮą░č湥ąĮąĖčÅ 10,1 ąĖ 13 ą╝2/ą│. ąŁčéąĖ čäą░ą║čéčŗ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāčÄčé ą▓ ą┐ąŠą╗čīąĘčā č鹊ą│ąŠ, čćč鹊 ą▓ ą▓čŗą▒čĆą░ąĮąĮčŗčģ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ, ą┐ąŠ ą║čĆą░ą╣ąĮąĄą╣ ą╝ąĄčĆąĄ, ą┤ąŠ 400 ┬░ąĪ, ą┤ąĖčäčäčāąĘąĖčÅ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ ą▓ ą┐ąŠčĆą░čģ ąĮąĄ ą╝ąŠąČąĄčé ą▒čŗčéčī čüąĄčĆčīąĄąĘąĮčŗą╝ čäą░ą║č鹊čĆąŠą╝, ą╗ąĖą╝ąĖčéąĖčĆčāčÄčēąĖą╝ čüą║ąŠčĆąŠčüčéčī ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░.
ąÆčŗčüą║ą░ąĘą░ąĮąĮąŠąĄ ą┐čĆąĄą┤ą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ą┐ąŠą┤čéą▓ąĄčƹȹ┤ą░čÄčé čĆą░čüčüčćąĖčéą░ąĮąĮčŗąĄ ąĖąĘ ą┤ą░ąĮąĮčŗčģ ą┐ąŠ ą║ąĖąĮąĄčéąĖą║ąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĘąĮą░č湥ąĮąĖčÅ ą║ą░ąČčāčēąĄą╣čüčÅ čŹąĮąĄčĆą│ąĖąĖ ą░ą║čéąĖą▓ą░čåąĖąĖ ą┐čĆąŠčåąĄčüčüą░ ą▓ čĆą░ąĘą╗ąĖčćąĮčŗčģ ą│ąĖą┤čĆąĖą┤ąĮčŗčģ čüčĆąĄą┤ą░čģ (čéą░ą▒ą╗.1).
ąóą░ą▒ą╗ąĖčåą░ 1
ąŚąĮą░č湥ąĮąĖčÅ čŹąĮąĄčĆą│ąĖąĖ ą░ą║čéąĖą▓ą░čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░
|
ąÆąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čī |
H2 |
CH4 |
NH3 |
SiH4 |
CH3SiHCl2 (ą£ąöąźąĪ) |
|
ąŁąĮąĄčĆą│ąĖčÅ ą░ą║čéąĖą▓ą░čåąĖąĖ ą┐čĆąŠčåąĄčüčüą░, ą║ąöąČ/ą╝ąŠą╗čī |
130 |
150 |
200 |
250 |
240 |
ąÆąĄą╗ąĖčćąĖąĮą░ 菹ĮąĄčĆą│ąĖąĖ ą░ą║čéąĖą▓ą░čåąĖąĖ ą┐čĆąŠčåąĄčüčüąŠą▓ čü ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĄą╝ čéąĖą┐ąĖčćąĮčŗčģ ą┤ą╗čÅ ąóąōąĪ ą│ąĖą┤čĆąĖą┤ąĮčŗčģ čĆąĄą░ą│ąĄąĮč鹊ą▓, ą║ą░ą║ ąĖ ą▓ čüą╗čāčćą░ąĄ ą┐čĆąĖą╝ąĄąĮąĄąĮąĖčÅ čéčĆą░ą┤ąĖčåąĖąŠąĮąĮąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ ŌĆō ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą│ąŠ ą▓ąŠą┤ąŠčĆąŠą┤ą░, ąĘąĮą░čćąĖč鹥ą╗čīąĮąŠ ą┐čĆąĄą▓čŗčłą░ąĄčé 100 ą║ąöąČ/ą╝ąŠą╗čī. ąśąĘ čŹč鹊ą│ąŠ čüą╗ąĄą┤čāąĄčé, čćč鹊 čüą║ąŠčĆąŠčüčéčī ą│ąĄč鹥čĆąŠą│ąĄąĮąĮąŠą│ąŠ ą┐čĆąŠčåąĄčüčüą░ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą▓ čåąĄą╗ąŠą╝ ąŠą┐čĆąĄą┤ąĄą╗čÅąĄčéčüčÅ čüą║ąŠčĆąŠčüčéčīčÄ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖčÅ ą▓ čüąĖčüč鹥ą╝ąĄ.
ąÆą░ąČąĮąŠčüčéčī ą│ą╗čāą▒ąŠą║ąŠą╣ ąŠčćąĖčüčéą║ąĖ ąĖ ąŠčüčāčłą║ąĖ ą│ą░ąĘąŠą▓čŗčģ čüčĆąĄą┤, ąĖčüą┐ąŠą╗čīąĘčāąĄą╝čŗčģ ą▓ ąóąōąĪ, ą┐ąŠą┤č湥čĆą║ąĖą▓ą░ąĄčé čüą╗ąĄą┤čāčÄčēąĖą╣ 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčé. ąÆ ą┐čĆąŠčåąĄčüčüąĄ ąŠą▒čĆą░ą▒ąŠčéą║ąĖ (500-600 ┬░ąĪ) ą┐čĆąĄą┤ą▓ą░čĆąĖč鹥ą╗čīąĮąŠ ą▓čŗčüčāčłąĄąĮąĮąŠą│ąŠ ą┐ąŠčĆąŠčłą║ą░ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą▒čŗč鹊ą▓čŗą╝ ą┐čĆąĖčĆąŠą┤ąĮčŗą╝ ą│ą░ąĘąŠą╝, ą┐ąŠčüčéčāą┐ą░čÄčēąĖą╝ ąĖąĘ ą│ąŠčĆąŠą┤čüą║ąŠą╣ ą╝ą░ą│ąĖčüčéčĆą░ą╗ąĖ, ą▒ąĄąĘ čüčéą░ąĮą┤ą░čĆčéąĮąŠą╣ ąŠčćąĖčüčéą║ąĖ ąĖ ą┐čĆąŠčģąŠąČą┤ąĄąĮąĖčÅ ąĮąĖąĘą║ąŠč鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą╣ ą╗ąŠą▓čāčłą║ąĖ, ąĖčüčģąŠą┤ąĮčŗą╣ ąŠą▒čĆą░ąĘąĄčå čéą▓ąĄčĆą┤ąŠą│ąŠ čģą╗ąŠčĆąĖą┤ą░ ąĖąĘą╝ąĄąĮčÅą╗ ąŠą║čĆą░čüą║čā ąŠčé ąČąĄą╗č鹊ą╣ ą┤ąŠ čüą░ą╗ą░čéąĮąŠ-ąĘąĄą╗ąĄąĮąŠą╣. ąśąĘ čŹč鹊ą│ąŠ ąŠą┐čŗčéą░ čüą╗ąĄą┤čāąĄčé, čćč鹊 ąĮąĄąŠčćąĖčēąĄąĮąĮčŗą╣ ą┐čĆąĖčĆąŠą┤ąĮčŗą╣ ą│ą░ąĘ, čüąŠą┤ąĄčƹȹ░čēąĖą╣ čüą╝ąĄčüčī čāą│ą╗ąĄą▓ąŠą┤ąŠčĆąŠą┤ąĮčŗčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗ąĄą╣ ąĮąĄ č鹊ą╗čīą║ąŠ ąĮąĄ ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░ąĄčé ąĮąĖą║ąĄą╗čī, ąĮąŠ ąĖ ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ ąŠą▒ą▓ąŠą┤ąĮąĄąĮąĖčÄ ąĖčüčģąŠą┤ąĮąŠą│ąŠ NiCl2 ąĖ ą┐ąŠčüč鹥ą┐ąĄąĮąĮąŠą╝čā ąĄą│ąŠ ą┐čĆąĄą▓čĆą░čēąĄąĮąĖčÄ ą▓ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čé NiCl2ŌłÖH2O. ąĢčüą╗ąĖ ąČąĄ ą┐čĆąĄą┤ą▓ą░čĆąĖč鹥ą╗čīąĮąŠ ą┐čĆąŠą┐čāčüčéąĖčéčī ą┐čĆąĖą╝ąĄąĮąĄąĮąĮčŗą╣ ą┐čĆąĖčĆąŠą┤ąĮčŗą╣ ą│ą░ąĘ ą┐ąŠčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ č湥čĆąĄąĘ čüąĖčüč鹥ą╝čā ąŠčüčāčłąĖč鹥ą╗ąĄą╣ (ą┐čĆąŠą║ą░ą╗ąĄąĮąĮčŗą╣ čüąĖą╗ąĖą║ą░ą│ąĄą╗čī, ą┐ąĄąĮčéą░ąŠą║čüąĖą┤ č乊čüč乊čĆą░, ąĮą░ąĮąĄčüąĄąĮąĮčŗą╣ ąĮą░ čüč鹥ą║ą╗čÅąĮąĮčāčÄ ąĮą░čüą░ą┤ą║čā), č湥čĆąĄąĘ ą░ą║čéąĖą▓ąĖčĆąŠą▓ą░ąĮąĮčāčÄ ą╝ąĄą┤čī ąĮą░ čüąĖą╗ąĖą║ą░ą│ąĄą╗ąĄ ą┐čĆąĖ 450 ┬░ąĪ ą┤ą╗čÅ ąŠčćąĖčüčéą║ąĖ ą│ą░ąĘą░ ąŠčé ą╝ąĖą║čĆąŠą┐čĆąĖą╝ąĄčüąĄą╣ ą║ąĖčüą╗ąŠčĆąŠą┤ą░ ąĖ č湥čĆąĄąĘ ąĮąĖąĘą║ąŠč鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčāčÄ ą╗ąŠą▓čāčłą║čā, ąĮą░ą┐ąŠą╗ąĮąĄąĮąĮčāčÄ čåąĄąŠą╗ąĖč鹊ą╝, č鹊 čĆąĄąĘčāą╗čīčéą░čé ąŠą┐čŗčéą░ ą▒čāą┤ąĄčé čüąŠą▓čüąĄą╝ ąĖąĮčŗą╝.
ąÆąĖąĘčāą░ą╗čīąĮąŠ ąĮą░ą▒ą╗čÄą┤ą░ąĄčéčüčÅ ą┐ąŠč湥čĆąĮąĄąĮąĖąĄ čćą░čüčéąĖčå ąŠą▒čĆą░ąĘčåą░, ą║ąŠč鹊čĆčŗąĄ ą┤ą▓ąĖąČčāčéčüčÅ ą▓ ą┐ąŠą╗ąĄ ą┐ąŠą┤ąĮąĄčüąĄąĮąĮąŠą│ąŠ ą╝ą░ą│ąĮąĖčéą░. ą¤ąŠčüą╗ąĄ čāą┤ą░ą╗ąĄąĮąĖčÅ čģą╗ąŠčĆą░ ąĖąĘ ąŠą▒čĆą░ąĘčåą░ ą▓ ą┐čĆąŠčåąĄčüčüąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąŠčćąĖčēąĄąĮąĮčŗą╝ ą┐čĆąĖčĆąŠą┤ąĮčŗą╝ ą│ą░ąĘąŠą╝ (ą╝ąĄčéą░ąĮąŠą╝) čĆąĄąĮčéą│ąĄąĮąŠą│čĆą░ą╝ą╝čŗ ą┐ąŠą╗čāč湥ąĮąĮąŠą│ąŠ ą┐ąŠčĆąŠčłą║ą░ čüąŠą┤ąĄčƹȹ░čé ą░ąĮą░ą╗ąĖčéąĖč湥čüą║ąĖąĄ ą╝ą░ą║čüąĖą╝čāą╝čŗ ą┤ąĖčäčĆą░ą║čåąĖąĖ, ąŠčéą▓ąĄčćą░čÄčēąĖąĄ ą╝ąĄąČą┐ą╗ąŠčüą║ąŠčüčéąĮčŗą╝ čĆą░čüčüč鹊čÅąĮąĖčÅą╝ d (1,246; 1,755; 2,03), ą║ąŠč鹊čĆčŗąĄ čģą░čĆą░ą║č鹥čĆąĮčŗ ą┤ą╗čÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čäą░ąĘčŗ ąĮąĖą║ąĄą╗čÅ [3].

ąĀąĖčü.3. ąÆą╗ąĖčÅąĮąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ąĮą░ ąĖąĘą╝ąĄąĮąĄąĮąĖąĄ ą┐ąŠč鹥ąĮčåąĖą░ą╗ą░ ąōąĖą▒ą▒čüą░ ą┐čĆąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ ą│ąĖą┤čĆąĖą┤ą░ą╝ąĖ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ ą╝ąĄčéą░ą╗ą╗ąŠą▓
1 ŌĆō 4FeO + CH4 = 4Fe + CO2 + 2H2O;
2 ŌĆō FeCl2 + 2/3NH3 = Fe + 1/3N2 + 2HCl;
3 ŌĆō 4NiO + CH4 = 4Ni + CO2 + 2H2O;
4 ŌĆō NiCl2 + 2/3NH3 = Ni + 1/3N2 + 2HCl;
5 ŌĆō CuCl2 + 2/3NH3 = Cu + 1/3N2 + 2HCl;
6 ŌĆō 4CuO + CH4 = 4Cu + CO2 + 2H2O

ąĀąĖčü.4. ąÆą╗ąĖčÅąĮąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą│ąŠ čäą░ą║č鹊čĆą░ ąĮą░ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ
ąóąĄčĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖąĄ čĆą░čüč湥čéčŗ, ą▓čŗą┐ąŠą╗ąĮąĄąĮąĮčŗąĄ ą┤ą╗čÅ čĆą░ą▓ąĮąŠą▓ąĄčüąĮčŗčģ čāčüą╗ąŠą▓ąĖą╣ (čĆąĖčü.3), ą┐ąŠą║ą░ąĘčŗą▓ą░čÄčé, čćč鹊 ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ą▓ čüčĆąĄą┤ąĄ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą│ąŠ ą░ą╝ą╝ąĖą░ą║ą░ čģą╗ąŠčĆąĖą┤ąŠą▓ Ni (II) ąĖ Cu (II), ą░ čéą░ą║ąČąĄ ąŠą║čüąĖą┤ą░ ą╝ąĄą┤ąĖ ą▓čŗčłąĄ 700 ąÜ čģą░čĆą░ą║č鹥čĆąĖąĘčāąĄčéčüčÅ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ąĖąĘą╝ąĄąĮąĄąĮąĖąĄą╝ ąĖąĘąŠą▒ą░čĆąĮąŠą│ąŠ ą┐ąŠč鹥ąĮčåąĖą░ą╗ą░ ąōąĖą▒ą▒čüą░ (╬öG< 0). ąŁč鹊 ąŠąĘąĮą░čćą░ąĄčé, čćč鹊 ą┐ąĄčĆąĄčćąĖčüą╗ąĄąĮąĮčŗąĄ ą┐čĆąŠčåąĄčüčüčŗ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ ąĮąĖą║ąĄą╗čÅ ąĖ ą╝ąĄą┤ąĖ čÅą▓ą╗čÅčÄčéčüčÅ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖ ą▒ą╗ą░ą│ąŠą┐čĆąĖčÅčéąĮčŗą╝ąĖ ą▓ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą╝ ąĖąĮč鹥čĆą▓ą░ą╗ąĄ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĖčÅ ąóąōąĪ: 713-733 ąÜ (440-460 ┬░ąĪ). ą¤ąŠčüą║ąŠą╗čīą║čā čĆąĄą░ą╗čīąĮčŗąĄ ą┐čĆąŠčåąĄčüčüčŗ ąóąōąĪ ą┐čĆąŠą▓ąŠą┤čÅčé ą▓ą┤ą░ą╗ąĖ ąŠčé čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ (ą▓ ą┐ąŠč鹊ą║ąĄ ą│ą░ąĘą░-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ čü čāą┤ą░ą╗ąĄąĮąĖąĄą╝ ą╗ąĄčéčāčćąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ čĆąĄą░ą║čåąĖąĖ), ąĮą░ ą┐čĆą░ą║čéąĖą║ąĄ čāą┤ą░ąĄčéčüčÅ ą┤ąŠą▒ąĖčéčīčüčÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ NiO ą▓ CH4 ąĖ ą┤ą░ąČąĄ ąŠą║čüąĖą┤ą░ Fe (II), ąĘą░ą╝ąĄąĮąĖą▓ ą╝ąĄčéą░ąĮ ąĮą░ ą┐ą░čĆčŗ ą£ąöąźąĪ [8-10].
ąĪ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĄą╝ čüąŠą▓čĆąĄą╝ąĄąĮąĮąŠą│ąŠ ą╝ąĄč鹊ą┤ą░ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéčī ąĮąĄ č鹊ą╗čīą║ąŠ ąŠčåąĄąĮąĖčéčī ą▓ąĄčĆąŠčÅčéąĮąŠčüčéčī ą┐čĆąŠč鹥ą║ą░ąĮąĖčÅ č鹊ą│ąŠ ąĖą╗ąĖ ąĖąĮąŠą│ąŠ ą┐čĆąŠčåąĄčüčüą░ [24], ąĮąŠ ąĖ ą┐ąŠą╗čāčćąĖčéčī ą╝ą░čéčĆąĖčåčā čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖčģ ą║ąŠčŹčäčäąĖčåąĖąĄąĮč鹊ą▓ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĄą╣ čģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ [6, 17, 21]. ąÆ ą┤ą░ąĮąĮąŠą╣ čĆą░ą▒ąŠč鹥 ą▓ą┐ąĄčĆą▓čŗąĄ čĆą░čüčüčćąĖčéą░ąĮčŗ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ čĆąĄą░ą║čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą▓ čüčĆąĄą┤ąĄ ą░ą╝ą╝ąĖą░ą║ą░ ą▓ čłąĖčĆąŠą║ąŠą╝ ąĖąĮč鹥čĆą▓ą░ą╗ąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ, ą▓ą║ą╗čÄčćą░čÅ ą┤ąĖą░ą┐ą░ąĘąŠąĮ, čģą░čĆą░ą║č鹥čĆąĮčŗą╣ ą┤ą╗čÅ ąóąōąĪ (čĆąĖčü.4).
ąŁą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ą┐ąŠą┤čéą▓ąĄčƹȹ┤ąĄąĮąĮą░čÅ čüčģąĄą╝ą░ ą▒čĆčāčéč鹊-čĆąĄą░ą║čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ NiCl2 ą▓ NH3 ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ąŠą┐ąĖčüčŗą▓ą░ąĄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝:
3NiCl2 + 2NH3 ŌåÆ 3Ni + 6HCl + N2. (1)
ąöą░ąĮąĮčŗąĄ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ ąĮą░ čĆąĖčü.4 ą▓ čåąĄą╗ąŠą╝ čüąŠą│ą╗ą░čüčāčÄčéčüčÅ čüąŠ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖąĄą╣ ą┐ąŠ čüčģąĄą╝ąĄ. ąśąĘ čĆąĖčü.4 čüą╗ąĄą┤čāąĄčé, čćč鹊, ą║ą░ą║ ąĖ ą▓ ą┐čĆąĖą▓ąĄą┤ąĄąĮąĮąŠą╝ čāčĆą░ą▓ąĮąĄąĮąĖąĖ, č鹥ąŠčĆąĄčéąĖč湥čüą║ąĖąĄ čĆą░čüč湥čéčŗ ą┐ąŠą║ą░ąĘčŗą▓ą░čÄčé, čćč鹊 ąĖąĘ ą║ą░ąČą┤čŗčģ čéčĆąĄčģ ą╝ąŠą╗ąĄą║čāą╗ NiCl2 ą▓čŗčłąĄ 714 ąÜ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ čéčĆąĖ ą░č鹊ą╝ą░ ąĮąĖą║ąĄą╗čÅ, čłąĄčüčéčī ą╝ąŠą╗ąĄą║čāą╗ HCl ąĖ ąŠą┤ąĮą░ ą╝ąŠą╗ąĄą║čāą╗ą░ N2. ąĀąĄąĘčāą╗čīčéą░čéčŗ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ čéą░ą║ąČąĄ ąĮąĄ ą┐čĆąŠčéąĖą▓ąŠčĆąĄčćą░čé ąĖąĘą▓ąĄčüčéąĮčŗą╝ čüą┐čĆą░ą▓ąŠčćąĮčŗą╝ ą┤ą░ąĮąĮčŗą╝.
ąØą░ą┐čĆąĖą╝ąĄčĆ, ąĮą░ čĆąĖčü.4 ą╗ąĄą▓ąĄąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą│ąŠ ąĖąĮč鹥čĆą▓ą░ą╗ą░, ąŠčéą▓ąĄčćą░čÄčēąĄą│ąŠ ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ąŠą▓ (713-733 ąÜ), ą┐ąŠą║ą░ąĘą░ąĮąŠ ą┐čĆąĖčüčāčéčüčéą▓ąĖąĄ NH4Cl. ąÆ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą╣ ąŠą▒ą╗ą░čüčéąĖ ąóąōąĪ čģą╗ąŠčĆąĖą┤ ą░ą╝ą╝ąŠąĮąĖčÅ čāąČąĄ ąŠčéčüčāčéčüčéą▓čāąĄčé. ąŁč鹊 čüąŠąŠčéą▓ąĄčéčüčéą▓čāąĄčé č鹥čĆą╝ąŠčģąĖą╝ąĖč湥čüą║ąĖą╝ čüą▓ąŠą╣čüčéą▓ą░ą╝ NH4Cl, ą║ąŠč鹊čĆčŗą╣ ą▓ąŠąĘą│ąŠąĮčÅąĄčéčüčÅ ą┐čĆąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĄ ąŠą║ąŠą╗ąŠ 610 ąÜ (337 ┬░ąĪ) ąĖ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ą┐ąŠą║ąĖą┤ą░ąĄčé čĆąĄą░ą║čåąĖąŠąĮąĮčāčÄ ąĘąŠąĮčā ą┐čĆąŠč鹊čćąĮąŠą╣ čāčüčéą░ąĮąŠą▓ą║ąĖ. ą¤ąŠ ą┤ą░ąĮąĮčŗą╝ ąŠą┐čŗč鹊ą▓, čüčģąĄą╝ą░ ą▒čĆčāčéč鹊-čĆąĄą░ą║čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ CuCl2 ą▓ NH3 ą┐ąŠą┤čćąĖąĮčÅąĄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖčÄ, ą░ąĮą░ą╗ąŠą│ąĖčćąĮąŠą╝čā ą┐čĆąĖą▓ąĄą┤ąĄąĮąĮąŠą╝čā ą▓čŗčłąĄ. ąöą░ąĮąĮčŗąĄ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą▓ NH3 ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ą╝ąĄą┤ąĖ [6] ąĖ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ (čéą░ą▒ą╗.2) ą┤ąĄą╝ąŠąĮčüčéčĆąĖčĆčāčÄčé čģąŠčĆąŠčłąĄąĄ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĄ čĆą░čüč湥čéąĮčŗčģ ąĖ ąŠą┐čŗčéąĮčŗčģ ą┤ą░ąĮąĮčŗčģ ą┐ąŠ ą▓ąĄą╗ąĖčćąĖąĮąĄ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖčģ ą║ąŠčŹčäčäąĖčåąĖąĄąĮč鹊ą▓ ąĖ ą╝ąŠą╗čīąĮčŗą╝ ąŠčéąĮąŠčłąĄąĮąĖčÅą╝ ą╝ąĄąČą┤čā ą▓ąĄčēąĄčüčéą▓ą░ą╝ąĖ, ąŠą▒čĆą░ąĘčāčÄčēąĖą╝ąĖčüčÅ ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ą╝ąĄčéą░ą╗ą╗ą░ (ą£ = Cu, Ni).
ąóą░ą▒ą╗ąĖčåą░ 2
ą£ąŠą╗čīąĮčŗąĄ ąŠčéąĮąŠčłąĄąĮąĖčÅ čĆąĄą░ą║čéą░ąĮč鹊ą▓ ą┐čĆąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ (ą£) ą┤ąĖčģą╗ąŠčĆąĖą┤ąŠą▓ ą╝ąĄą┤ąĖ ąĖ ąĮąĖą║ąĄą╗čÅ ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ
|
ąśčüčģąŠą┤ąĮčŗąĄ |
[HCl]/[M] |
[M]/[HCl]/[N2] |
||
|
ąĀą░čüč湥čé |
ą×ą┐čŗčé |
ąĀą░čüč湥čé |
ą×ą┐čŗčé |
|
|
CuCl2 |
2:1 |
2:1 |
3:6:1 |
3:6:1 |
|
NiCl2 |
2:1 |
2:1 |
3:6:1 |
3:6:1 |
ąĪčāčēąĄčüčéą▓čāčÄčēą░čÅ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ą░čÅ ą╝ąŠą┤ąĄą╗čī ąĮąĄ čāčćąĖčéčŗą▓ą░ąĄčé, čćč鹊 ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ą┤ąĖčüčüąŠčåąĖą░čåąĖčÅ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ N-H ą░ą╝ą╝ąĖą░ą║ą░ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ąĮą░ čéą▓ąĄčĆą┤ąŠą╣ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ, ą░ ą▓čŗčüą▓ąŠą▒ąŠąČą┤ą░čÄčēąĖą╣čüčÅ ą░č鹊ą╝ ą▓ąŠą┤ąŠčĆąŠą┤ą░ čüą▓čÅąĘčŗą▓ą░ąĄčéčüčÅ čü ą░č鹊ą╝ąŠą╝ čģą╗ąŠčĆą░ ąĖąĘ ą│ą░ą╗ąŠą│ąĄąĮąĖą┤ą░ ą╝ąĄčéą░ą╗ą╗ą░ ąĖ ą▓čŗą┤ąĄą╗čÅąĄčéčüčÅ ą▓ ą▓ąĖą┤ąĄ HCl. ą¤ąŠčŹč鹊ą╝čā ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗą╣ ą▓ąŠą┤ąŠčĆąŠą┤, ą║ąŠč鹊čĆčŗą╣ ą┐čĆąĖčüčāčéčüčéą▓čāąĄčé ąĮą░ čĆąĖčü.4, ąŠč湥ą▓ąĖą┤ąĮąŠ ąĮąĄ ąŠčéčĆą░ąČą░ąĄčé ą┤ąĄčéą░ą╗ąĖ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝ą░ ąóąōąĪ, čüą▓čÅąĘą░ąĮąĮąŠą│ąŠ čü ą┤ąĖčüčüąŠčåąĖą░čéąĖą▓ąĮąŠą╣ čģąĄą╝ąŠčüąŠčĆą▒čåąĖąĄą╣ ą│ąĖą┤čĆąĖą┤ą░-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ ąĮą░ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ čéą▓ąĄčĆą┤ąŠą╣ čäą░ąĘčŗ. ąĀą░ąĘą╗ąŠąČąĄąĮąĖąĄ ą░ą╝ą╝ąĖą░ą║ą░ ąĮą░ N2 ąĖ H2 ą▓ ą│ą░ąĘąŠą▓ąŠą╣ čäą░ąĘąĄ čģą░čĆą░ą║č鹥čĆąĮąŠ ą┤ą╗čÅ ą▒ąŠą╗ąĄąĄ ą▓čŗčüąŠą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ (čüą▓čŗčłąĄ 740 ąÜ). ą×ą▒čēąĄąĄ ą▓ čäą░ąĘąŠą▓ąŠą╣ ą╝ąŠą┤ąĄą╗ąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ čéą▓ąĄčĆą┤čŗčģ čģą╗ąŠčĆąĖą┤ąŠą▓ ąĮąĖą║ąĄą╗čÅ ąĖ ą╝ąĄą┤ąĖ ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ čüąŠčüč鹊ąĖčé ą▓ č鹊ą╝, čćč鹊 ą┐čĆąĖ ąĮąĄą▓čŗčüąŠą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ (ą┤ąŠ 640 ąÜ) ąŠą┤ąĮąĖą╝ ąĖąĘ ą┐čĆąŠą┤čāą║č鹊ą▓ čĆąĄą░ą║čåąĖąĖ čÅą▓ą╗čÅąĄčéčüčÅ čģą╗ąŠčĆąĖą┤ ą░ą╝ą╝ąŠąĮąĖčÅ. ą×čüąĮąŠą▓ąĮąŠąĄ ąŠčéą╗ąĖčćąĖąĄ ąĘą░ą║ą╗čÄčćą░ąĄčéčüčÅ
ą▓ č鹊ą╝, čćč鹊 ą┐ąŠ ą┤ą░ąĮąĮčŗą╝ čĆąĖčü.4, ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ąĮąĄ čüąŠą┐čĆąŠą▓ąŠąČą┤ą░ąĄčéčüčÅ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ą╝ąŠąĮąŠčģą╗ąŠčĆąĖą┤ą░ ą╝ąĄčéą░ą╗ą╗ą░ ąĮą░ ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮąŠą╣ čüčéą░ą┤ąĖąĖ, čćč鹊 čģą░čĆą░ą║č鹥čĆąĮąŠ ą┤ą╗čÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ CuCl2 ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ. ąÆąŠąĘą╝ąŠąČąĮąŠ, čŹč鹊 čüą▓čÅąĘą░ąĮąŠ čü ą▒ąŠą╗čīčłąĄą╣ č鹥čĆą╝ąŠčāčüč鹊ą╣čćąĖą▓ąŠčüčéčīčÄ ąĖ ą┐čĆąŠčćąĮąŠčüčéčīčÄ čüą▓čÅąĘąĖ M-Cl ą▓ NiCl2, č湥ą╝ ą▓ CuCl2 [12, 13].
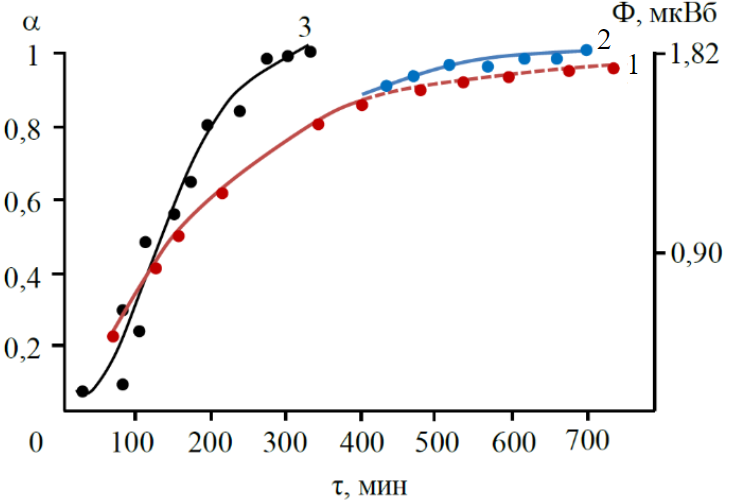
ąÉąĮą░ą╗ąĖąĘ ą▓čĆąĄą╝ąĄąĮąĮčŗčģ ąĘą░ą▓ąĖčüąĖą╝ąŠčüč鹥ą╣ čüč鹥ą┐ąĄąĮąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ (╬▒) ą┐čĆąĖ ąŠą▒čĆą░ą▒ąŠčéą║ąĄ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ąŠą║čüąĖą┤ą░ Ni (II) ąĖ čģą╗ąŠčĆąĖą┤ąŠą▓ Fe (II) ąĖ Cu (II) ą┐čĆąŠčüč鹥ą╣čłąĖą╝ąĖ ą│ąĖą┤čĆąĖą┤ą░ą╝ąĖ ą┐ąŠą║ą░ąĘą░ą╗ čüą╗ąĄą┤čāčÄčēąĄąĄ. ą¤čĆąĖ 0,1 < ╬▒ < 0,7 ąŠą┐čŗčéąĮčŗąĄ ą┤ą░ąĮąĮčŗąĄ čü ą║ąŠčŹčäčäąĖčåąĖąĄąĮč鹊ą╝ ą╗ąĖąĮąĄą╣ąĮąŠą╣ ą║ąŠčĆčĆąĄą╗čÅčåąĖąĖ 0,96-0,98 ąŠą┐ąĖčüčŗą▓ą░čÄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ ąĀąŠą│ąĖąĮčüą║ąŠą│ąŠ ŌĆō ą©čāą╗čīčå ą▓ ą╗ąĖąĮąĄą╣ąĮąŠą╣ č乊čĆą╝ąĄ (čĆąĖčü.5, ą░). ą¤čĆąĖ ą▒ąŠą╗čīčłąĖčģ čüč鹥ą┐ąĄąĮčÅčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ, ą▓ą┐ą╗ąŠčéčī ą┤ąŠ 1, ą┐čĆąĄą┤ą┐ąŠčćčéąĖč鹥ą╗čīąĮąĄą╣ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÅ ą┐ąŠą╗čāč湥ąĮąĮčŗčģ ąĘąĮą░č湥ąĮąĖą╣ ╬▒ ą▓ ą║ąŠąŠčĆą┤ąĖąĮą░čéą░čģ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗ ą▓ ą╗ąĖąĮąĄą╣ąĮąŠą╣ č乊čĆą╝ąĄ (čĆąĖčü.5, ą▒). ą¤ąŠą┤ąŠą▒ąĮčŗąĄ č鹊ą┐ąŠčģąĖą╝ąĖč湥čüą║ąĖąĄ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ąĖąĘą▓ąĄčüčéąĮčŗ ą▓ ą┐čĆą░ą║čéąĖą║ąĄ ąŠą┐ąĖčüą░ąĮąĖčÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąŠą▓ čéčĆą░ą┤ąĖčåąĖąŠąĮąĮčŗą╝ąĖ ą│ą░ąĘą░ą╝ąĖ-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅą╝ąĖ.
ąØą░ čĆąĖčü.6 ą┐čĆąĖą▓ąĄą┤ąĄąĮą░ čéąĖą┐ąĖčćąĮą░čÅ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī ╬▒ ąŠčé ą▓čĆąĄą╝ąĄąĮąĖ Žä ą┤ą╗čÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ NiCl2 ą▓ CH4 ą┐čĆąĖ 500 ┬░ąĪ. ąĪą┐čĆą░ą▓ą░ ąĮą░ čĆąĖčü.6 ą┐ąŠą╝ąĄčēąĄąĮą░ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī ╬▒ = f (Žä) ą┤ą╗čÅ ą▒ąŠą╗ąĄąĄ čüą╗ąŠąČąĮąŠą│ąŠ čüą╗čāčćą░čÅ: ą┐čĆąĖą╝ąĄčĆąĮąŠ ą┤ąŠ ╬▒ = 0,8 ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ąĖą┤ąĄčé ą▓ ą┐ą░čĆą░čģ ą£ąöąźąĪ (ą║čĆąĖą▓ą░čÅ 1), ą┤ą░ą╗ąĄąĄ ą┤ą╗čÅ čāčüą║ąŠčĆąĄąĮąĖčÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĖ čāą┤ą░ą╗ąĄąĮąĖčÅ čģą╗ąŠčĆą░ ą┐čĆąŠą▓ąŠą┤ąĖčéčüčÅ ąŠčéąČąĖą│ ą▓ CH4 ą▓ ą▒ąŠą╗ąĄąĄ ąČąĄčüčéą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗčģ čāčüą╗ąŠą▓ąĖčÅčģ (ą║čĆąĖą▓ą░čÅ 2).
ą¤čĆąĄą┤čüčéą░ą▓ą╗ąĄąĮąĖąĄ ąŠą┐čŗčéąĮčŗčģ ą┤ą░ąĮąĮčŗčģ čĆąĖčü.6 (ą║čĆąĖą▓ą░čÅ 1) ą┤ą╗čÅ 0,1 < ╬▒ < 0,7 ą▓ ą║ąŠąŠčĆą┤ąĖąĮą░čéą░čģ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ąĀąŠą│ąĖąĮčüą║ąŠą│ąŠ ŌĆō ą©čāą╗čīčå čāą┤ąŠą▓ą╗ąĄčéą▓ąŠčĆąĖč鹥ą╗čīąĮąŠ ą░ą┐ą┐čĆąŠą║čüąĖą╝ąĖčĆčāąĄčéčüčÅ ą┐čĆčÅą╝ąŠą╣ 1 ąĮą░ čĆąĖčü.7, ą░. ąØąŠ ą║ąĖąĮąĄčéąĖč湥čüą║ąĖąĄ ą┤ą░ąĮąĮčŗąĄ čĆąĖčü.6 ą┤ą╗čÅ ą▒ąŠą╗ąĄąĄ ą▓čŗčüąŠą║ąĖčģ ╬▒ ą╗čāčćčłąĄ ąŠą┐ąĖčüčŗą▓ą░čÄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗ (ą┐čĆčÅą╝ą░čÅ 2 ąĮą░ čĆąĖčü.7, ą░). ą×ą▒čĆą░ą▒ąŠčéą║ą░ 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗčģ čĆąĄąĘčāą╗čīčéą░č鹊ą▓ ą║čĆąĖą▓ą░čÅ 2 ąĮą░ čĆąĖčü.6 ą┤ą╗čÅ ╬▒ > 0,9, ą║ąŠą│ą┤ą░ ąŠą▒čĆą░ąĘąĄčå čāąČąĄ ą▓ąŠčüčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░ąĄčéčüčÅ ą▓ CH4, ą┐ąŠą║ą░ąĘčŗą▓ą░ąĄčé, čćč鹊 ą╝ąŠą┤ąĖčäąĖą║ą░čåąĖčÅ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗ ą▓ąĖą┤ą░ kŽä=1-┬│ŌłÜ(1-╬▒) čÅą▓ą╗čÅąĄčéčüčÅ ą▒ąŠą╗ąĄąĄ čāą┤ą░čćąĮąŠą╣, č湥ą╝ ą╝ąŠą┤ąĖčäąĖą║ą░čåąĖčÅ ą▓ąĖą┤ą░ kŽän=╬▒/(1-╬▒), ą│ą┤ąĄ n= 1 (čĆąĖčü.7, ą▒). ą¤čĆąĖą▓ąĄą┤ąĄąĮąĮąŠąĄ ą▓čŗčĆą░ąČąĄąĮąĖąĄ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ╬▒ ąŠčé Žä čÅą▓ą╗čÅąĄčéčüčÅ čćą░čüčéąĮčŗą╝ čüą╗čāčćą░ąĄą╝ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗. ą×ąĮąŠ ąŠą┐ąĖčüčŗą▓ą░ąĄčé čüąĖčéčāą░čåąĖčÄ, ą║ąŠą│ą┤ą░ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ čÅą┤ąĄčĆ ąĮąŠą▓ąŠą╣ čäą░ąĘčŗ ąĮąŠčüąĖčé ą╝ą│ąĮąŠą▓ąĄąĮąĮčŗą╣ čģą░čĆą░ą║č鹥čĆ ąĖ ą┐čĆąŠč鹥ą║ą░ąĄčé ą┐ąŠ ą▓čüąĄą╣ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ. ąĀąĄąĘčāą╗čīčéą░čéčŗ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ąŠą┐čŗčéąĮčŗčģ ą┤ą░ąĮąĮčŗčģ ąĮą░ čĆąĖčü.7, ą▒ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāčÄčé, čćč鹊 ą┤ą░ąĮąĮą░čÅ ą╝ąŠą┤ąĄą╗čī ąĮąĄčģą░čĆą░ą║č鹥čĆąĮą░ ą┤ą╗čÅ čĆąĄą░ą╗čīąĮąŠą│ąŠ ą┐čĆąŠčåąĄčüčüą░. ą¤čĆąŠč鹥ą║ą░ąĮąĖčÄ ą┐čĆąŠčåąĄčüčüą░ ą┐ąŠ čŹč鹊ą╣ ą╝ąŠą┤ąĄą╗ąĖ ą╝ąĄčłą░ąĄčé, ąŠč湥ą▓ąĖą┤ąĮąŠ, ąĮąĄąŠą┤ąĮąŠčĆąŠą┤ąĮąŠčüčéčī ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ, čüą▓čÅąĘą░ąĮąĮą░čÅ ą▓ č鹊ą╝ čćąĖčüą╗ąĄ čü ąĮą░ą╗ąĖčćąĖąĄą╝ čĆą░ąĘą╗ąĖčćąĮčŗčģ ą┐ąŠčĆ, ą┐ąŠą┤čéą▓ąĄčƹȹ┤ą░ąĄą╝čŗčģ ą░ą┤čüąŠčĆą▒čåąĖąŠąĮąĮąŠ-čüčéčĆčāą║čéčāčĆąĮčŗą╝ąĖ ąĖąĘą╝ąĄčĆąĄąĮąĖčÅą╝ąĖ [25].

ąĀąĖčü.5. ąĀąĄąĘčāą╗čīčéą░čéčŗ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗčģ ą║ąĖąĮąĄčéąĖč湥čüą║ąĖčģ ą┤ą░ąĮąĮčŗčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░: ą░ ŌĆō ą┤ą╗čÅ čĆąĄą░ą║čåąĖą╣ 1 ŌĆō NiO čü CH4 (500 ┬░ąĪ); 2 ŌĆō NiO čü CH4 (535 ┬░ąĪ); 3 ŌĆō FeCl2 c SiH4 (340 ┬░ąĪ); 4 ŌĆō CuCl2 čü NH3 (450 ┬░ąĪ); ą▒ ŌĆō ą┤ą╗čÅ čĆąĄą░ą║čåąĖąĖ NiO čü CH4
ąĀąĖčü.6. ąŚą░ą▓ąĖčüąĖą╝ąŠčüčéčī aąŠčé ą▓čĆąĄą╝ąĄąĮąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖčÅ čü ą£ąöąźąĪ ąĖ CH4 ą┐čĆąĖ čĆą░ąĘąĮčŗčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ ąóąōąĪ 1 ŌĆō ą£ąöąźąĪ (340 ┬░ąĪ); 2 ŌĆō ąĪąØ4 (680 ┬░ąĪ); 3 ŌĆō NiCl2 + CH4 (500 ┬░ąĪ)
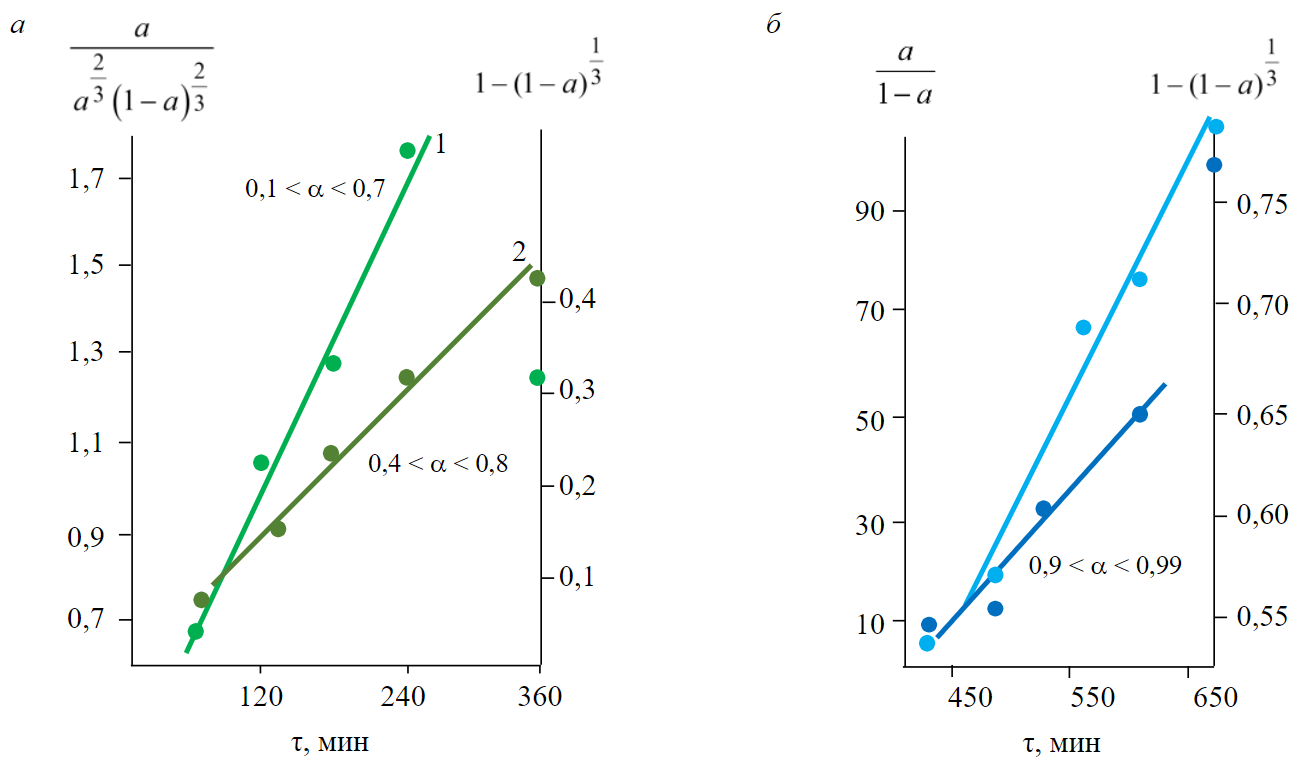
ąĀąĖčü.7. ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÅ čŹą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗčģ ą┤ą░ąĮąĮčŗčģ: ą░ ŌĆō ą║čĆąĖą▓ąŠą╣ 1 čĆąĖčü.6, čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗ ąĖ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ ąĀąŠą│ąĖąĮčüą║ąŠą│ąŠ ŌĆō ą©čāą╗čīčå; ą▒ ŌĆō ą║čĆąĖą▓ąŠą╣ 2 čĆąĖčü.6, čāčĆą░ą▓ąĮąĄąĮąĖčÅą╝ąĖ kŽän=╬▒/(1-╬▒), kŽä = 1 ŌĆō (1 ŌĆō╬▒)1/3
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ąĮą░ ąĘą░ą║ą╗čÄčćąĖč鹥ą╗čīąĮąŠą╣ čüčéą░ą┤ąĖąĖ (ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ą▓ CH4), ą┐ąŠ-ą▓ąĖą┤ąĖą╝ąŠą╝čā, ąĖą╝ąĄąĄčé ą╝ąĄčüč鹊 ą╝ąĄčģą░ąĮąĖąĘą╝ ą┐ąŠ ąŠčüąĮąŠą▓ąĮąŠą╣ ą╝ąŠą┤ąĄą╗ąĖ ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗. ą¤čĆąŠąĖčüčģąŠą┤ąĖčé čĆąŠčüčé čüą╗ąŠčÅ čüąŠą╝ą║ąĮčāą▓čłąĖčģčüčÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ąĘą░čĆąŠą┤čŗčłąĄą╣. ąĀąĄą░ą║čåąĖčÅ ą╗ąŠą║ą░ą╗ąĖąĘąŠą▓ą░ąĮą░ ąĮą░ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ čĆą░ąĘą┤ąĄą╗ą░, ą║ąŠč鹊čĆą░čÅ ą┐ąŠ čģąŠą┤čā ą┐čĆąŠčåąĄčüčüą░ ą┐čĆąŠą┤ą▓ąĖą│ą░ąĄčéčüčÅ ą▓ą│ą╗čāą▒čī ą║čĆąĖčüčéą░ą╗ą╗ą░. ą¤čĆąĄą┤ą┐ąŠą╗ą░ą│ą░čÄčé, čćč鹊 čĆąĄą░ą║čåąĖčÅ ą┐čĆąŠč鹥ą║ą░ąĄčé ąĮą░ čüč乥čĆąĖč湥čüą║ąŠą╣ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ čĆą░ąĘą┤ąĄą╗ą░, ąĖ čĆą░ą┤ąĖčāčü čüč乥čĆčŗ ą┐ąŠ čģąŠą┤čā ą┐čĆąŠčåąĄčüčüą░ čāą╝ąĄąĮčīčłą░ąĄčéčüčÅ [25]. ąŻč鹊ą╗čēąĄąĮąĖąĄ čüą╗ąŠčÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą│ąŠ ą┐čĆąŠą┤čāą║čéą░ ą╝ąŠąČąĄčé čüąŠąĘą┤ą░ą▓ą░čéčī ą┐čĆąĄą┐čÅčéčüčéą▓ąĖąĄ ą┤ą╗čÅ ą┐čĆąŠąĮąĖą║ąĮąŠą▓ąĄąĮąĖčÅ ą│ą░ąĘą░-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ ą║ čéą▓ąĄčĆą┤ąŠą╝čā čģą╗ąŠčĆąĖą┤čā ą╝ąĄčéą░ą╗ą╗ą░.
ą¤čĆąĖą▓ąĄą┤ąĄąĮąĮčŗą╣ ą╝ą░č鹥čĆąĖą░ą╗ čĆą░ąĘą▓ąĖą▓ą░ąĄčé ąĮą░čāčćąĮąŠąĄ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĄ ąōąŠčĆąĮąŠą│ąŠ čāąĮąĖą▓ąĄčĆčüąĖč鹥čéą░ ┬½ąØą░ąĮąŠčüčéčĆčāą║čéčāčĆąĖčĆąŠą▓ą░ąĮąĮčŗąĄ ą▓čŗčüąŠą║ąŠą│ąĖą┤čĆąŠč乊ą▒ąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ ąĖ čéą▓ąĄčĆą┤ąŠč鹥ą╗čīąĮčŗąĄ ą╝ąĄč鹊ą┤čŗ ąĖčģ ą┐ąŠą╗čāč湥ąĮąĖčÅ┬╗ ą▓ čĆą░ą╝ą║ą░čģ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖą╣ čłą║ąŠą╗čŗ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąŠą▓ ąōąŠčĆąĮąŠą│ąŠ čāąĮąĖą▓ąĄčĆčüąĖč鹥čéą░ [15, 19]. ą¤čĆąĖ ąĖąĘčāč湥ąĮąĖąĖ ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ą│ą╗ą░ą▓ąĮčŗą╣ ą░ą║čåąĄąĮčé čüą┤ąĄą╗ą░ąĮ ąĮą░ ą┐čĆąŠčåąĄčüčüą░čģ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ą░ ąĖąĘ čéą▓ąĄčĆą┤čŗčģ čģą╗ąŠčĆąĖą┤ąŠą▓, čĆą░čüčüą╝ą░čéčĆąĖą▓ą░ąĄą╝čŗčģ ą║ą░ą║ ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮčŗą╣ ą┐čĆąŠą┤čāą║čé ą┐čĆąĖ čģą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖąĖ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ąŠčüčāą╗čīčäąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ą▓ ą┐čĆąŠčåąĄčüčüąĄ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ą░. ąÆ čĆą░ą▒ąŠčéą░čģ [6, 7] ąŠčüąĮąŠą▓ąĮąŠąĄ ą▓ąĮąĖą╝ą░ąĮąĖąĄ čāą┤ąĄą╗čÅą╗ąŠčüčī ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéčÅą╝ ąóąōąĪ ą┐čĆąĖ ą▓ą░čĆčīąĖčĆąŠą▓ą░ąĮąĖąĖ ą▓ąĖą┤ą░ ą│ąĖą┤čĆąĖą┤ąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ ą┐ąŠą╗čāčćą░čéčī ą╝ąĄčéą░ą╗ą╗čŗ čü čĆą░ąĘą╗ąĖčćąĮčŗą╝ąĖ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮčŗą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ ąĖ ą▓čŗčüąŠą║ąĖą╝ąĖ ą┐ąŠą╗ąĄąĘąĮčŗą╝ąĖ čģą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ą░ą╝ąĖ (ąČą░čĆąŠčüč鹊ą╣ą║ąŠčüčéčī, ą│ąĖą┤čĆąŠč乊ą▒ąĮąŠčüčéčī, čüč鹊ą╣ą║ąŠčüčéčī ą║ čüąŠą╗ąĄą▓ąŠą╣ ą║ąŠčĆčĆąŠąĘąĖąĖ). ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖąĄ ąóąōąĪ ą▓ąĮąŠčüąĖčé ą▓ą║ą╗ą░ą┤ ąĮąĄ č鹊ą╗čīą║ąŠ ą▓ č鹥ąŠčĆąĖčÄ ąĮąŠą▓čŗčģ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ (ą┐čĆčÅą╝ąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ) čü ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĄą╝ ąĮąĄčéčĆą░ą┤ąĖčåąĖąŠąĮąĮčŗčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗ąĄą╣-ą╝ąŠą┤ąĖčäąĖą║ą░č鹊čĆąŠą▓, ąĮąŠ ąĖ ąŠčéą▓ąĄčćą░ąĄčé čüąŠą▓čĆąĄą╝ąĄąĮąĮčŗą╝ čéčĆąĄąĮą┤ą░ą╝ ą▓ ąŠą▒ą╗ą░čüčéąĖ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║čåąĖąĖ ąĖ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ ąĮąŠą▓ąŠą│ąŠ ą┐ąŠą║ąŠą╗ąĄąĮąĖčÅ [26, 27]. ąŻčćąĖčéčŗą▓ą░čÅ ą▓ą░ąČąĮąŠčüčéčī čüąŠąĘą┤ą░ąĮąĖčÅ čüčāą┐ąĄčĆą│ąĖą┤čĆąŠč乊ą▒ąĮčŗčģ ą┐ąŠą▓ąĄčĆčģąĮąŠčüč鹥ą╣ ą┤ą╗čÅ ą┐čĆąĄą┤ąŠčéą▓čĆą░čēąĄąĮąĖčÅ ąĮąĄąČąĄą╗ą░č鹥ą╗čīąĮčŗčģ ą║ąŠčĆčĆąŠąĘąĖąŠąĮąĮčŗčģ ąĖ ą▒ąĖąŠą╗ąŠą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ąĮą░ ą╝ąĄčéą░ą╗ą╗ą░čģ [4, 28, 29], č乊čĆą╝ąĖčĆąŠą▓ą░ąĮąĖąĄ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ąóąōąĪ ą▓ čüčĆąĄą┤ąĄ ą║čĆąĄą╝ąĮąĖą╣ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ ą│ąĖą┤čĆąĖą┤ąĮčŗčģ čĆąĄą░ą│ąĄąĮč鹊ą▓ ąĖ ą╝ąĄčéą░ąĮą░ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé ąŠčüąŠą▒čŗą╣ ąĖąĮč鹥čĆąĄčü [7, 8].
ąÆ ą║ąŠąĮčåąĄ 2020 ą│. ąĖčüą┐ąŠą╗ąĮąĖą╗ąŠčüčī 160 ą╗ąĄčé čüąŠ ą┤ąĮčÅ čĆąŠąČą┤ąĄąĮąĖčÅ ą▓čŗą┤ą░čÄčēąĄą│ąŠčüčÅ ą▓čŗą┐čāčüą║ąĮąĖą║ą░ ąōąŠčĆąĮąŠą│ąŠ ąĖąĮčüčéąĖčéčāčéą░ ą░ą║ą░ą┤ąĄą╝ąĖą║ą░ ąØ.ąĪ.ąÜčāčĆąĮą░ą║ąŠą▓ą░ ŌĆō čüąŠąĘą┤ą░č鹥ą╗čÅ ą╝ąĄč鹊ą┤ą░ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░ [30], čüč鹊čÅą▓čłąĄą│ąŠ čā ąĖčüč鹊ą║ąŠą▓ ąĮą░čāčćąĮąŠą╣ čłą║ąŠą╗čŗ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąŠą▓ ąōąŠčĆąĮąŠą│ąŠ čāąĮąĖą▓ąĄčĆčüąĖč鹥čéą░ ą▓ ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│ąĄ [3]. ą¢čāčĆąĮą░ą╗ ┬½ą”ą▓ąĄčéąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ┬╗ ą┐ąŠčüą▓čÅčéąĖą╗ ąĮąŠą╝ąĄčĆ čŹč鹊ą╝čā čüąŠą▒čŗčéąĖčÄ [31]. ąĀą░čüčüą╝ąŠčéčĆąĄąĮąĮčŗąĄ ą▓ąŠą┐čĆąŠčüčŗ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖą║ąĖ ąĖ ą║ąĖąĮąĄčéąĖą║ąĖ ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ąĮąĄčüąŠą╝ąĮąĄąĮąĮąŠ, ąĖą╗ą╗čÄčüčéčĆąĖčĆčāčÄčé ą┐čĆąĖą╝ąĄąĮąĄąĮąĖąĄ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░ ą║ ąĖąĘčāč湥ąĮąĖčÄ čüą╗ąŠąČąĮčŗčģ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮčŗčģ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓. ąśčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĄ ąŠčüąĮąŠą▓ąŠą┐ąŠą╗ą░ą│ą░čÄčēąĄą│ąŠ ą┐čĆąĖąĮčåąĖą┐ą░ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░ ą▓ ą▓čŗčÅą▓ą╗ąĄąĮąĖąĖ čüą▓čÅąĘąĖ čäąĖąĘąĖč湥čüą║ąĖčģ ąĖą╗ąĖ čģąĖą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓ ą▓ąĄčēąĄčüčéą▓ čü ąĖčģ čüąŠčüčéą░ą▓ąŠą╝ ŌĆō čģą░čĆą░ą║č鹥čĆąĮąŠ ą┤ą╗čÅ čüąŠą▓čĆąĄą╝ąĄąĮąĮčŗčģ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖą╣ čüą┐ą╗ą░ą▓ąŠą▓ ąĖ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ [30, 32], čĆą░ąĘą╗ąĖčćąĮčŗčģ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ [6, 19, 34] ąĖ ą║ąŠą╝ą┐ąŠąĘąĖčéąĮčŗčģ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ [33, 37], ą┐čĆąŠą▒ą╗ąĄą╝ ą╝ąĖąĮąĄčĆą░ą╗čīąĮąŠ-čüčŗčĆčīąĄą▓ąŠą│ąŠ ą║ąŠą╝ą┐ą╗ąĄą║čüą░ [3, 16, 36].
ą¤ąŠ ąĘą░ą╝čŗčüą╗čā čĆą░ąĘčĆą░ą▒ąŠčéčćąĖą║ąŠą▓ ąóąōąĪ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĖ ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéčÅą╝ ą╝ąĄč鹊ą┤ą░ ąŠąĮ ąŠčĆąĖąĄąĮčéąĖčĆąŠą▓ą░ąĮ ąĮąĄ ąĮą░ ą║čĆčāą┐ąĮąŠč鹊ąĮąĮą░ąČąĮčŗą╣ ą▓čŗą┐čāčüą║ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓, ą░ ąĮą░ ą┐ąŠą╗čāč湥ąĮąĖąĄ ą▓ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ąĮąĄą▒ąŠą╗čīčłąĖčģ ą║ąŠą╗ąĖč湥čüčéą▓ą░čģ čāąĮąĖą║ą░ą╗čīąĮčŗčģ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ ą┤ą╗čÅ čĆąĄčłąĄąĮąĖčÅ ┬½ą┤ąĄą╗ąĖą║ą░čéąĮčŗčģ┬╗ ąĘą░ą┤ą░čć (čüąŠąĘą┤ą░ąĮąĖąĄ ą┐ąŠčĆąĖčüčéčŗčģ ą╝ąĄčéą░ą╗ą╗ąĖąĘąĖčĆąŠą▓ą░ąĮąĮčŗčģ čģąŠą╗ąŠą┤ąĮčŗčģ ą║ą░č鹊ą┤ąŠą▓ [7], ą┐ąŠą╗čāč湥ąĮąĖąĄ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ą┤ą╗čÅ ą▒ą░čéą░čĆąĄą╣ąĮąŠą│ąŠ čüąĄą║č鹊čĆą░ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéąĖ, ą┐ąŠą╗ąĄąĘąĮčŗčģ ą┤ąĖčüą┐ąĄčĆčüąĮčŗčģ ą┤ąŠą▒ą░ą▓ąŠą║ ą┤ą╗čÅ čüą╝ą░ąĘąŠą║, ą┐ąŠą╗ąĖą╝ąĄčĆąŠą▓, ąĘą░čēąĖčéąĮčŗčģ ą┐ąŠą║čĆčŗčéąĖą╣ [8-10]). ą¤ąŠ ąĖą╝ąĄčÄčēąĖą╝čüčÅ ąŠčåąĄąĮą║ą░ą╝, ą┐ąŠčéčĆąĄą▒ąĮąŠčüčéčī ą▓ čéą▓ąĄčĆą┤čŗčģ ą┐čĆąŠą┤čāą║čéą░čģ ąóąōąĪ ą┤ą╗čÅ ą╝ąĄą│ą░ą┐ąŠą╗ąĖčüą░ ą╝ą░čüčłčéą░ą▒ą░ ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│ą░ čüąŠčüčéą░ą▓ą╗čÅąĄčé 250-300 ą║ą│/ą│ąŠą┤. ąóą░ą║ą░čÅ čüą║čĆąŠą╝ąĮą░čÅ čåąĖčäčĆą░ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮą░ č鹥ą╝, čćč鹊 ą┤ąŠą▒ą░ą▓ą║ą░ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠ-ą╝ąŠą┤ąĖčäąĖčåąĖčĆąŠą▓ą░ąĮąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ąóąōąĪ ą▓ čüą╝ą░ąĘą║ąĄ, 菹╝ą░ą╗ąĖ, ą║čĆą░čüą║ąĄ čüąŠčüčéą░ą▓ą╗čÅąĄčé, ą║ą░ą║ ą┐čĆą░ą▓ąĖą╗ąŠ, ąĮąĄ ą▒ąŠą╗ąĄąĄ 1 ą╝ą░c.%. ąÆ ąĮą░čüč鹊čÅčēąĄąĄ ą▓čĆąĄą╝čÅ čćą░čüčéčī ą┐čĆąĖą▓ąĄą┤ąĄąĮąĮčŗčģ ą▓ čüčéą░čéčīąĄ čĆąĄąĘčāą╗čīčéą░č鹊ą▓ ą┐ąŠą╗ąŠąČąĄąĮą░ ą▓ ąŠčüąĮąŠą▓čā č鹥čģąĮąŠą╗ąŠą│ąĖč湥čüą║ąĖčģ čüčģąĄą╝, ą║ąŠč鹊čĆčŗąĄ ąŠčäąĖčåąĖą░ą╗čīąĮąŠ ą▓ąĮąĄą┤čĆąĄąĮčŗ ą▓ ą┐čĆąŠąĄą║čé čüčéčĆąŠąĖč鹥ą╗čīčüčéą▓ą░ ą│ąŠčĆąĮąŠ-ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖč湥čüą║ąŠą│ąŠ ą║ąŠą╝ą▒ąĖąĮą░čéą░ ąĮą░ ąÜąĖąĮą│ą░čłčüą║ąŠą╝ ą║ąŠą▒ą░ą╗čīčé-ą╝ąĄą┤ąĮąŠ-ąĮąĖą║ąĄą╗ąĄą▓ąŠą╝ ą╝ąĄčüč鹊čĆąŠąČą┤ąĄąĮąĖąĖ (ąÜčĆą░čüąĮąŠčÅčĆčüą║ąĖą╣ ą║čĆą░ą╣).
ąŚą░ą║ą╗čÄč湥ąĮąĖąĄ
ąØą░čāčćąĮąŠ ąŠą▒ąŠčüąĮąŠą▓ą░ąĮčŗ ą▓čŗą▒ąŠčĆ ąĖ čĆąĄąČąĖą╝čŗ ą┐ąŠą┤ą│ąŠč鹊ą▓ą║ąĖ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čéą▓ąĄčĆą┤ąŠčäą░ąĘąĮąŠą│ąŠ čüčŗčĆčīčÅ ąĖ ą│ą░ąĘąŠą▓čŗčģ čüčĆąĄą┤ ą┤ą╗čÅ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ą╝ąĄč鹊ą┤ąŠą╝ ąóąōąĪ. ą×čüąŠą▒ąŠąĄ ą▓ąĮąĖą╝ą░ąĮąĖąĄ čāą┤ąĄą╗ąĄąĮąŠ ą┐čĆą░ą║čéąĖč湥čüą║ąĖ ą▓ą░ąČąĮčŗą╝ ą┐čĆąŠčåąĄčüčüą░ą╝ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ąČąĄą╗ąĄąĘąŠąŠą║čüąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ (ąŠą╗ąĄąĮąĄą│ąŠčĆčüą║ąŠą│ąŠ čüčāą┐ąĄčĆą║ąŠąĮčåąĄąĮčéčĆą░čéą░) ąĖ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ŌĆō ą┐čĆąŠą┤čāą║čéą░ čģą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖčÅ čĆčāą┤, čüąŠą┤ąĄčƹȹ░čēąĖčģ čüčāą╗čīčäąĖą┤ ąĮąĖą║ąĄą╗čÅ. ąØą░ ą┐čĆąĖą╝ąĄčĆąĄ čéą▓ąĄčĆą┤ąŠą│ąŠ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ąŠą┐ąĖčüą░ąĮčŗ ąĖ ą░čĆą│čāą╝ąĄąĮčéąĖčĆąŠą▓ą░ąĮčŗ č鹥čģąĮąŠą╗ąŠą│ąĖč湥čüą║ąĖąĄ ąŠą┐ąĄčĆą░čåąĖąĖ ąĖ ą╝ąĄč鹊ą┤ąĖą║ąĖ ą║ąŠąĮčéčĆąŠą╗čÅ ą┐ąŠą╗ąĮąŠą│ąŠ čāą┤ą░ą╗ąĄąĮąĖčÅ ą║čĆąĖčüčéą░ą╗ą╗ąŠą│ąĖą┤čĆą░čéąĮąŠą╣ ą▓ąŠą┤čŗ ąĖąĘ čģą╗ąŠčĆąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ. ąŻčüčéą░ąĮąŠą▓ą╗ąĄąĮčŗ čāčüą╗ąŠą▓ąĖčÅ, ą▓ą║ą╗čÄčćą░čÅ čĆą░ąĘą╝ąĄčĆ čćą░čüčéąĖčå ąĖčüčģąŠą┤ąĮąŠą│ąŠ čéą▓ąĄčĆą┤ąŠą│ąŠ čģą╗ąŠčĆąĖą┤ą░, ą║ąŠč鹊čĆčŗąĄ ąŠą▒ąĄčüą┐ąĄčćąĖą▓ą░čÄčé ą╝ąĖąĮąĖą╝ą░ą╗čīąĮčŗąĄ ą┤ąĖčäčäčāąĘąĖąŠąĮąĮčŗąĄ ąŠčüą╗ąŠąČąĮąĄąĮąĖčÅ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ą┐ą░čĆą░ą╝ąĖ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░.
ą¤čĆąŠą░ąĮą░ą╗ąĖąĘąĖčĆąŠą▓ą░ąĮčŗ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖąĄ ąĖ ą║ąĖąĮąĄčéąĖč湥čüą║ąĖąĄ ą░čüą┐ąĄą║čéčŗ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ čĆą░ąĘą╗ąĖčćąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ (ą£ = Ni, Fe, Cu) ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ. ą¤ąŠą║ą░ąĘą░ąĮąŠ, čćč鹊 čĆą░čüčüčćąĖčéą░ąĮąĮčŗąĄ ą╝ąĄč鹊ą┤ąŠą╝ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ ą▒čĆčāčéč鹊-čĆąĄą░ą║čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąĖčģą╗ąŠčĆąĖą┤ą░ ąĮąĖą║ąĄą╗čÅ ą▓ ą░ą╝ą╝ąĖą░ą║ąĄ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčé 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗą╝ ą┤ą░ąĮąĮčŗą╝. ą×ą▒ąĮą░čĆčāąČąĄąĮąŠ, čćč鹊 ą║ąĖąĮąĄčéąĖą║ą░ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĮąĖą║ąĄą╗čÅ, ą╝ąĄą┤ąĖ ąĖ ąČąĄą╗ąĄąĘą░ ą▓ čüčĆąĄą┤ąĄ ą░ą╝ą╝ąĖą░ą║ą░, ą╝ąŠąĮąŠčüąĖą╗ą░ąĮą░, ą╝ąĄčéą░ąĮą░ ąĖ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ą┐ąŠą┤čćąĖąĮčÅąĄčéčüčÅ č鹊ą┐ąŠčģąĖą╝ąĖč湥čüą║ąĖą╝ čāčĆą░ą▓ąĮąĄąĮąĖčÅą╝. ą¤čĆąĖ čüč鹥ą┐ąĄąĮčÅčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ╬▒ ą┤ąŠ 0,7-0,8 ą┐čĆąŠčåąĄčüčü čāą┤ąŠą▓ą╗ąĄčéą▓ąŠčĆąĖč鹥ą╗čīąĮąŠ ąŠą┐ąĖčüčŗą▓ą░ąĄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ ąĀąŠą│ąĖąĮčüą║ąŠą│ąŠ ŌĆō ą©čāą╗čīčå. ą¤čĆąĖ ╬▒ > 0,8 ąŠą┐čŗčéąĮčŗąĄ ą┤ą░ąĮąĮčŗąĄ ą╗čāčćčłąĄ ą░ą┐ą┐čĆąŠą║čüąĖą╝ąĖčĆčāčÄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ ┬½čüąČąĖą╝ą░čÄčēąĄą╣čüčÅ čüč乥čĆčŗ┬╗ ą▓ ą╗ąĖąĮąĄą╣ąĮąŠą╣ č乊čĆą╝ąĄ.
ąÆąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ ąŠą┐ąĖčüčŗą▓ą░ąĄčéčüčÅ čāčĆą░ą▓ąĮąĄąĮąĖčÅą╝ąĖ, ąĖąĘą▓ąĄčüčéąĮčŗą╝ąĖ ą┤ą╗čÅ čéčĆą░ą┤ąĖčåąĖąŠąĮąĮčŗčģ ą│ą░ąĘąŠą▓-ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗ąĄą╣ (H2, CO), čćč鹊 ą┤ą░ąĄčé ą┤ąŠą┐ąŠą╗ąĮąĖč鹥ą╗čīąĮčŗą╣ ą░čĆą│čāą╝ąĄąĮčé ą▓ ą┐ąŠą╗čīąĘčā čĆą░ąĘą▓ąĖą▓ą░ąĄą╝čŗčģ ą┐čĆąĄą┤čüčéą░ą▓ą╗ąĄąĮąĖą╣ ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝ąĄ ąóąōąĪ. ąĀąĄą░ą╗ąĖąĘą░čåąĖčÅ ą╝ąŠą┤ąĄą╗ąĄą╣ ą┐čĆąŠč鹥ą║ą░ąĮąĖčÅ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮčŗčģ čĆąĄą░ą║čåąĖą╣, čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖčģ ą┐ąĄčĆąĄčćąĖčüą╗ąĄąĮąĮčŗą╝ č鹊ą┐ąŠčģąĖą╝ąĖč湥čüą║ąĖą╝ čāčĆą░ą▓ąĮąĄąĮąĖčÅą╝, čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāąĄčé, čćč鹊 čüą▓ąĄčĆčģč鹊ąĮą║ąĖąĄ (čüčāą▒ą╝ąŠąĮąŠčüą╗ąŠą╣ąĮčŗąĄ) ą┐ą╗ąĄąĮą║ąĖ ą│ąĖą┤čĆąĖą┤ąĮčŗčģ čĆąĄą░ą│ąĄąĮč鹊ą▓, čģąĄą╝ąŠčüąŠčĆą▒ąĖčĆčāčÄčēąĖčģčüčÅ ąĮą░ ą╝ąĄčéą░ą╗ą╗ąĄ ą▓ ą┐čĆąŠčåąĄčüčüąĄ ąóąōąĪ, ąĮąĄ ąŠą║ą░ąĘčŗą▓ą░čÄčé čüąĄčĆčīąĄąĘąĮąŠą│ąŠ ą▓ą╗ąĖčÅąĮąĖčÅ ąĮą░ ą║ąĖąĮąĄčéąĖą║čā ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░. ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ą┐ąŠą║ą░ąĘą░ąĮą░ čĆąŠą╗čī čģąĄą╝ąŠčüąŠčĆą▒čåąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čÅ ąĮąĄ č鹊ą╗čīą║ąŠ ą▓ ą╝ąĄčģą░ąĮąĖąĘą╝ąĄ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ą░, ąĮąŠ ąĖ ą┐čĆąĖ č乊čĆą╝ąĖčĆąŠą▓ą░ąĮąĖąĖ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą│ąŠ ą┐čĆąŠą┤čāą║čéą░, čćč鹊 ą▓ą░ąČąĮąŠ čāčćąĖčéčŗą▓ą░čéčī ą┐čĆąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ ą┐čĆąŠčüč鹥ą╣čłąĖą╝ąĖ ą│ąĖą┤čĆąĖą┤ą░ą╝ąĖ (NH3, CH4, SiH4) ąĖ ąĖčģ ą┐čĆąŠąĖąĘą▓ąŠą┤ąĮčŗą╝ąĖ. ą¤čĆąĖą╝ąĄąĮąĄąĮąĖąĄ ąĮą░ ą┐ąĄčĆą▓ąŠą╣ čüčéą░ą┤ąĖąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąČąĄą╗ąĄąĘąŠąŠą║čüąĖą┤ąĮąŠą│ąŠ čüčŗčĆčīčÅ ąŠą▒čĆą░ą▒ąŠčéą║ąĖ ą┐ą░čĆą░ą╝ąĖ ą╝ąĄčéąĖą╗ą┤ąĖčģą╗ąŠčĆčüąĖą╗ą░ąĮą░ ą┐ąŠąĘą▓ąŠą╗čÅąĄčé ą┐čĆąŠą▓ąĄčüčéąĖ ą│ą╗čāą▒ąŠą║čāčÄ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮčāčÄ ą┐ąĄčĆąĄčĆą░ą▒ąŠčéą║čā čüčŗčĆčīčÅ ąĖ ąŠą▒ą╗ąĄą│čćąĖčéčī ą┐ąŠą╗ąĮąŠąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ ąČąĄą╗ąĄąĘą░ ą┤ąŠ ą╝ąĄčéą░ą╗ą╗ą░ ąĮą░ ąĘą░ą▓ąĄčĆčłą░čÄčēąĄą╣ čüčéą░ą┤ąĖąĖ ą▓ čüčĆąĄą┤ąĄ ą╝ąĄčéą░ąĮą░ (ą┐čĆąĖčĆąŠą┤ąĮąŠą│ąŠ ą│ą░ąĘą░) ą▓ čāčüą╗ąŠą▓ąĖčÅčģ ąóąōąĪ. ą¤ąŠ čüčāčéąĖ, ą▓ą░čĆčīąĖčĆčāčÅ ą│ąĖą┤čĆąĖą┤ąĮčŗąĄ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗ąĖ ąĖ ą┐čĆąŠą│čĆą░ą╝ą╝čā ąŠą▒čĆą░ą▒ąŠčéą║ąĖ ąĖą╝ąĖ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čéą▓ąĄčĆą┤ąŠčäą░ąĘąĮąŠą│ąŠ čüčŗčĆčīčÅ, čāą┤ą░ąĄčéčüčÅ ą┐ąŠą╗čāčćą░čéčī ą╝ąĄčéą░ą╗ą╗ąŠą┐čĆąŠą┤čāą║čåąĖčÄ ąĖ ą┤ąĖčüą┐ąĄčĆčüąĮčŗąĄ ą╝ą░č鹥čĆąĖą░ą╗čŗ ąĮąŠą▓ąŠą│ąŠ ą┐ąŠą║ąŠą╗ąĄąĮąĖčÅ čü čĆąĄą│čāą╗ąĖčĆčāąĄą╝ąŠą╣ čģąĖą╝ąĖąĄą╣ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĖ ąĖ ąĮąĄąŠą▒čģąŠą┤ąĖą╝čŗą╝ąĖ 菹║čüą┐ą╗čāą░čéą░čåąĖąŠąĮąĮčŗą╝ąĖ čģą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ą░ą╝ąĖ (ą║ąŠčĆčĆąŠąĘąĖąŠąĮąĮąŠą╣ čüč鹊ą╣ą║ąŠčüčéčīčÄ, ą░ąĮčéąĖčäčĆąĖą║čåąĖąŠąĮąĮčŗą╝ čŹčäč乥ą║č鹊ą╝ ąĖ čé.ą┤.). ąśąĮąĮąŠą▓ą░čåąĖąŠąĮąĮąŠąĄ čüąŠč湥čéą░ąĮąĖąĄ ą▓ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą╝ čüą╗ąŠąĄ ą┐ąŠą┤ąŠą▒ąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠą┤čāą║č鹊ą▓ čłąĄčĆąŠčģąŠą▓ą░č鹊čüčéąĖ ąĮą░ ą╝ąĖą║čĆąŠ- ąĖ ąĮą░ąĮąŠčāčĆąŠą▓ąĮąĄ [12, 19] ą┐čĆąĖ čģąĄą╝ąŠčüąŠčĆą▒čåąĖąĖ ą│ąĖą┤čĆąŠč乊ą▒ąĮčŗčģ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗ąĄą╣ ą┐ąŠąĘą▓ąŠą╗čÅąĄčé ą┐ąŠą╗čāčćą░čéčī čüčāą┐ąĄčĆą│ąĖą┤čĆąŠč乊ą▒ąĮčŗąĄ ą┤ąĖčüą┐ąĄčĆčüąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖąĄ ą┐čĆąŠą┤čāą║čéčŗ, ą║ąŠč鹊čĆčŗąĄ ą┐čĆą░ą║čéąĖč湥čüą║ąĖ ąĮąĄ čüą╝ą░čćąĖą▓ą░čÄčéčüčÅ ą▓ąŠą┤ąŠą╣ (ą▓ąĄą╗ąĖčćąĖąĮą░ čüąŠčĆą▒čåąĖąĖ ą▓ą╗ą░ą│ąĖ ąĮąĄ ą┐čĆąĄą▓čŗčłą░ąĄčé 0,1 ą╝ąŠąĮąŠčüą╗ąŠčÅ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ).
ąøąĖč鹥čĆą░čéčāčĆą░
- Konchus D.A., Sivenkov A.V. A surface structure formation of stainless steel using a laser // Materials Science Forum. 2021. Vol. 1022. P. 112-118. DOI: 10.4028/www.scientific.net/MSF.1022.112
- Ponomarenko T., Resheva E., Mosquera A.P. Urbano Assessment of Energy Sustainability Issues in the Andean Community: Additional Indicators and Their Interpretation // Energies. 2022. Vol. 15. Iss. 3. P. 1077. DOI: 10.3390/en15031077
- Quiroz Cabascango V.E., Bazhin V.Yu. Nickel oxide reduction in CO/CO2 gas mixtures in reverberatory furnaces // IOP Conference Series: Metrological Support of Innovative Technologies. 2020. Vol.1515. Ōä¢022028. DOI: 10.1088/1742-6596/1515/2/022028
- ą©ąĄąĮą║ ąÖ., ąøčÄąĮą│ąĄąĮ ąź.ąæ. ą¤ąŠč鹥ąĮčåąĖą░ą╗ čŹčäč乥ą║čéąĖą▓ąĮąŠą│ąŠ ą┐čĆąĖą╝ąĄąĮąĄąĮąĖčÅ ą┐čĆąŠčåąĄčüčüąŠą▓ ą┐čĆčÅą╝ąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ąĖ ą▓ąŠčüčüčéą░ąĮąŠą▓ąĖč鹥ą╗čīąĮąŠą╣ ą┐ą╗ą░ą▓ą║ąĖ ą▓ ąĢą▓čĆąŠą┐ąĄ // ą¦ąĄčĆąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ. 2017. Ōä¢ 2. ąĪ.25-31.
- ąöčāą░čĆč鹥 ą¤., ąæąĄčüąĄčĆčĆą░ ąź. ą¤čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ąŠ ą▓čŗčüąŠą║ąŠčāą│ą╗ąĄčĆąŠą┤ąĖčüč鹊ą│ąŠ ąČąĄą╗ąĄąĘą░ ą┐čĆčÅą╝ąŠą│ąŠ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ (DRI) ą┐ąŠ č鹥čģąĮąŠą╗ąŠą│ąĖąĖ Energiron DR // ą¦ąĄčĆąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ. 2016. Ōä¢ 6. ąĪ. 24-30.
- ąĪą╗ąŠą▒ąŠą┤ąŠą▓ ąÉ.ąÉ., ąĪčŗčĆą║ąŠą▓ ąÉ.ąō., ą»čćą╝ąĄąĮąŠą▓ą░ ąø.ąÉ. ąĖ ą┤čĆ. ąÆą╗ąĖčÅąĮąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ąĮą░ čéą▓ąĄčĆą┤ąŠč鹥ą╗čīąĮčŗą╣ ą│ąĖą┤čĆąĖą┤ąĮčŗą╣ čüąĖąĮč鹥ąĘ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ą┐ąŠ ą┤ą░ąĮąĮčŗą╝ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą│ąŠ ą╝ąŠą┤ąĄą╗ąĖčĆąŠą▓ą░ąĮąĖčÅ // ąŚą░ą┐ąĖčüą║ąĖ ąōąŠčĆąĮąŠą│ąŠ ąĖąĮčüčéąĖčéčāčéą░. 2019. ąó. 239. ąĪ. 550-555. DOI: 10.31897/PMI.2019.5.550
- ą¤ą╗ąĄčüą║čāąĮąŠą▓ ąś.ąÆ. ąĀą░ąĘą▓ąĖčéąĖąĄ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖą╣ ąĮąĖąĘą║ąŠčĆą░ąĘą╝ąĄčĆąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠčüąŠą┤ąĄčƹȹ░čēąĖčģ čüąĖčüč鹥ą╝ ąŠčé ą¤.ą¤.ąÆąĄą╣ą╝ą░čĆąĮą░ ą┤ąŠ ąĮą░čłąĖčģ ą┤ąĮąĄą╣ // ąŚą░ą┐ąĖčüą║ąĖ ąōąŠčĆąĮąŠą│ąŠ ąĖąĮčüčéąĖčéčāčéą░. 2018. ąó. 231. ąĪ. 287-291. DOI: 10.25515/PMI.2018.3.287
- ąÜčāčēąĄąĮą║ąŠ ąÉ.ąØ. ą×čüąŠą▒ąĄąĮąĮąŠčüčéąĖ č乊čĆą╝ąĖčĆąŠą▓ą░ąĮąĖčÅ čüąŠčĆą▒čåąĖąŠąĮąĮčŗčģ čüą▓ąŠą╣čüčéą▓ ąĖ ą│ąĖą┤čĆąŠč乊ą▒ąĮąŠčüčéąĖ ą╝ąĄčéą░ą╗ą╗ąŠą▓, čüąŠą┤ąĄčƹȹ░čēąĖčģ ą▓ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą╝ čüą╗ąŠąĄ ą░ą╝ą╝ąŠąĮąĖąĄą▓čŗąĄ ąĖ ą║čĆąĄą╝ąĮąĖą╣ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ: ąÉą▓č鹊čĆąĄčä. ą┤ąĖčü. ŌĆ” ą║ą░ąĮą┤. č鹥čģąĮ. ąĮą░čāą║. ąĪą¤ą▒: ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│čüą║ąĖą╣ ą│ąŠčĆąĮčŗą╣ čāąĮąĖą▓ąĄčĆčüąĖč鹥čé, 2020. 22 čü.
- ąĀąĄą╝ąĘąŠą▓ą░ ąĢ.ąÆ. ąØąĄą╗ąĖąĮąĄą╣ąĮąŠčüčéčī čģąĖą╝ąĖą║ąŠ-čäąĖąĘąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠ-ą╝ąŠą┤ąĖčäąĖčåąĖčĆąŠą▓ą░ąĮąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĖ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮčŗčģ čüąĖčüč鹥ą╝ ąĮą░ ąĖčģ ąŠčüąĮąŠą▓ąĄ: ąÉą▓č鹊čĆąĄčä. ą┤ąĖčü. ŌĆ” ą║ą░ąĮą┤. čģąĖą╝. ąĮą░čāą║. ąÆąŠčĆąŠąĮąĄąČ: ąÆąŠčĆąŠąĮąĄąČčüą║ąĖą╣ ą│ąŠčüčāą┤ą░čĆčüčéą▓ąĄąĮąĮčŗą╣ čāąĮąĖą▓ąĄčĆčüąĖč鹥čé, 2013. 20 čü.
- ąØą░ąĘą░čĆąŠą▓ą░ ąĢ.ąÉ. ąÆą╗ąĖčÅąĮąĖąĄ ą░ą┤čüąŠčĆą▒čåąĖąĖ ą░ą╝ą╝ąŠąĮąĖąĄą▓čŗčģ ąĖ ą║čĆąĄą╝ąĮąĖą╣ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ ąĮą░ čéčĆąĖą▒ąŠčģąĖą╝ąĖč湥čüą║ąĖąĄ čüą▓ąŠą╣čüčéą▓ą░ ą╝ąĄčéą░ą╗ą╗ąŠą▓ (Al, Cu, Ni): ąÉą▓č鹊čĆąĄčä. ą┤ąĖčü. ŌĆ” ą║ą░ąĮą┤. čģąĖą╝. ąĮą░čāą║. ąĪą¤ą▒: ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│čüą║ąĖą╣ ą│ąŠčüčāą┤ą░čĆčüčéą▓ąĄąĮąĮčŗą╣ č鹥čģąĮąŠą╗ąŠą│ąĖč湥čüą║ąĖą╣ ąĖąĮčüčéąĖčéčāčé, 2016. 20 čü.
- ą¤ą░č鹥ąĮčé Ōä¢ 2570599 ąĀąż. ąĪą┐ąŠčüąŠą▒ ą┐ąŠą╗čāč湥ąĮąĖčÅ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠ-ąĮą░ąĮąŠčüčéčĆčāą║čéčāčĆąĖčĆąŠą▓ą░ąĮąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą│ąŠ ą╝ą░č鹥čĆąĖą░ą╗ą░ / ąÉ.ąō.ąĪčŗčĆą║ąŠą▓, ąø.ąÉ.ą»čćą╝ąĄąĮąŠą▓ą░, ąĢ.ąÉ.ąØą░ąĘą░čĆąŠą▓ą░ ąĖ ą┤čĆ. ą×ą┐čāą▒ą╗. 10.12.2015
- ąÉą▒čāąŠą▓ ą£.ąō., ąÜąŠą▓ą│ą░ąĮ ą¤.ąÉ. ąźą╗ąŠčĆąĮą░čÅ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖčÅ ąĖ ą▓ąŠąĘą╝ąŠąČąĮąŠčüčéąĖ čüąĮąĖąČąĄąĮąĖčÅ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖčÅ ąĮą░ ąŠą║čĆčāąČą░čÄčēčāčÄ čüčĆąĄą┤čā // ąŁą║ąŠą╗ąŠą│ąĖčÅ ąĖ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéčī ąĀąŠčüčüąĖąĖ. 2009. Ōä¢ 1. ąĪ. 10-13.
- ąÜąŠą▓ą│ą░ąĮ ą¤.ąÉ., ąÉą▒čāąŠą▓ ą£.ąō., ąĢą┤ąĖą╗čīą▒ą░ąĄą▓ ąÉ.ąś., ąŚą░ą┤ąĖčĆą░ąĮąŠą▓ ąÉ.ąØ. ą¤ąĄčĆčüą┐ąĄą║čéąĖą▓ąĮąŠąĄ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĄ čüąŠą▓čĆąĄą╝ąĄąĮąĮąŠą╣ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖąĖ ŌĆōčģą╗ąŠčĆąĮą░čÅ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖčÅ // ąøąĖčéčīąĄ ąĖ ą╝ąĄčéą░ą╗ą╗čāčĆą│ąĖčÅ. 2009. Ōä¢ 3 (52). ąĪ. 321-324.
- Quiroz Cabascango V.E., Bazhin V.Yu. Combustion optimization in gas burners of reverberatory furnaces during the melting of nickel alloys // International Conference on Complex equipment and quality control laboratories (CEQCL), 14-17 April 2020, Saint Petersburg, Russian Federation. Journal of Physics: Conference Series. 2021. Vol. 1728. Ōä¢ 012019. DOI: 10.1088/1742-6596/1728/1/012019
- ąæčĆąĖčćą║ąĖąĮ ąÆ.ąØ., ąÆąŠčĆąŠą▒čīąĄą▓ ąÉ.ąō., ąæą░ąČąĖąĮ ąÆ.ą«. ą£ąĄčéą░ą╗ą╗čāčĆą│ąĖ ąōąŠčĆąĮąŠą│ąŠ čāąĮąĖą▓ąĄčĆčüąĖč鹥čéą░: čéčĆą░ą┤ąĖčåąĖąĖ ąĮą░ čüą╗čāąČą▒ąĄ ą×č鹥č湥čüčéą▓čā, ąĮą░čāą║ąĄ ąĖ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓čā // ą”ą▓ąĄčéąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ. 2020. Ōä¢ 10. ąĪ. 4-13. DOI: 10.17580/tsm.2020.10.01
- ąæčĆąĖčćą║ąĖąĮ ąÆ.ąØ., ąĪąĖąĘčÅą║ąŠą▓ ąÆ.ą£., ą×ą▒ą╗ąŠą▓ą░ ąś.ąĪ., ążąĄą┤ąŠčüąĄąĄą▓ ąö.ąÆ. ą¤čĆąŠą╝čŗčłą╗ąĄąĮąĮčŗą╣ čüąĖąĮč鹥ąĘ č鹊ąĮą║ąŠą┤ąĖčüą┐ąĄčĆčüąĮąŠą│ąŠ ą│ąĖą┤čĆąŠą║čüąĖą┤ą░ ą░ą╗čÄą╝ąĖąĮąĖčÅ ą┐čĆąĖ ą┐ąĄčĆąĄčĆą░ą▒ąŠčéą║ąĄ ą░ą╗čÄą╝ąĖąĮąĖą╣čüąŠą┤ąĄčƹȹ░čēąĄą│ąŠ čüčŗčĆčīčÅ // ą”ą▓ąĄčéąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ. 2018. Ōä¢ 10. ąĪ. 45-51. DOI: 10.17580/tsm.2018.10.06
- ąĪą╗ąŠą▒ąŠą┤ąŠą▓ ąÉ.ąÉ., ąĀą░ą╗ąĖčü ąĀ.ąÆ., ąŻčüą┐ąĄąĮčüą║ąĖą╣ ąÉ.ąæ. ąĖ ą┤čĆ. ąĀą░ąĘčĆą░ą▒ąŠčéą║ą░ ą║čĆąĖč鹥čĆąĖąĄą▓ ą║ą░č湥čüčéą▓ą░ čüąĖčüč鹥ą╝ ąĖ ą▒ą░ąĘ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ ą┤ą░ąĮąĮčŗčģ ą┤ą╗čÅ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖčÅ ą╝ąĮąŠą│ąŠą║ąŠą╝ą┐ąŠąĮąĄąĮčéąĮčŗčģ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąĖčģ ą┐čĆąĖčĆąŠą┤ąĮčŗčģ ąĖ č鹥čģąĮąŠą╗ąŠą│ąĖč湥čüą║ąĖčģ čüąĖčüč鹥ą╝ // ąśąĘą▓ąĄčüčéąĖčÅ ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│čüą║ąŠą│ąŠ ą│ąŠčüčāą┤ą░čĆčüčéą▓ąĄąĮąĮąŠą│ąŠ č鹥čģąĮąŠą╗ąŠą│ąĖč湥čüą║ąŠą│ąŠ ąĖąĮčüčéąĖčéčāčéą░. 2015. Ōä¢ 31 (57). ąĪ. 8-12.
- Roduit B., Hartmann H., Folly P. et al. Prediction of thermal stability of materials by modified kinetic and model selection approaches based on limited amount of experimental points // Thermochim Acta. 2014. Vol.579. P.31-39. DOI: 10.1016/J.TCA.2014.01.005
- ą¦ąĖčüčéčÅą║ąŠą▓ ąö.ąō., ąōąŠą╗čāą▒ąĄą▓ ąÆ.ą×., ąĪąĖąĘčÅą║ąŠą▓ ąÆ.ą£., ąæčĆąĖčćą║ąĖąĮ ąÆ.ąØ. ąÆą╗ąĖčÅąĮąĖąĄ čüąŠčüčéą░ą▓ą░ čüčŗčĆčīčÅ ąĮą░ ą┐ą░čĆą░ą╝ąĄčéčĆčŗ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ą░ ąÉą× ┬½ąĀąŻąĪąÉąø ąÉčćąĖąĮčüą║┬╗ // ą”ą▓ąĄčéąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ. 2020. Ōä¢ 10. P. 27-34. DOI: 10.17580/tsm.2020.10.04
- Shakhnazarov K.Y. Property Anomalies of Unalloyed Pre-Eutectoid Steel Melts at ~0.5 % C as a Consequence of the Intermediate Fe42C Phase // Steel in translation. 2020. Vol. 50. Iss. 4. P. 261-265.
- Ralys R.V., Uspenskiy A.A., Slobodov A.A. Deriving properties of low-volatile substances from isothermal evaporation curves // Journal of Non-Equilibrium Thermodynamics. 2016. Vol. 41. Iss. 1. P. 3-11. DOI: 10.1515/jnet-2015-0030
- ą£ąŠč鹊ą▓ąĖą╗ąŠą▓ ąś.ą«., ąøčāą│ą░ąĮąŠą▓ ąÆ.ąÉ. ąÆčŗčüąŠą║ąŠč鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗą╣ ą│ąĖą┤čĆąŠą╗ąĖąĘ čģą╗ąŠčĆąĖą┤ą░ ąČąĄą╗ąĄąĘą░ (II) // ąōąŠčĆąĮčŗą╣ ąČčāčĆąĮą░ą╗ ąÜą░ąĘą░čģčüčéą░ąĮą░. 2016. Ōä¢ 1. ąĪ. 41-46.
- Motovilov I.Y., Luganov V.A., Mishra B., Chepushtanova T.A. Oxide powders production from iron chloride // CIS Iron and Steel Review. 2018. Vol. 15. P. 28-32. DOI: 10.17580/cisisr.2018.01.06
- Rotaru A. Discriminating within the kinetic models for heterogeneous processes of materials by employing a combined procedure under TKS-SP 2.0 software // Journal of thermal analysis and calorimetry. 2016.Vol. 126.P. 919-932. DOI: 10.1007/s10973-016-5584-6
- ąÆąĖą│ą┤ąŠčĆąŠą▓ąĖčć ąÆ.ąś., ąÉą╗ąĄą║čüą░čłąĖąĮą░ ąĢ.ąÆ. ąÜąĖąĮąĄčéąĖą║ą░ čĆąĄą░ą╗čīąĮčŗčģ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮčŗčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ąĖ ąĮą░ąĮąŠčüąŠčüč鹊čÅąĮąĖąĄ ą▓ąĄčēąĄčüčéą▓ą░ // ąÆąĄčüčéąĮąĖą║ ąóąōąóąŻ. 2010. ąó. 16. Ōä¢ 3. ąĪ. 664-676.
- Kim S., Suzuki J., Gao X. et al. A Kinetic Model to Simulate the Reaction Between Slag and Matte for the Production
- of Ferromanganese Alloy from Steelmaking Slag // Journal of Sustainable Metallurgy. 2016. Vol. 2. Iss. 2. P. 141-151. DOI: 10.1007/s40831-016-0042-z
- Bogusz A., Masset P. High Temperature Diffusion Processes at the Metal/Slag Interface // Defect and Diffusion Forum. 2012. Vol. 323-325 P. 115-120. DOI: 10.4028/www.scientific.net/DDF.323-325.115
- ąæąŠą╣ąĮąŠą▓ąĖčć ąø.ąæ. ąĪčāą┐ąĄčĆą│ąĖą┤čĆąŠč乊ą▒ąĮčŗąĄ ą┐ąŠą║čĆčŗčéąĖčÅ ŌĆō ąĮąŠą▓čŗą╣ ą║ą╗ą░čüčü ą┐ąŠą╗ąĖčäčāąĮą║čåąĖąŠąĮą░ą╗čīąĮčŗčģ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ // ąÆąĄčüčéąĮąĖą║ ąĀąŠčüčüąĖą╣čüą║ąŠą╣ ą░ą║ą░ą┤ąĄą╝ąĖąĖ ąĮą░čāą║. 2013. ąó. 83. Ōä¢ 1. ąĪ. 10-22. DOI: 10.7868/S0869587313010039
- Schellenberger F., Encinas N., Doris V., Butt H.-J. How Water Advances on Superhydrophobic Surfaces // Physical Review Letters. 2016. Vol. 116. Iss. 9. Ōä¢ 096101. DOI: 10.1103/PhysRevLett.116.096101
- ąöą░ąĮąĖą╗ąŠą▓ąÆ.ą¤., ąÜčāąĘąĮąĄčåąŠą▓ąØ.ąó., ąØąŠą▓ąŠč鹊čĆčåąĄą▓ąÆ.ą£. ąØą░čāčćąĮą░čÅ čłą║ąŠą╗ą░ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░ ąØ.ąĪ.ąÜčāčĆąĮą░ą║ąŠą▓ą░ // ą¢čāčĆąĮą░ą╗ ąĮąĄąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ čģąĖą╝ąĖąĖ. 2014. ąó. 59. Ōä¢ 7. ąĪ. 836-839. DOI: 10.7868/S0044457X14070058
- ąĪčŗčĆą║ąŠą▓ ąÉ.ąō., ą¤čĆąŠą║ąŠą┐čćčāą║ ąØ.ąĀ., ąÆąŠčĆąŠą▒čīąĄą▓ ąÉ.ąō., ąæčĆąĖčćą║ąĖąĮ ąÆ.ąØ. ąÉą║ą░ą┤ąĄą╝ąĖą║ ąØ.ąĪ.ąÜčāčĆąĮą░ą║ąŠą▓ ą║ą░ą║ ąŠčüąĮąŠą▓ąŠą┐ąŠą╗ąŠąČąĮąĖą║ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ ą░ąĮą░ą╗ąĖąĘą░ ŌĆō ąĮą░čāčćąĮąŠą│ąŠ čäčāąĮą┤ą░ą╝ąĄąĮčéą░ ą┤ą╗čÅ čĆą░ąĘčĆą░ą▒ąŠčéą║ąĖ ąĮąŠą▓čŗčģ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čüą┐ą╗ą░ą▓ąŠą▓ ąĖ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ // ą”ą▓ąĄčéąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ. 2021. Ōä¢1. ąĪ. 77-83.
- ą£ąĖčģą░ą╣ą╗ąŠą▓ ąÉ.ąÆ., ą©ą░čģąĮą░ąĘą░čĆąŠą▓ ąÜ.ą«. ą×ą▒ąŠčüąĮąŠą▓ą░ąĮąĖąĄ čüą▓čÅąĘąĖ ą░ąĮąŠą╝ą░ą╗ąĖą╣ čüą▓ąŠą╣čüčéą▓ čüą┐ą╗ą░ą▓ąŠą▓ čü ą║ąŠą╝ą┐ąŠąĮąĄąĮč鹊ą╝-ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąŠą╝, ą░ čéą░ą║ąČąĄ ąŠčüąŠą▒ąĄąĮąĮąŠčüč鹥ą╣ čüč鹥ą║ą╗ąŠąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čü ą┤ąĖą░ą│čĆą░ą╝ą╝ą░ą╝ąĖ čäą░ąĘąŠą▓ąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ // ąĪą▒ąŠčĆąĮąĖą║ ąĮą░čāčćąĮčŗčģ čéčĆčāą┤ąŠą▓ ą£ąĄąČą┤čāąĮą░čĆąŠą┤ąĮąŠą│ąŠ čüąĄą╝ąĖąĮą░čĆą░ ┬½ąØą░ąĮąŠčäąĖąĘąĖą║ą░ ąĖ ąØą░ąĮąŠą╝ą░č鹥čĆąĖą░ą╗čŗ┬╗, 25-26 ąĮąŠčÅą▒čĆčÅ 2020, ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│, ąĀąŠčüčüąĖčÅ. ąĪą¤ą▒: ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│čüą║ąĖą╣ ą│ąŠčĆąĮčŗą╣ čāąĮąĖą▓ąĄčĆčüąĖč鹥čé, 2020. ąĪ. 217-220.
- ą¤ąŠąČąĖą┤ą░ąĄą▓ą░ ąĪ.ąö., ąÉą│ąĄąĄą▓ą░ ąø.ąĪ., ąśą▓ą░ąĮąŠą▓ ąÉ.ą£. ąĪčĆą░ą▓ąĮąĖč鹥ą╗čīąĮą░čÅ čģą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ą░ ąŠą║ąĖčüą╗ąĄąĮąĖčÅ čåąĖąĮą║ą░ ąĖ ąŠą╗ąŠą▓ą░ čü čāčćą░čüčéąĖąĄą╝ ą║ąĖčüą╗ąŠčé ą┐čĆąĖ ą║ąŠą╝ąĮą░čéąĮčŗčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ // ąŚą░ą┐ąĖčüą║ąĖ ąōąŠčĆąĮąŠą│ąŠ ąĖąĮčüčéąĖčéčāčéą░. 2019. ąó. 235. ąĪ. 38-46. DOI: 10.31897/PMI.2019.1.38
- Alexandrova T.N., Romashev A., Potemkin V. Justification of evaluation criteria of gold beneficiation ability by gravitational methods // Journal of Applied Engineering Science. 2020. Vol. 18. Ōä¢ 2. P. 230-237. DOI: 10.5937/jaes18-26076
- ąÜąŠąĮąŠąĮąŠą▓ą░ ąś.ąĢ., ąÜąŠąĮąŠąĮąŠą▓ ą¤.ąÆ., ą£ąŠčłąĮąĖą║ąŠą▓ ąÆ.ąÉ. ąÉč鹊ą╝ąĮąŠ-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ą░čĆčģąĖč鹥ą║č鹊ąĮąĖą║ą░ ą┐ąŠčĆąĖčüčéčŗčģ ą╝ą░č鹥čĆąĖą░ą╗ąŠą▓ ą▓ čāčüą╗ąŠą▓ąĖčÅčģ čüą░ą╝ąŠčüą▒ąŠčĆą║ąĖ ąĘąŠą╗čī-ą│ąĄą╗čī ą┐čĆąŠčåąĄčüčüąŠą▓ // ąĪą▒ąŠčĆąĮąĖą║ ąĮą░čāčćąĮčŗčģ čéčĆčāą┤ąŠą▓ ą£ąĄąČą┤čāąĮą░čĆąŠą┤ąĮąŠą│ąŠ čüąĄą╝ąĖąĮą░čĆą░ ┬½ąØą░ąĮąŠčäąĖąĘąĖą║ą░ ąĖ ąØą░ąĮąŠą╝ą░č鹥čĆąĖą░ą╗čŗ┬╗, 25-26 ąĮąŠčÅą▒čĆčÅ 2020, ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│, ąĀąŠčüčüąĖčÅ. ąĪą¤ą▒: ąĪą░ąĮą║čé-ą¤ąĄč鹥čĆą▒čāčĆą│čüą║ąĖą╣ ą│ąŠčĆąĮčŗą╣ čāąĮąĖą▓ąĄčĆčüąĖč鹥čé, 2020. ąĪ. 170-173.
- Kogan V.E., Shakhparonova T.S. Rational use of science of chemistry as a factor for environmental safety and ensuring ecosystem purity // 17-th International Multidisciplinary Scientific Geoconference SGEM 2017, 29 June ŌĆō 5 July 2017, Albena, Bulgaria. SGEM, 2017. P. 773-780.
- Popova A.N., Sukhomlinov V.S., Mustafaev A.S. Accounting for Interelement Interferences in Atomic Emission Spectroscopy: A Nonlinear Theory // Applied Science. 2021. Vol. 11. Iss. 23. Ōä¢ 11237. DOI: 10.3390/app112311237
