Сорбция координационных соединений редкоземельных элементов
- 1 — д-р техн. наук заведующий кафедрой Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 2 — Ph.D. постдок в области металлургических процессов K1-Met GmbH ▪ Scopus
- 3 — канд. хим. наук ассистент Санкт-Петербургский горный университет ▪ Orcid ▪ Elibrary ▪ Scopus ▪ ResearcherID
- 4 — ассистент Санкт-Петербургский горный университет
Аннотация
Редкоземельные элементы (РЗЭ) являются ценными и стратегически важными для многих технологических областей, таких как лазерная техника, медицина и металлургия. Основными методами выделения РЗЭ являются осаждение, экстракция и сорбция, в частности ионный обмен с использованием различных сорбентов, которые позволяют проводить селективное извлечение и отделение элементов от сопутствующих компонентов, а также проводить разделение близких по своим химическим свойствам редкоземельных металлов. В работе изучен процесс извлечения иттербия в виде координационных соединений с трилоном Б на слабоосновном анионите D-403 из нитратных растворов. Для определения термодинамических параметров сорбции анионных комплексов иттербия ионообменный процесс проводили из модельных растворов при постоянной ионной силе за счет введения NaNO3, оптимальном соотношении масс твердой и жидкой фаз, уровне рН, температурах 298 и 343 К методом переменных концентраций. Описание термодинамического равновесия проводилось с использованием закона действующих масс, записанного для уравнения ионного обмена и математически преобразованного в линейную форму. Рассчитаны значения констант ионообменного равновесия, энергии Гиббса, энтальпии и энтропии сорбционного процесса. На основании рассчитанных значений энергии Гиббса получен сорбционный ряд комплексных ионов РЗЭ с трилоном Б на анионите D-403 из нитратных растворов при температуре 298 К. Получены сорбционные характеристики анионита: полная емкость, предельная сорбция комплексного иона, полная динамическая емкость и динамическая емкость до проскока.
Введение. Редкоземельные металлы являются неотъемлемой частью многих высокотехнологичных отраслевых секторов, таких как лазерная промышленность, военная техника, медицина, электроника, металлургия и автомобилестроение.
В результате анализа рынка добычи редкоземельных металлов (РЗМ) можно сделать вывод, что в 2014-2017 гг. объем добычи РЗМ сохранялся на достаточно стабильном уровне, а с 2018 г. значительно увеличился с 132 до 170 тыс.т [3]. По ресурсам основным лидером в последнее десятилетие остается Китай с долей 37,89 %, за ним следуют Бразилия и Вьетнам с равными долями в 18,94 %. Россия занимает не последнюю позицию в данном списке с долей 10,33 %. Также стоит отметить такие страны как Австралия, США, Малайзия и Индия, в которых также оцениваются запасы РЗМ [3].
В настоящее время Россия является не производителем редкоземельных элементов (РЗЭ), а импортером, что отрицательно влияет на экономику страны и производственный сектор в частности
Основной целевой источник РЗЭ в России расположен в Мурманской области на Ловозерском месторождении. Также имеется попутная добыча РЗМ в виде компонента других руд и из отходов производств [6, 15, 16]. Однако в РФ отсутствуют производства по глубокой переработке, что делает невозможным получение конечной продукции в виде индивидуальных РЗМ. В связи с этим добываемые РЗМ экспортируются в виде дешевых коллективных концентратов.
Основными способами получения РЗЭ являются осаждение, экстракция и сорбция [5, 8, 12, 13, 18]. Сорбционные процессы – наиболее перспективный метод селективного извлечения РЗМ из растворов сложносолевого состава, который позволяет проводить отделение элементов от сопутствующих компонентов, а также проводить разделение близких по химическим свойствам РЗМ [10].
Авторами работы [7] изучено извлечение Nd, Gd и Ho на синтезируемых смолах, имеющих функциональную группу в виде первичных аминогрупп (primary amine surface groups) с лигандами, имеющими сродство к РЗМ: фосфоноуксусная кислота (PAA), N,N-бис (фосфонометил), глицин (BPG) и диэтилентриаминпентауксусный диангидрид (DTPADA). Для определения термодинамических характеристик проводили серию экспериментов с растворами, содержащими 0,3-300 мг/л РЗЭ при постоянной концентрации HCl 0,5 моль/л и фиксированном значении рН. Растворы перемешивали при 300 об/мин в течении 24 ч с ионообменной смолой 10 г/л при трех значениях температуры: 20, 60 и 100 °С. Изотермы сорбции получали при постоянном присутствии NaCl 0,5 моль/л и фиксированных значениях рН в зависимости от синтезируемого анионита: 6,5 – для амина, PAA, BPG или 2,5 – для DTPADA при температурах 20, 60 и 100 °С. Термодинамическое описание проводилось моделями Ленгмюра и Фрейндлиха. В результате авторами были рассчитаны значения констант равновесия, энергии Гиббса, энтальпии и энтропии процесса извлечения Nd, Gd и Ho.
В работе [14] изучалось разделение металлов на основе ионообменного вытеснения ионов металлов (Se, Re, Mo, La, Sc, Ce (IV)) из твердой фазы на ионообменных смолах Purolite A170, Lewatit M500 и Lewatit SP112. Эффективное разделение церия (IV) и лантана наблюдалось на Lewatit MonoPlus SP 112 (Na+). Насыщение ионита проводилось в динамических условиях раствором нитрата лантана. Далее проводилось элюирование раствором нитрата церия (IV). В ходе эксперимента было отмечено, что церий (IV) вытеснил лантан из твердой фазы смолы на 96-97 %. Процесс фронтально-градиентного вытеснения лантана церием (IV) является частью разработанной технологии. Общий коэффициент разделения церия и лантана с использованием разработанного метода разделения составил 4300. Коэффициенты распределения для церия и лантана составляли 1000 и 0,23 соответственно. Данный метод позволяет получать церий (IV) с чистотой 99,99 %.
Также для извлечения таких металлов как торий (IV) и уран (IV) в работе [17] применялись твердые сорбенты с матрицей смолы в виде мономера 2, 4, 6-триформилфлороглюцин и 2,5-диаминобензолсульфоновая кислота (COF) и функциональными группами COF-SO3H и \(\mathrm{[NH_4]^+[COF-SO_3^-]}\). В работе оценивали влияние рН на сорбционную емкость тория (IV) в интервале 1-2,8. Сделан вывод, что для сорбента \(\mathrm{[NH_4]^+[COF-SO_3^-]}\) при увеличении рН значение емкости увеличилось с 98,8 (рН = 1) до 168 мг/г (рН = 2,8). Похожая тенденция наблюдалась и для сорбента COF-SO3H, однако при понижении рН наблюдается уменьшение значения емкости. При исследовании кинетических зависимостей отмечено, что при проведении процесса в течение 10 мин. значение емкости достигло величины 232 мг/г из раствора с концентрацией тория (IV) 125 ppm при рН = 2,8 на сорбенте \(\mathrm{[NH_4]^+[COF-SO_3^-]}\) и 100 мг/г на сорбенте COF-SO3H. Изотермы сорбции, полученные в интервале концентраций 50-400 ppm, были проанализированы с использованием модели Ленгмюра. Полученное значение емкости для сорбента \(\mathrm{[NH_4]^+[COF-SO_3^-]}\) выше, чем для сорбента COF-SO3H. Авторами было проведено разделение тория (IV), урана (IV), церия (III) и европия (III) и получены следующие коэффициенты разделения элементов: STh/U = 9,4, STh/Eu = 9,4 и STh/Ce = 10,3.
Постановка проблемы. Анализируя содержание литературных источников, можно сделать вывод, что извлечение РЗМ из сложносолевых систем [11] в силу комплексного характера редкоземельных источников является актуальным. Значения полученных термодинамических характеристик процесса сорбции, в частности ионного обмена, определяют как условия проведения процесса, так и технологические параметры ионообменных установок для разделения РЗЭ и отделения их от примесных компонентов. На основании величин энергии Гиббса ионообменного процесса возможен прогноз эффективности извлечения лантаноидов из водно-солевых растворов. Учитывая, что извлечение РЗЭ, как правило, проводят из растворов минеральных неорганических кислот, используемых в качестве растворов выщелачивания фосфогипса или иного сырья, содержащего РЗМ, в работе изучено извлечение иттербия в виде анионных комплексов с трилоном Б на слабоосновном анионите D-403 из растворов азотной кислоты.
Методология эксперимента. Исследование сорбции в статических условиях. Исследование процесса сорбции РЗЭ проводилось из модельных растворов, содержащих анионные комплексы иттербия с трилоном Б (ЭДТАиттербиат-ионов), полученных добавлением раствора трилона Б к раствору нитрата иттербия в точном мольном соотношении 1:1 по стехиометрии реакции [9].
В работе [14] изучалось разделение металлов на основе ионообменного вытеснения ионов металлов (Se, Re, Mo, La, Sc, Ce (IV)) из твердой фазы на ионообменных смолах Purolite A170, Lewatit M500 и Lewatit SP112. Эффективное разделение церия(IV) и лантана наблюдалось на Lewatit MonoPlus SP 112 (Na+). Насыщение ионита проводилось в динамических условиях растворомнитрата лантана. Далее проводилось элюирование раствором нитрата церия (IV). В ходе экспе-римента было отмечено, что церий(IV) вытеснил лантан из твердой фазы смолы на 96-97%. Процесс фронтально-градиентного вытеснения лантана церием (IV) является частью разработан-ной технологии. Общий коэффициент разделения церия и лантана с использованием разработанного метода разделения составил 4300. Коэффициенты распределения для церия и лантана составляли1000 и 0,23 соответственно. Данный метод позволяет получать церий (IV) с чистотой 99,99%.
Применялся метод переменных концентраций при соотношении ж:т = 5 (раствора – 20, анионита – 4 см3), рН = 3 и постоянной ионной силе I, равной 1 моль/кг (NaNO3). Сорбцию проводили при температурах T, равных 298 и 343 К в интервале концентраций иттербия 0,1082-0,0056 моль/кг.
В качестве ионообменной смолы применялся анионит D-403 в нитратной форме (Китай), являющийся полистирольным хелатным анионитом с дивинилбензолстирольной матрицей и функциональной группой в виде третичного атома азота с оксигидрильными группами в β, γ, δ положениях, снижающими подвижность неподеленной пары электронов азота вследствие отрицательного индуктивного эффекта [9]:
Раствор с анионитом перемешивали со скоростью 120 об/мин в термостатированном шкафу GFL (Германия) в течение 5-6 ч до наступления равновесия. Концентрацию иттербия в исходных и равновесных растворах определяли спектрофотометрическим методом с арсеназо (III) и рентгенофлуорисцентным методом на приборе Epsilon 3 производства PANalytical.
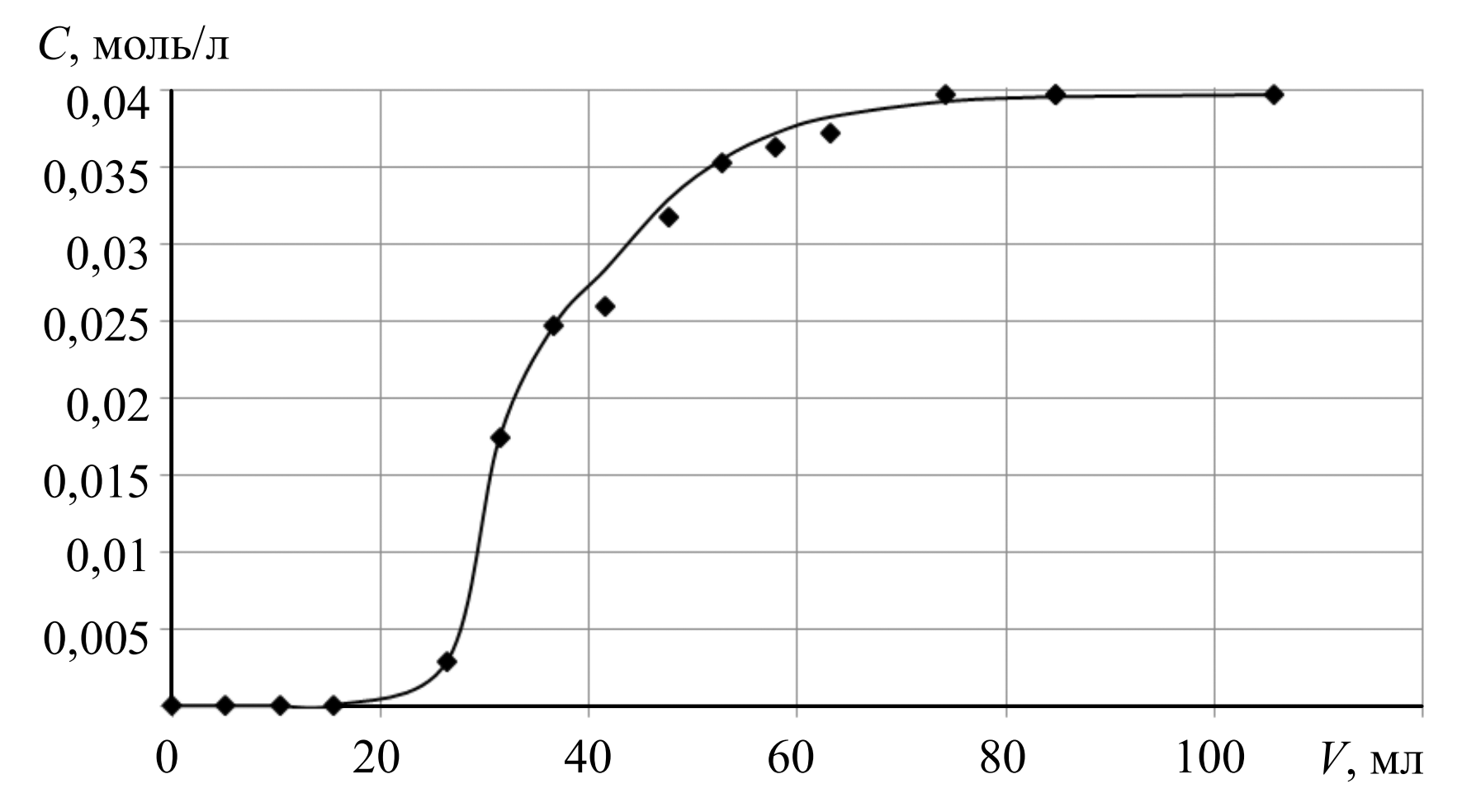
Исследование сорбции в динамических условиях. Для подтверждения значения предельной сорбции проводилось насыщение анионита D-403 ЭДТАиттербиат-ионами в динамических условиях. Эксперимент осуществлялся в сорбционной колонке диаметром 1,2 и высотой слоя анионита 31,5 см, масса анионита составляла 11,3 г. Раствор, содержащий ЭДТАиттербиат-ионы концентрацией 0,0398 моль/л, пропускали через колонку со скоростью 1 мл/мин с использованием перистальтического насоса LOIP LS-301 (АО «Лабораторное оборудование и приборы», Россия). На выходе из колонки отбирали порции раствора по 5 до проскока и 10 мл после проскока до достижения значения исходной концентрации.
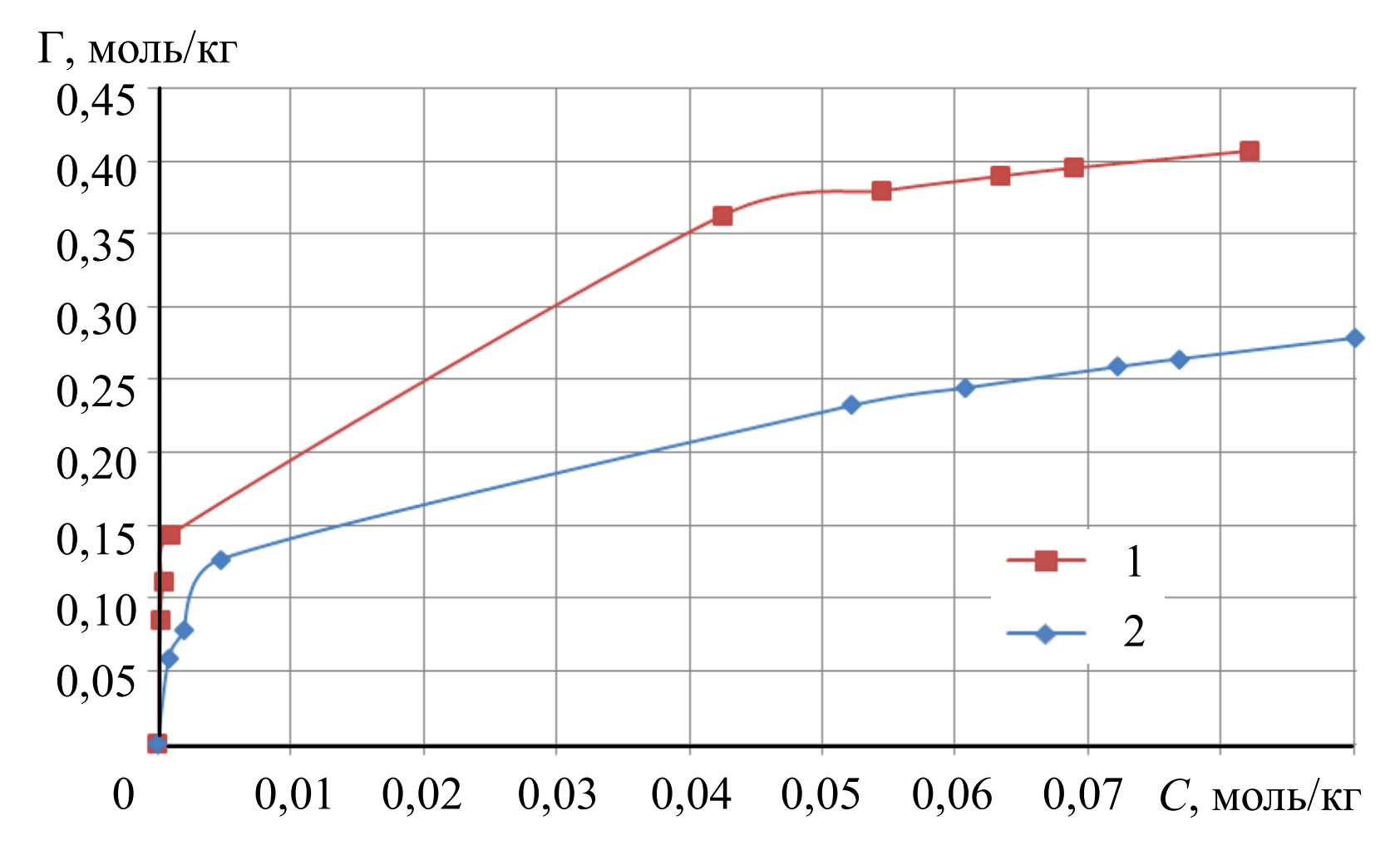
Результаты эксперимента. Расчет константы ионообменного равновесия, энергии Гиббса ионного обмена и полной емкости анионита. Полученные данные процесса сорбции при температурах 298 и 343 К представлены в табл.1. Значение сорбции рассчитывали по формуле
где \(C\)0 и \(C\)∞ – исходные и равновесные концентрации комплексных ионов в растворе, моль/кг; \(V\) – объем, мл; m – масса сухого анионита, г.
Таблица 1
Экспериментальные данные сорбции ЭДТАиттербиат-ионов на анионите D-403 в нитратной форме при рН = 3
| 298 К | 343 К | ||||
| C0, моль/кг | С∞, моль/кг | Г, моль/кг | C0, моль/кг | С∞, моль/кг | Г, моль/кг |
| 0,1082 | 0,0901 | 0,2786 | 0,1082 | 0,0822 | 0,4066 |
| 0,0947 | 0,0768 | 0,2642 | 0,0947 | 0,0690 | 0,3950 |
| 0,0863 | 0,0722 | 0,2587 | 0,0863 | 0,0634 | 0,3893 |
| 0,0749 | 0,0607 | 0,2442 | 0,0749 | 0,0544 | 0,3791 |
| 0,0678 | 0,0522 | 0,2322 | 0,0678 | 0,0425 | 0,3624 |
| 0,0525 | 0,0392 | 0,2111 | 0,0525 | 0,0302 | 0,3392 |
| 0,0433 | 0,0303 | 0,1936 | 0,0433 | 0,0225 | 0,3195 |
| 0,0311 | 0,0204 | 0,1697 | 0,0311 | 0,0131 | 0,2838 |
| 0,0173 | 0,0094 | 0,1311 | 0,0173 | 0,0040 | 0,2120 |
| 0,0110 | 0,0048 | 0,1267 | 0,0110 | 0,0010 | 0,1784 |
| 0,0079 | 0,0020 | 0,0778 | 0,0079 | 0,0004 | 0,1110 |
| 0,0056 | 0,0009 | 0,0590 | 0,0056 | 0,0002 | 0,0853 |
Изотермы сорбции приведены на рис.1.
Для получения термодинамических данных проводилось математическое преобразование закона действующих масс
используемого для уравнения ионного обмена
где \(K\) – константа ионообменного равновесия; и \(\Large{\mathrm{\Gamma_{YbTr^–}}}\), \(\Large{\mathrm{\Gamma_{{NO^3}^{–}}}}\) – значение концентрации ионов в твердой фазе анионита,моль/кг; \(\Large{\mathrm{a_{{NO^3}^{–}}}}\), \(\Large{\mathrm{{a_{YbTr^-}}}}\) – активности нитрат- и ЭДТАиттербиат-ионов, моль/кг; \(\mathrm{[NO{_3^-}]}\), \(\mathrm{[YbTr^-]}\) – активности нитрат- и ЭДТАиттербиат-ионов, моль/кг; \(\Large{\mathrm{\gamma_{[NO{_3^-}]}}}\), \(\Large{\mathrm{\gamma_{[YbTr{_3^-}]}}}\) – коэффициенты активности нитрат- и ЭДТАиттербиат-ионов; \(R\) – органическая матрица ионитов.
Считая, что предельная сорбция складывается из величин равновесной сорбции нитрат- и ЭДТАиттербиатионов:
закон действующих масс привели к линейному виду, аналогичному изотерме сорбции Ленгмюра
где \(\Large{f(C)=\frac{\mathrm{[NO{_3^-}]}\gamma{_{\pm\mathrm{NaNO_3}}^2}}{[\mathrm{YbTr^-}]\gamma{_{\pm\mathrm{NaYbTr}}^2}}}\) – концентрационная абсцисса; \(\Large{\frac{1}{\Gamma_{\mathrm{YbTr^-}}}}\) – ордината обратной сорбции; \(\Large{\gamma{_{\pm}}}\) – среднеионные коэффициенты активности электролитов, выраженные через коэффициенты активности индивидуальных ионов:
Среднеионные коэффициенты активности рассчитывали с использованием справочных данных и математического описания зависимостей коэффициентов активности от ионной силы раствора. Для соединения \(\mathrm{NaYbTr}\ \gamma\pm\) принимали равными для CH3COONa при данной ионной силе из-за основной зависимости коэффициентов активности от заряда ионов и ионной силы раствора, а также слабой зависимости от индивидуальной природы аниона, в том числе комплексного иона. Известно, что комплексные ионы не проявляют каких-либо особенностей в поведении коэффициентов активности по сравнению с простыми электролитами [4].
С учетом влияния температуры коэффициенты активности пересчитывали по формуле
где γ±,343 и γ±,298 – значение среднеионных коэффициентов активности при соответствующих температурах; A343 и А298 – коэффициенты уравнения Дебая – Хюккеля для температур 343 и 298 К, соответственно (А343 = 0,5562, А298 = 0,5107 [1]).
Расчетные и полученные экспериментальные данные для математического описания линейных форм изотерм сорбции иттербия на анионите D-403 из нитратных растворов при температурах 298 и 343 К представлены в табл.2.
Таблица 2
Данные для построения линейных форм изотерм сорбции ЭДТАиттербиат-ионов на анионите
| 1/Г, кг/моль | I, моль/кг | \(\mathrm{[NO{_3^-}]}\), моль/кг | \(\mathrm{[YbTr^-]}\), моль/кг | γ±NaYbTr | γ±NaNO3 | \(f(C)\) |
| 298 К | ||||||
| 3,5890 | 1,1082 | 1,3328 | 0,0901 | 0,7677 | 0,5183 | 6,7415 |
| 3,7856 | 1,0947 | 1,2923 | 0,0768 | 0,7670 | 0,5214 | 7,7740 |
| 3,8652 | 1,0863 | 1,2654 | 0,0722 | 0,7666 | 0,5234 | 8,1758 |
| 4,0942 | 1,0749 | 1,2312 | 0,0607 | 0,7660 | 0,5261 | 9,5645 |
| 4,3064 | 1,0678 | 1,2105 | 0,0522 | 0,7656 | 0,5278 | 11,0200 |
| 7,8927 | 1,0110 | 1,0358 | 0,0048 | 0,7628 | 0,5431 | 110,3377 |
| 12,8593 | 1,0079 | 1,0262 | 0,0020 | 0,7627 | 0,5440 | 262,7363 |
| 343 К | ||||||
| 2,4594 | 1,1082 | 1,3520 | 0,0822 | 0,7474 | 0,4880 | 7,014542 |
| 2,5318 | 1,0947 | 1,3111 | 0,0690 | 0,7462 | 0,4912 | 8,23391 |
| 2,5689 | 1,0863 | 1,2831 | 0,0634 | 0,7455 | 0,4935 | 8,871151 |
| 2,6380 | 1,0749 | 1,2463 | 0,0544 | 0,7446 | 0,4965 | 10,1794 |
| 2,7592 | 1,0678 | 1,2299 | 0,0425 | 0,7440 | 0,4979 | 12,95437 |
| 2,9477 | 1,0525 | 1,1810 | 0,0302 | 0,7427 | 0,5021 | 17,89694 |
| 5,6054 | 1,0110 | 1,0434 | 0,0010 | 0,7393 | 0,5150 | 495,4003 |
| 9,0053 | 1,0079 | 1,0313 | 0,0004 | 0,7391 | 0,5162 | 1125,44 |
Линейные формы изотерм сорбции представлены на рис.2
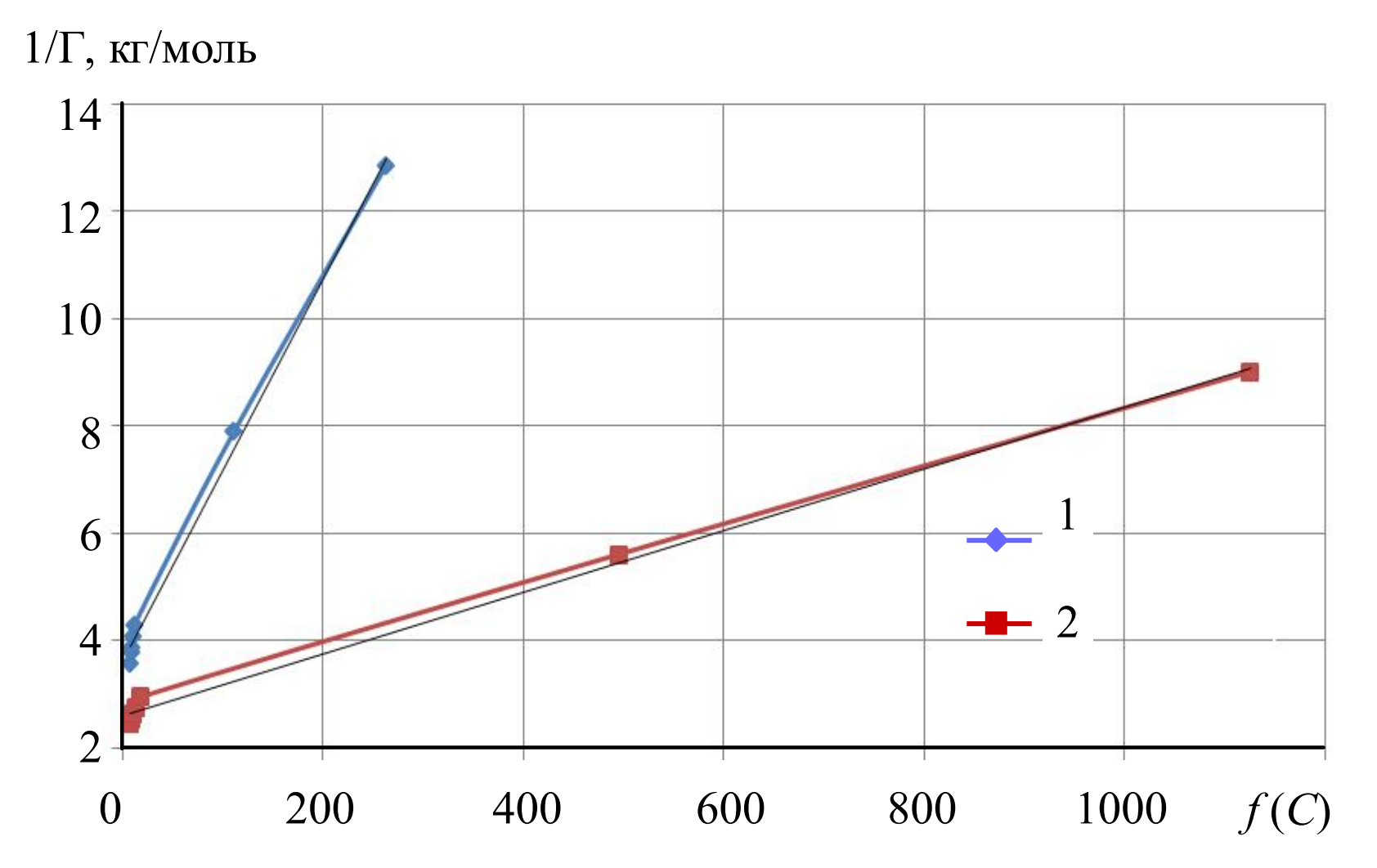
По уравнениям аппроксимации линейных форм (рис.2) рассчитали значения констант ионообменного процесса, энергии Гиббса, полной емкости анионита, а также предельной сорбции комплексного ЭДТАиттербиат-иона (рис.3).
Термодинамические и сорбционные характеристики:
| Т, К | Уравнение аппроксимации | Коэффициент корреляции R 2 | K | \({\Delta_r{G{_T^0}}}\), кДж/моль | Г∞, моль/кг | \(Г_{YbTr^-}\), моль/кг |
| 298 | y = 0,0355x + 3,6573 | 0,9956 | 103,02 ± 5,15 | –11,48 ± 5,74 | 0,27 ± 0,01 | 0,28 ± 0,01 |
| 343 | y = 0,0058x + 2,6024 | 0,9961 | 448,69 ± 22,43 | –17,42 ± 8,71 | 0,38 ± 0,02 | 0,41 ± 0,02 |
Расчет значений энтальпии и энтропии сорбции. По полученным значениям констант ионообменного равновесия в интервале температур 298-343 К рассчитали значение энтальпии ионного обмена по уравнению изобары
где Т1 и Т2 – температуры проведения процесса сорбции, К1 и К2 – константы ионообменного равновесия при соответствующих температурах и значение энтропии ионного обмена
Получены значения:
Расчет полной динамической обменной емкости (ПДОЕ) и динамической обменной емкости (ДОЕ). Значение предельной сорбции комплексного иона в статических условиях при 298 К согласно результатам, представленным на рис.2, составило 0,279 ± 0,014 моль/кг. Кривая сорбции в динамических условиях представлена на рис.3.
Значения ПДОЕ и ДОЕ рассчитываются по формулам:
где m – масса сорбента, г; С0 и Сn – исходная и текущая концентрации иттербия на выходе из колонки, мг/мл; Vn+1, Vn – объем раствора, соответствующий концентрации иттербия на выходе из колонки Сn+1 и Сn, мл; Спр – объем раствора до проскока.
ПДОЕ и ДОЕ составили 0,12 ± 0,01 и 0,09 ± 0,01 моль/кг соответственно.
Обсуждение экспериментальных результатов. Согласно полученным значениям энергии Гиббса ионообменного процесса при температуре 298 К ЭДТАиттербиат-ионы имеют большее химическое сродство к твердой фазе ионообменной смолы по сравнению с РЗЭ легкой группы:
| ЭДТАРЗМ-ион | [CeTr]– | [YTr]– | [ErTr]– | [YbTr]– |
| \({\Delta_rG_{298}^{0}}\), кДж/моль | 0,15±0,01 | 4,82±0,15 | 9,24±4,62 | 11,48±5,74 |
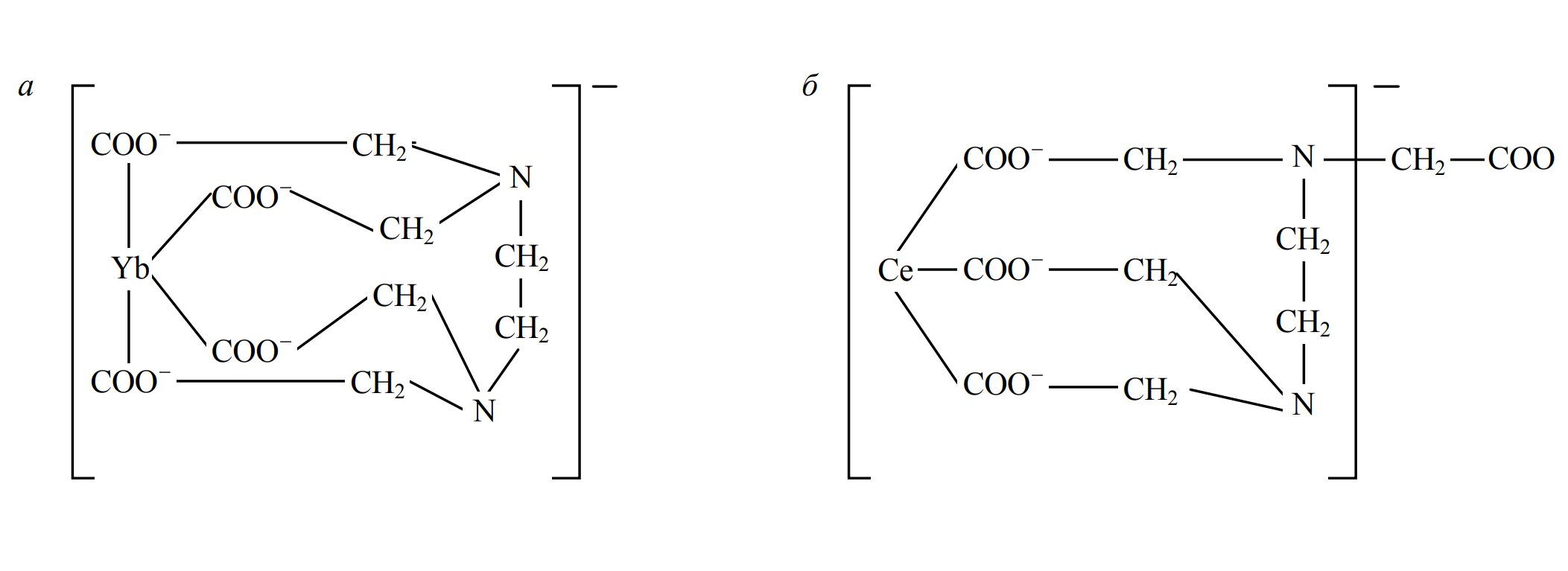
Это обусловлено специфической особенностью координации лиганда относительно иона РЗЭ легкой и тяжелой групп [2]. Внутренняя сфера комплексов [YbTr]–, [ErTr]– образуется из двух атомов азота и четырех карбоксильных групп, в то время как комплексы [CeTr]– и [YTr]– содержат по два атома азота и только три карбоксильные группы (рис.4). Повышение эффективного отрицательного заряда комплексного иона эрбия и иттербия приводит к увеличению электростатических взаимодействий с матрицей ионообменной смолы. И, как следствие, с уменьшением атомного радиуса и увеличением эффективного заряда комплекса возрастает химическое сродство к твердой фазе анионообменной смолы.
Уменьшение энергии Гиббса в ряду церий-эрбий-иттербий коррелирует с лантаноидным сжатием, уменьшением атомного радиуса и увеличением эффективного заряда комплекса, что приводит к большему сродству и усилению электростатических взаимодействий с анионитом и повышению селективности.
Значение предельной сорбции комплексного иона совпало со значениями полной емкости анионита при обеих температурах. С увеличением температуры величина сорбции увеличивается в соответствии со смещением равновесия в сторону вытеснения нитрат-ионов из матрицы ионообменной смолы ЭДТАиттербиат-ионами.
Величина энтальпии составила положительное значение, однако определяющим фактором понижения энергии Гиббса \({\Delta{G_{T}^{0}}}\lt0\) процесса ионного обмена с ростом температуры является энтропийный критерий. Полученные термодинамические данные характеризуют избирательность процесса ионного обмена ЭДТАиттербиат-ионов в ряду РЗЭ на \(\mathrm{{NO_{3}^{-}}}\) с поверхности ионита. Недостижение значения сорбции комплексного иона величины предельной сорбции объясняется большим геометрическим размером ЭДТАиттербиат-иона.
Заключение. В работе изучен процесс сорбции иттербия в виде анионных комплексов с трилоном Б из нитратных растворов при постоянной ионной силе, равной 1 моль/кг, рН = 3, ж:т = 5 и температурах 298 и 343 К на слабоосновном анионите D-403.
Получены значения предельной сорбции комплексного ЭДТАиттербиат-иона, равные 0,28 ± 0,01 при температуре 298 и 0,41 ± 0,02 моль/кг при 343 К в статических условиях, а также ПДОЕ 0,12 ± 0,01 и ДОЕ 0,09 ± 0,01 моль/кг в динамических условиях.
Рассчитаны значения полной емкости анионита при температурах 298 и 343 К: Г∞ = 0,27 ± 0,01 и Г∞ = 0,38 ± 0,02 моль/кг соответственно.
Проведено математическое преобразование закона действующих масс, приведенного к линейной форме, аналогичной уравнению Ленгмюра, графическое решение которого позволило рассчитать термодинамические параметры ионообменного процесса.
Значения констант ионообменного равновесия и энергии Гиббса ионного обмена при температурах 298 и 343 К составили K298 = 103,02 ± 5,15; \(\Delta_r{G_{298}^{0}}\) = 11,45 кДж/моль; K343 = 448,69±22,43 и \(\Delta_r{G_{343}^{0}}\) = –17,42±8,71 кДж/моль.
По значениям энергий Гиббса рассчитали энтальпию и энтропии процесса ионного обмена: \(\Delta{G_{T_{2}-T_{1}}^{0}}\) = 13,88±6,94 кДж/моль, \(\Delta{S_{298}^{0}}\) = 85,08±4,25, \(\Delta{S_{343}^{0}}\) = 91,23±4,56 Дж/моль∙К. Полученные термодинамические данные характеризуют эффективность использования анионообменной смолы D-403 для извлечения РЗЭ и разделения на индивидуальные компоненты.
Литература
- Vasilev V.P. Thermodynamic Properties of Electrolyte Solutions. Мoscow: Vysshaya shkola, 1982, p. 320 (in Russian).
- Martynenko L.I. Specifics of Rare Earth Elements (III) Complex Formation. Uspekhi khimii. 1991. Vol. 60. Iss. 9. p. 1969-1998 (in Russian).
- Global Market of Rare Earth Metals and Compounds 2019-2025 (9th edition): Analytical Study; Research Group Specializing on the Markets of Raw Materials, Metals and Associated Products. International Metallurgical Research Group. 2019, p. 104. URL: https://docplayer.ru/134894766-Mirovoy-rynok-redkozemelnyh-metallov-i-soedineniy-9-izdanie.html (date of access 27.01.2020) (in Russian).
- Mironov I.V. Environmental Effect and Complex Formation in Electrolyte Solutions. Novosibirsk: INKh SO RAN, 2003, p. 240 (in Russian).
- Ivanik S.A., Ilyukhin D.A. Flotation extraction of elemental sulfur from gold-bearing cakes. Journal of Mining Institute. 2020. Vol. 242, p. 202-208. DOI: 10.31897/PMI.2020.2.202
- Sizyakov V.M., Litvinova T.E., Brichkin V.N., Fedorov A.T. Modern physicochemical equilibrium description
- in Na2O–Al2O3–H2O system and its analogues. Journal of Mining Institute. 2019. Vol. 237, p. 298-306. DOI: 10.31897/PMI.2019.3.298
- Callura J.C., Perkins K.M., Baltrus J.P., Washburn N.R., Dzombak D.A., Karamalidis A.K. Adsorption kinetics, thermodynamics, and isotherm studies for functionalized lanthanide-chelating resins. Journal of Colloid and Interface Science. 2019. Vol. 557, p. 465-477. DOI: 10.1016/j.jcis.2019.08.097
- Cui H., Feng X., Sh J., Liu W., Yan N., Rao G., Wang W. A facile process for enhanced rare earth elements separation from dilute solutions using N, N-di(2-ethylhexyl)-diglycolamide grafted polymer resin. Separation and Purification Technology. 2020. Vol. 234. 116096. DOI: 10.1016/j.seppur.2019.116096
- Cheremisina O.V., Ponomareva M.A., Sagdiev V.N. Thermodynamic Characteristics of Sorption Extraction and Chromatographic Separation of Anionic Complexes of Erbium and Cerium with Trilon B on Weakly Basic Anionite. Russian Journal of Physical Chemistry A. 2016. Vol. 90 (3), p. 664-670. DOI: 10.1134/S0036024416030079
- Manousi N., Gomez-Gomez B., Madrid Y., Deliyanni E.A., Zachariadis G.A. Determination of rare earth elements by inductively coupled plasma-mass spectrometry after dispersive solid phase extraction with novel oxidized graphene oxide and optimization with response surface methodology and central composite design. Microchemical Journal. 2020. Vol. 152. 104428. DOI: 10.1016/j.microc.2019.104428
- Batchu N.K., Dewulf B., Riaño S., Binnemans K. Development of a solvometallurgical process for the separation of yttrium and europium by Cyanex 923 from ethylene glycol solutions. Separation and Purification Technology. 2020. Vol. 235. 116193. DOI: 10.1016/j.seppur.2019.116193
- Turanov A.N., Karandashev V.K., Baulin V.E., Baulin D.V., Khvostikov V.A. Extraction of Rare-Earth Elements (III) from Nitric Acid Solutions with Diethyl 2-[(Diphenylphosphoryl)methoxy]-5-ethylphenylphosphonate. Russian Journal of Inorganic Chemistry. 2019. Vol. 64(10), p. 1297-1303. DOI: 10.1134/S0036023619100164
- Maria L., Cruz A., Carretas J.M., Monteiro B., Galinha C., Gomes S.S., Araújo M.F., Paiva I., Marçalo J., Leal J.P. Improving the selective extraction of lanthanides by using functionalised ionic liquid. Separation and Purification Technology. 2020. Vol. 237. 116354. DOI: 10.1016/j.seppur.2019.116354
- Gedgagov E.I., Zakharyan S.V., Sinyanskaya O.M., Zakharyan D.V. Removal of Impurities from Saturated Ion-Exchange Resins by Frontal-Gradient Purification in Schemes for Recovery of Nonferrous, Rare, and Rare Earth Metals. Theoretical Foundations of Chemical Engineering. 2018. Vol. 52 (5), p. 920-927. DOI: 10.1134/S0040579518050111
- Kuskov V.B., Kuskova Y.V. Research of physical and mechanical properties of briquettes, concentrated from loose high-grade iron ores. 17th International Multidisciplinary Scientific GeoConference SGEM 2017, 29 June – 5 July 2017. Vol. 17. Iss. 11, p. 1011-1016. DOI: 10.5593/sgem2017/11/S04.129
- Bailey G., Joyce P.J., Schrijvers D., Schulze R., Sylvestre A.M., Sprecher B., Vahidi E., Dewulf W., Van Acker K. Review and new life cycle assessment for rare earth production from bastnäsite, ion adsorption clays and lateritic monazite. Resources, Conservation and Recycling. 2020. Vol. 155. 104675. DOI: 10.1016/j.resconrec.2019.104675
- Xiong X.H., Tao Y., Yu Z.W., Yan L.X., Sun L.J., Fan Y.L., Luo F. Selective extraction of thorium from uranium and rare earth elements using sulfonated covalent organic framework and its membrane derivate. Chemical Engineering Journal. 2020. Vol. 384. 123240. DOI: 10.1016/j.cej.2019.123240
- Swain N., Mishra S., Acharya M.R. Hydrometallurgical route for recovery and separation of samarium (III) and cobalt (II) from simulated waste solution using tri-n-octyl phosphine oxide – A novel pathway for synthesis of samarium and cobalt oxides nanoparticles. Journal of Alloys and Compounds. 2020. Vol. 815. 152423. DOI: 10.1016/j.jallcom.2019.152423