Изотерма и кинетическая адсорбция частиц рисовой шелухи как модельного адсорбента для решения проблем устойчивой добычи золота в результате выщелачивания ртути
- 1 — д-р техн. наук профессор Университет Пендидикан Индонезии ▪ Orcid
- 2 — док. наук научный сотрудник Центр исследований в области экологии и чистых технологий, Национальное агентство по исследованиям и инновациям ▪ Orcid
- 3 — научный сотрудник Университет Пендидикан Индонезии ▪ Orcid
- 4 — научный сотрудник Университет Пендидикан Индонезии ▪ Orcid
- 5 — научный сотрудник Университет Пендидикан Индонезии ▪ Orcid
- 6 — научный сотрудник Центр исследований в области экологии и чистых технологий, Национальное агентство по исследованиям и инновациям ▪ Orcid
- 7 — научный сотрудник Центр исследований в области экологии и чистых технологий, Национальное агентство по исследованиям и инновациям ▪ Orcid
Аннотация
Одним из методов извлечения золота в кустарной и мелкомасштабной золотодобыче является ртутная амальгамация. Однако использование ртути представляет серьезную опасность для здоровья и окружающей среды и не позволяет добиться оптимальной эффективности извлечения золота. В данной работе представлена возможность использования рисовой шелухи в качестве прототипа адсорбента для удаления ртути при ее выщелачивании в условиях горно-добывающей промышленности. Для обоснования проведенного анализа рисовая шелуха была исследована методами ИК-спектроскопии с Фурье-преобразованием, сканирующей электронной микроскопии, электронно-дисперсионной рентгеновской спектроскопии и анализа Брунауэра – Эммета – Теллера. Для изучения процесса удаления Hg из водных растворов были проведены серийные адсорбционные эксперименты, эффективность которых оптимизировалась по различным параметрам: время контакта, дозировка рисовой шелухи и начальная концентрация ртути. Также были проведены кинетические и изотермические исследования. Кинетическая адсорбция анализировалась с использованием псевдопервого и псевдовторого порядков. Кроме того, изотермы адсорбции анализировались с использованием десяти моделей изотерм адсорбции (Ленгмюра, Фрейндлиха, Темкина, Дубинина – Радушкевича, Флори – Хаггинса, Фаулера – Гуггенхайма, Хилла – де Бура, Йовановича, Харкина – Джура и Халси). Количество поглощенной ртути увеличивалось с ростом времени контакта, массы адсорбента и начальной концентрации ртути. Кинетическая модель псевдовторого порядка оказалась наилучшей моделью для описания процесса адсорбции. Анализ полученных результатов показывает, что адсорбция объясняется образованием монослоя без латерального взаимодействия между адсорбатом и адсорбентом. Кроме того, за счет неоднородного распределения пор происходит образование мультислоев, что обусловливает механизм заполнения пор. Обнаружено, что изотермы близки к моделям Йовановича, а максимальная адсорбционная емкость рисовой шелухи составила 107,299 мг/г. Таким образом, рисовая шелуха может стать перспективным вариантом для очистки сточных вод благодаря быстрой и эффективной удаляющей способности, а также доступности и экологичности. Прогнозные термодинамические исследования с использованием модели изотерм Флори – Хаггинса показывают, что процесс адсорбции является эндотермическим, самопроизвольным и протекает с участием физорбции. Результаты исследования показывают, что при использовании рисовой шелухи в качестве адсорбента происходит утилизация сельскохозяйственных отходов, таким образом решается актуальная задача утилизации в рамках Целей устойчивого развития ООН.
Введение
Добыча золота на территории Индонезии ведется уже сотни лет, и в настоящее время она переживает бурный рост. Индонезия входит в десятку крупнейших мировых производителей золота (www.ceicdata.com; www.gold.org). Основная проблема заключается в том, что в стране действует множество предприятий кустарной и мелкомасштабной добычи золота (КМДЗ) и производственных объектов. КМДЗ определяется Министерством охраны окружающей среды и лесного хозяйства как добыча золота, осуществляемая индивидуальными старателями или маленькими фирмами с небольшими капиталом и объемом производства. В Индонезии существует два вида предприятий КМДЗ – лицензируемые и нелицензируемые. Большинство видов КМДЗ продолжают вестись нелегально без государственного разрешения. Нелегальная КМДЗ наносит ущерб государству, поскольку она не зарегистрирована, не выплачивает роялти, не поддается регулированию, а также наносит ущерб окружающей среде и негативно влияет на здоровье людей из-за использования ртути.
Добыча золота в Индонезии традиционным методом в большинстве случаев включает амальгамирование с ртутью [1]. Ртуть и золото выпадают в осадок, образуя ртутно-золотую амальгаму, которая затем нагревается при высоких температурах. Затем золото извлекается путем выпаривания, при этом отгоняется только 10-40 % содержащегося золота [2]. Традиционным методом переработки шахтеры зачастую могут извлечь лишь ограниченное количество золота с высоким содержанием ртути (ежегодно в окружающую среду выбрасывается более 1000 т ртути) [1], что наносит вред экологии и здоровью не только для самих шахтеров, участвующих в переработке, но и окружающему населению, не занимающемуся добычей. На долю выбросов ртути в результате деятельности КМДЗ приходится 37 % всех антропогенных выбросов ртути в окружающую среду, что делает КМДЗ вторым источником ртутного загрязнения в Индонезии после сжигания угля [3, 4]. Загрязнение подземных вод ртутью представляет серьезную опасность для человека, животных и экосистемы в глобальном масштабе. По данным Агентства по охране окружающей среды и Всемирной организации здравоохранения, предельно допустимые нормы общего содержания ртути и CH3Hg составляют 5,0 и 1,6 г/кг в неделю соответственно. Кроме того, в Постановлении Правительства Индонезии № 82 от 2001 г. указано, что количество ртути, содержащейся в воде, составляет 0,001 части на миллион (ppm). Это подтверждается постановлением Министерства здравоохранения Индонезии № 907/Menkes/SK/VII/2002, в котором указано, что максимальная концентрация допустимой ртути составляет 0,001 мг/л. Таким образом, удаление ртути из загрязненной воды имеет первостепенное значение, и этот вопрос требует дополнительного внимания и рассмотрения. Одним из наиболее значимых актов, направленных против использования ртути, стала Минаматская конвенция ООН по ртути, подписанная 128 странами в 2013 г. Ее основная задача – ограничить и сократить использование ртути, а к 2030 г. окончательно ликвидировать ее.
Для удаления ртути из сточных вод применяется ряд химических и физических процессов, такие как ионный обмен [5], коагуляция/соосаждение [6], адсорбция, обратный осмос, мембранное разделение, жидкостно-жидкостная экстракция, осаждение, электроосаждение [7, 8]. Однако с инженерной точки зрения стоимость и эффективность технологии должны быть невысокими. Тем не менее, адсорбционные технологии позволяют удалять ионы тяжелых металлов благодаря своей простоте, возможности многократного использования адсорбента, экологичности, простоте эксплуатации и экономической эффективности [9, 10].
Рисовая шелуха – это защитная внешняя оболочка рисовых зерен, которая является обильным сельскохозяйственным отходом рисового производства и имеет различные варианты использования и разные сферы применения. Краткая информация о последних потенциальных возможностях применения рисовой шелухи и ее модификации приведена в табл.1.
Некоторые исследователи уже изучали возможности использования сорбентов из рисовой шелухи для удаления тяжелых металлов из воды [11-14]. Однако в этих исследованиях использовались сложные и дорогостоящие методы, связанные с модификацией рисовой шелухи. Поэтому в данной работе для определения адсорбционных свойств рисовой шелухи в качестве сорбирующего материала использовалась необработанная рисовая шелуха. Таким образом, мелкие старатели КМДЗ смогут использовать данный метод при переработке ртутных отходов золотодобычи.
В данной работе изучалась способность необработанной рисовой шелухи удалять Hg2+ при различных сравнительных условиях, таких как начальная концентрация, время контакта и дозировка. Кроме того, для понимания взаимодействия между несколькими сорбатами и влияния комплексообразующих лигандов на динамику сорбции Hg с помощью моделей кинетики и изотермы адсорбции была исследована эффективность использования необработанной рисовой шелухи для удаления Hg2+ из сточных вод. Затем были проведены экспериментальные и теоретические исследования для выяснения механизма адсорбции ртути на рисовой шелухе и сорбционной способности этого адсорбента.
Таблица 1
Варианты применения и модификации рисовой шелухи
|
Материал |
Сфера применения |
Модификация |
Результаты |
Источник |
|
Рисовая шелуха, KOH, HCl, HNO3 |
Удаление тяжелых металлов из водной фазы |
Пиролиз; активированная с помощью KOH |
Адсорбент |
[11] |
|
Рисовая шелуха, бамбуковые опилки |
Удаление тяжелых металлов из водной фазы |
Карбонизированная при 400 °C в течение 2 ч; смесь с золой бамбуковых опилок |
Адсорбент |
[12] |
|
Рисовая шелуха, Na2CO3, NaOH, CH2Cl2, CH3NH2, CH3COOH, K2Cr2O7 |
Удаление тяжелых металлов из водной фазы |
Модифицированный Na2CO3 |
Адсорбент |
[13] |
|
Уголь, рисовая шелуха, Pb(NO3)2, NaNO3, HNO3, NaOH |
Удаление тяжелых металлов из водной фазы |
Биоферментация |
Адсорбент |
[14] |
|
Рисовая шелуха, твердый гидроксид натрия, винная кислота, дистиллированная вода |
Среда роста монокристалла CaC4H4O64H2O |
Пиролиз; фильтрат силиката натрия подвергался воздействию винной кислоты (C4H6O6) |
Метасиликатный гель |
[15] |
|
Зола рисовой шелухи, грунт, бентонитовая глина |
Керамическая мембрана в микробных топливных элементах |
Зола рисовой шелухи смешивается с почвой |
Керамическая мембрана |
[16] |
|
HNO3, H2SO4, и H2O2 |
Производство водорода |
Неорганическая обработка с помощью ультразвука |
Катализатор |
[17] |
|
Рисовая шелуха, полиэфирная смола, пероксид метилэтилкетона – катализатор,пальмовые ветви |
Наполнитель и смола |
Высушивается на солнце в течение 3 дней; смешивается с пальмовыми ветвями в соотношении: 90/10; 70/30; 50/50; 30/70 |
Тормозные колодки на основе композитов |
[18] |
|
Рисовая шелуха, калий-дигидрогенфосфат и калийная селитра |
Внесение удобрений в почву |
Пиролиз с помощью микроволновой обработки |
Адсорбент |
[19] |
|
NaOH, HCl, алюминат натрия, этанол, LiCl·H2O, LaCl3·7H2O и CeCl3·7H2O |
Улавливание углерода |
Гидротермальный метод;импрегнированный цеолит |
Пористый сорбционный материал редкоземельных элементов La и Ce |
[20] |
|
рисовая шелуха, пшеничная мука, соевое масло, вода и сухие дрожжи |
Теплоизоляция |
Карбонизация;ферментация |
Углеродная пена (вспененный углерод) |
[21] |
|
Рисовая шелуха, NaOH – 98, HCl – 37, KBr – 98, Mg – 98, EtOH – 98, плавиковая кислота (HF) – 40, гексафторфосфат лития (LiPF6) – 99, этиленкарбонат – 99, диэтилкарбонат – 99, этилметилкарбонат – 98 % по массе; ацетиленовая сажа, полиакриловая кислота и n-метил-2-пирролидон |
Отходы |
Кальцинирование-KBr |
Наночастицы кремния |
[22] |
|
Рисовая шелуха и KOH |
Накопители энергии и устройства преобразования энергии на основе углерода |
Кальцинирование и химическая активация-KOH |
Графен |
[23] |
|
Зола рисовой шелухи и бромид цетилтриметиламмония |
Фотокатализатор для разложения метиленового синего |
Золь-гель |
Кремний-оловянные нанотрубки |
[24] |
|
Зола рисовой шелухи, HCl, этилметансульфонат (ЭМС) |
Замена цемента |
Кислотная модификация;смешивание с ЭМС |
Цементный раствор |
[25] |
|
Зола рисовой шелухи, NaOH, HCl, этанол, диоксид углерода, керосин без запаха, Span 80, Tween 80, додецилсульфат натрия и вода |
Фармацевтика |
Золь-гель |
Микрочастицы силикатного аэрогеля |
[26] |
|
Рисовая шелуха |
Производство биоудобрений |
Анаэробное сбраживание периодического действия |
Биогаз и продукты анаэробного разложения |
[27] |
|
Рисовая шелуха, амоксициллин тригидрат, церия(III) нитрат, гексагидрат, гуминовая кислота, додецилсульфат натрия и диклофенак натрия |
Удаление антибиотиков |
Гидротермальный метод |
Адсорбент Ceo2@sio |
[28] |
|
Рисовая шелуха, KOH и NaOH |
Электрод суперконденсатора |
Химическая активация с использованием двойных активаторов |
Активированные угли |
[29] |
|
Рисовая шелуха, HCl, HNO3, H2SO4 и H3PO4 |
Получение кремнезема |
Метод кислотного выщелачивания |
Мезопористый кремнезем и магнитный мезопористый кремнезем |
[30] |
Методы
Материалами для исследования служили необработанная рисовая шелуха (предоставленная компанией Farm Shop, Бандунг, Индонезия), стандартный исходный раствор ртути (1000±2 мг/л, Merck (Германия)), азотная кислота (EMSURE) и ультрачистая вода (18,2 МОм/см, система Milli-Q). В данном исследовании все используемые реагенты относились к классу аналитических реактивов.
Необработанную рисовую шелуху измельчали до требуемого размера и просеивали через сита с размерами отверстий 74, 125, 250, 500, 1000 и 2000 мкм (Общественный фонд «Bumi Nusantara», Индонезия) с последующим хранением при комнатной температуре. Измельчение выполняли при помощи обычной ножевой мельницы периодического действия. Как правило, в состав такого размольного устройства входит размольная трубка из материала SAN диаметром 16,6 и длиной 13,5 см, а также ножи из нержавеющей стали 6 см. Размол проводился при комнатной температуре в течение 10 мин.
Для определения функциональных групп рисовой шелухи в диапазоне длин волн 400-4000 см–1 использовался ИК-Фурье-спектрометр Nicolet 6700 производства Thermo Fisher Scientific, США. Кроме того, для характеристики морфологии поверхности адсорбента использовался сканирующий электронный микроскоп с полевой эмиссией (СЭМ) JSM-6360. Затем были измерены удельная площадь поверхности и средний размер пор адсорбента по методу БЭТ при температуре 77 К с помощью прибора Quantachrome NOVA 2200E, Китай. Наконец, для определения содержания химических элементов в растворе использовались атомно-абсорбционные спектрофотометры Agilent 200 Series AA компании Agilent Technologies.
Процедура адсорбции
Для проведения серийных адсорбционных экспериментов растворы Hg(II) готовились с использованием реактива аналитического класса (Hg(NO3)2), а в качестве растворителя использовалась сверхчистая вода. pH приготовленных растворов корректировали с помощью раствора HNO3 0,05 М для обеспечения присутствия ионов металла, образование которых зависит от кислотности среды.
Для оценки эффективности рисовой шелухи при удалении Hg из 100 мл водных растворов были проведены различные экспериментальные исследования. Для определения наиболее благоприятных условий адсорбции исследовались такие параметры, как время контакта (от 30 до 180 мин), дозировка адсорбента (от 0,02 до 0,2 г) и начальная концентрация Hg (от 5 до 20 мг/л). Затем были получены оптимальные значения, обеспечивающие наибольшую степень очистки. После этого при использовании полученных оптимальных значений были проведены кинетические и изотермические испытания с различным временем контакта.
Раствор смеси встряхивали при 200 об/мин с помощью магнитной мешалки (SP88850105 производства Thermo Fisher Scientific). После окончания адсорбции раствор фильтровали с помощью нейлонового мембранного фильтра 0,45 мкм для удаления адсорбента, мешающего определению ртути. Остаточную концентрацию Hg(II) определяли в конце каждого эксперимента на атомно-абсорбционном спектрофотометре Agilent 200 Series АА. Затем рассчитали адсорбционную емкость и степень удаления Hg:
где C0 и Ce – начальная и остаточная концентрации ионов металлов соответственно, мг/л; Ct – концентрация аналита в момент времени t, мг/л; V – объем используемого раствора, л; m – масса адсорбента, г.
Кинетическая процедура
Кинетические параметры необходимы для прогнозирования скорости удаления Hg(II) из водных растворов, понимания механизма адсорбции и определения стадии, определяющей адсорбцию [31]. В данной работе использовались данные о влиянии времени контакта на количество Hg(II), адсорбированной на поверхности рисовой шелухи, которые получены в рамках уравнений Лагергрена псевдопервого порядка [32]
и псевдовторого порядка [31, 32]
где Qe – адсорбционная емкость при равновесии, мг Hg/г рисовой шелухи; Qt – адсорбционная емкость в момент времени t, мг Hg/г рисовой шелухи; k1 – константа скорости кинетической модели псевдопервого порядка Лагергрена, мин–1; t – время эксперимента, мин; k2 – константа скорости кинетической модели псевдовторого порядка, мин–1.
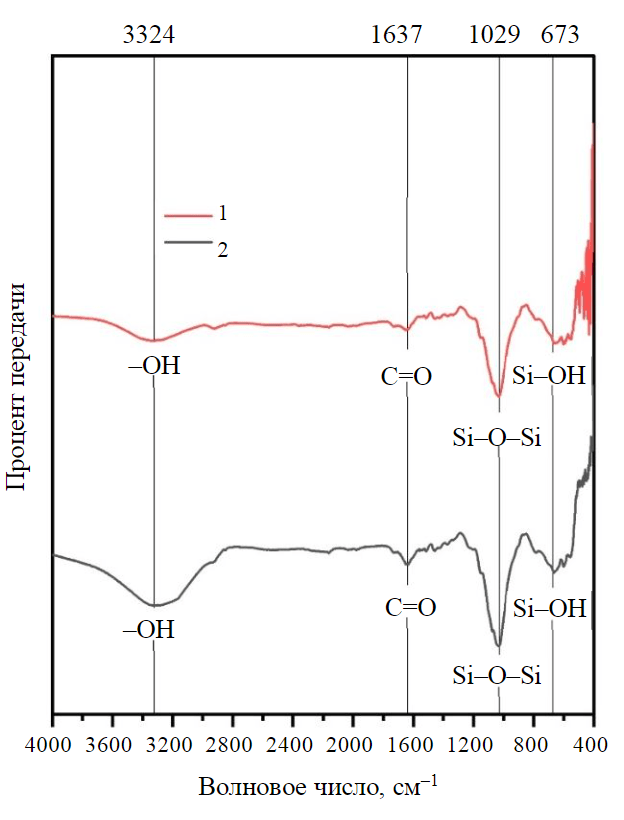
Рис.1. ИК-Фурье-спектроскопия рисовой шелухи до и после адсорбции 1 – после адсорбции; 2 – до адсорбции
Считается, что кинетика адсорбции в значительной степени зависит от физико-химических свойств используемого вещества (адсорбента) [18].
Результаты и обсуждение
ИК-Фурье-спектры необработанной рисовой шелухи получены после и до адсорбции (рис.1). Полоса, расположенная при 3282 см–1, соответствует гидроксогруппе (–OH), связанной с растяжением целлюлозы и лигнина рисовой шелухи до процесса адсорбции [33-35]. Другие пики в спектре рисовой шелухи до адсорбции Hg2+ – полоса при 2918 см–1, отнесенная к связи C–H в –CH- и –CH2-группах; полосы при 2160-1978,65 см–1, обусловленные связью C≡C, и полоса при 1650,69-1514,86 см–1 отнесена к группе C=O (эфирная и карбоксильная группа из гемицеллюлозы) и связи C=C ароматических колец из лигнина, в то время как полосы 1455,11-1330,89 см–1 – к группе –COOH [36]. Резкий пик колебаний в области 1073,75 и 1032,02 см–1 можно соотнести с органическим кремнием (Si–O–Si), а пик, возникающий в области волновых чисел 788,75-557,36 см–1, является типичной характеристикой спектра аморфного кремнезема (Si–OH) [35].
При анализе ИК-Фурье-спектров после адсорбции ртути (рис.1) был обнаружен заметный пик при 432,08 см–1. Этот пик можно отнести к колебаниям кислорода, перпендикулярным плоскостям Si–O–Si [35]. Кроме того, спектры рисовой шелухи после удаления Hg2+ показали заметное уменьшение длины волн пиков при 2160,82, 2034,84, 1978,65 и 1073,75 см–1 за счет оксигенированных функциональных групп. Результаты использования адсорбентов, полученных из отходов агропромышленного комплекса, сходны с данными, опубликованными в источниках [31-37]. В более ранних исследованиях было показано, что соединения ртути демонстрируют характерные сигналы на ИК-Фурье-спектрах при 3500, 1750 и 600 см–1 [38]. В случае рисовой шелухи наблюдается полоса при 3500 см–1, что соответствует взаимодействию –OH и Hg. Эти результаты согласуются с данными X.Guo et al. [36] – фенольные гидроксильные группы на поверхности адсорбента вступают в реакции комплексообразования с Hg2+.
СЭМ-изображение адсорбента представлено на рис.2. СЭМ-анализ поверхности адсорбента выявил неравномерный слой кремнезема и природных смол в структуре рисовой шелухи. СЭМ-изображение рисовой шелухи до адсорбции (рис.2, а, б) демонстрирует наличие поверхностных пор, которые служат идеальным местом для захвата Hg2+ из водных растворов [39]. После адсорбции на СЭМ-изображении рисовой шелухи видно, что ионы Hg2+ успешно захватываются в поры на его поверхности (рис.2, в, г). Это происходит в результате диффузии и миграции молекул Hg2+ из водного раствора к поверхности рисовой шелухи и, в конечном счете, заполнения имеющихся пор [40]. Физическая адсорбция Hg2+ на поверхности рисовой шелухи, вероятно, обусловлена механической адгезией за счет электростатических сил, что согласуется с результатами предыдущих исследований [39-41].

Рис.2. СЭМ-микрофотография рисовой шелухи до адсорбции (а) и нагруженной Hg – после адсорбции (в); рентгенограмма (EDX-спектр) рисовой шелухи до адсорбции (б) и после адсорбции (г)
На рис.2, б, г представлены рентгенограммы (EDX-спектры) рисовой шелухи. На рис.2, б показано, что преобладающими элементами в приготовленном адсорбенте являются углерод и кислород, что свидетельствует о наличии на поверхности углерода кислородных функциональных групп. Кроме того, в небольших количествах присутствуют кремнезем, кальций, магний и фосфор из исходного материала. Тем не менее, после адсорбции (рис.2, г) наблюдается уменьшение количества катионов, присутствующих в рисовой шелухе.
Также было обнаружено появление пиков Hg на рентгенограмме, что подтверждает заполнение Hg поровой структуры. Этот результат позволяет предположить, что, возможно, имел место механизм ионного обмена [36].
Для определения типа изотермы, удельной поверхности и объема пор адсорбента использовались изотермы адсорбции азота (Quantachrome NOVA 2200E и формализм Брунауэра – Эммета – Теллера (БЭТ). Результаты исследования изотермы адсорбции азота показали, что она имеет тип IV по классификации IUPAC и гистерезис H3 (рис.3, а). Это свидетельствует о мезопористом веществе с непрерывным простым соединением пор. Кроме того, оно имеет ограниченную многослойную структуру, соответствующую полному заполнению капилляров [42-45]. Удельная площадь поверхности адсорбента по БЭТ составила 173,782 м2/г, а распределение пор по методу BJH показало, что диаметр пор составляет около 1,714 нм, объем пор – около 0,307 см3/г (рис.3, б). Эти результаты превзошли результаты предыдущих исследований [37, 46]. Полученные нами результаты свидетельствуют о превосходном качестве адсорбента.
Исследование адсорбции
Было выявлено несколько факторов влияния на адсорбцию Hg:
- Влияние времени контакта. Для проведения эффективных экспериментов по адсорбции в статических условиях очень важно оценить влияние времени контакта, необходимого для достижения равновесия. Поэтому влияние времени контакта на адсорбцию Hg изучалось при различных дозировках адсорбента в пределах 30-180 мин. Результаты показали, что при комнатной температуре концентрация ртути в воде снижается в течение первых 30 мин (рис.4, а). Быстрые начальные скорости адсорбции объясняются наличием значительного числа активных центров адсорбции в начале процесса, затем происходит насыщение и установление равновесия [47]. Кроме того, наличие в структуре рисовой шелухи основных функциональных групп, таких как оксигенированные ароматические кольца, подтвержденное ИК-спектрами (см. рис.1), позволяет осуществлять Hg-π-сопряжение и π-π-взаимодействие (стэкинг-взаимодействие) с ионами Hg [48]. Как показывают СЭМ-изображения (см. рис.2), наличие целлюлозы и лигнина также может играть роль в удалении тяжелого металла ртути [37]. Установлено, что оптимальное время контакта для удаления ртути составляет около двух часов для всех дозировок рисовой шелухи, так как процентное содержание ртути после этого срока увеличивается незначительно (рис.4, а).
- Влияние дозировки адсорбента. Как правило, адсорбенты имеют ограниченное количество активных центров, поэтому их дозировка должна быть оптимизирована. Для обработки 100 мл водного раствора с начальной концентрацией ртути 200 мкг/л в течение 120 мин в условиях окружающей среды были определены различные дозировки рисовой шелухи. На рис.4, б показано, что степень удаления ртути увеличивается с ростом дозировки адсорбента и достигает 78,8 % при дозировке 0,2 г. Это объясняется тем, что с ростом дозировки увеличивается количество активных центров на поверхности адсорбента, что позволяет ему связывать больше ртути [32, 37, 47, 48]. Однако при увеличении дозировки адсорбента уменьшалось и количество адсорбированных ионов металла из-за снижения концентрации ртути в растворе. Таким образом снижалась и движущая сила процесса адсорбции. В результате не все доступные активные центры адсорбции могут быть заняты, что приводит к снижению адсорбционной емкости [49, 50].
- Влияние начальных концентраций Hg. На рис.4, в, г представлено влияние начальных концентраций ртути на эффективность процесса адсорбции при использовании 0,05 г рисовой шелухи. Изучалось влияние различных уровней концентрации Hg на адсорбционные свойства с использованием раствора ртути в качестве модели сточных вод. Исходная концентрация раствора ртути составляла 5, 10 и 20 мг/л. Эти концентрации приняты, исходя из реальной концентрации ртути в загрязненных сточных водах (речных) Индонезии. Из рис.4, в, г, видно, что с увеличением начальной концентрации ртути увеличивается как адсорбционная способность, так и степень удаления ртути. При более высокой концентрации ртути (20 мг/л) максимальная степень удаления составляет около 93,1 %, а адсорбционная емкость – около 37,3 мг/г. При более низких концентрациях ртути (10 и 5 мг/л) степень удаления после 120 мин контакта составляет 78 и 52 % соответственно, а адсорбционная емкость – 28,6 и 5,2 мг/г соответственно. Это объясняется тем, что высокая начальная концентрация обеспечивает необходимую движущую силу для преодоления процессов массопереноса адсорбата между водной и твердой фазами [47, 51, 52].

Рис.3. Характерная изотерма адсорбции N2 на адсорбенте типа IV (по классификации IUPAC (a) и распределение пор адсорбента (б)
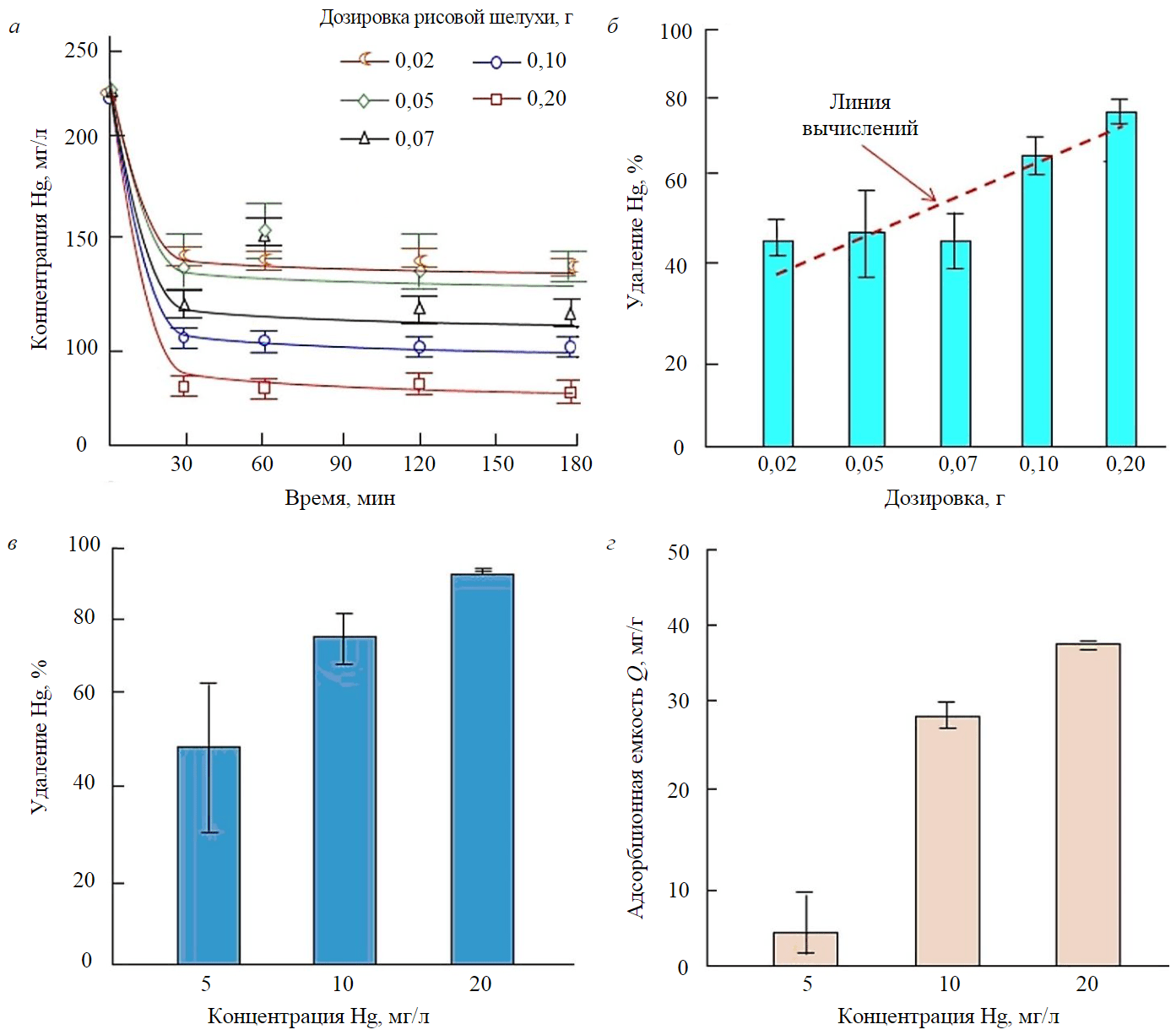
Рис.4. Зависимость концентрации Hg в воде от времени (а); адсорбционные характеристики рисовой шелухи при различных дозировках адсорбента (б); влияние начальной концентрации ртути на процент удаления (в); адсорбционная емкость (г)
Кинетика адсорбции
Для понимания скорости и механизма удаления Hg(II) из водного раствора необходимо знание его кинетических параметров. При анализе кинетических уравнений (1) и (2) в сравнении с экспериментальными данными были получены линейные связи. Таким образом были определены кинетические параметры адсорбции ртути (табл.2). Эффективность кинетических моделей оценивалась по значениям коэффициента детерминации R2. Рассчитанные кинетические константы показали, что кинетическая модель псевдовторого порядка имеет наибольший коэффициент корреляции R2 и обеспечивает наилучшее соответствие. Кроме того, результаты показали, что поглощение Hg, полученное с помощью кинетической модели псевдопервого порядка, было значительно ниже экспериментального значения (Qe(cal)⊥Qe(exp)). Напротив, расчетное поглощение Hg в рамках кинетики псевдовторого порядка было значительно ближе к экспериментальному значению. Этот вывод согласуется с результатами предыдущих исследований, проведенных [31, 32]. Эти результаты подтверждают, что наилучшей кинетической моделью является кинетическая модель псевдовторого порядка и что адсорбция Hg на рисовой шелухе, скорее всего, происходит по хемосорбционному механизму [8, 53].
Таблица 2
Кинетические параметры адсорбции ртути на рисовой шелухе
|
Кинетическая информация |
Параметр |
Значение |
|
Экспериментальные данные |
Qe(exp),мг/г |
90,63 |
|
Модель псевдопервого порядка Лагергрена |
Qe(cal), мг/г |
37,07 |
|
k1,мин–1 |
0,0244 |
|
|
R2 |
0,57238 |
|
|
Модель псевдовторого порядка |
Qe(cal), мг/г |
92,65 |
|
|
k2, г/мг·мин |
0,0016 |
|
R2 |
0,98859 |
Изотермы адсорбции
Для изучения механизма адсорбции в табл.3 приведен краткий обзор десяти изотерм адсорбции и расчеты для получения кривых из результатов аппроксимации данных. В работе [54] подробно приведен расчет изотерм адсорбции.
Таблица 3
Сводная информация о десяти моделях изотерм адсорбции
|
Модель |
Теоретическое рассмотрение |
диаграмма (оси х и у) |
Параметр |
|
Ленгмюра |
Модель предполагает монослойную адсорбцию, при которой адсорбаты адсорбируются на конечном числе одинаковых и эквивалентных определенных локализованных участков без латерального взаимодействия, где kL – постоянная Ленгмюра; qe – количество молекул, адсорбированных при равновесии; мг/г, qmax – адсорбционная емкость, мг/г. Коэффициент адсорбции где RL характеризует: неблагоприятную адсорбцию (RL > 1), линейную адсорбцию (зависит от количества и концентрации адсорбированных молекул – RL = 1), слишком сильную адсорбцию или необратимую адсорбцию (RL = 0) и благоприятную адсорбцию или отсутствие десорбции (0 < RL < 1) |
|
|
|
Фрейндлиха |
Модель отражает многослойную адсорбцию на гетерогенных поверхностях, обусловленную вариациями теплоты адсорбции, где kF – константа Фрейндлиха, используемая для определения адсорбционной емкости; Ce – концентрация адсорбата в равновесном состоянии, мг/л; n – степень нелинейности и сила адсорбции: хемосорбция n < 1 или физорбция n > 1; линейная адсорбция (не зависящее от концентрации разделение между двумя фазами n = 1; нормальная адсорбция n–1 < 1; кооперативная адсорбция n–1 > 1; благоприятная адсорбция или отсутствие десорбции 1 < n–1 < 0; адсорбция на гетерогенной поверхности 0 < n–1 < 1; чем величина n ближе к нулю, тем больше неоднородность поверхности адсорбента
|
|
|
|
Темкина |
Модель охватывает взаимодействие между адсорбентом и адсорбатом, если теплота адсорбции молекул линейно уменьшается в каждом адсорбированном слое и исключает высокие и низкие значения концентрации, где AT – константа равновесия модели Темкина; ВT – константа Темкина, которая определяет, является ли адсорбция физической (ВT < 8 кДж) или химической (ВT > 8 кДж)
|
|
|
|
Дубинина – Радушкевича |
Модель основана на адсорбции газов пористыми адсорбентами и механизме заполнения пор где Qs – емкость насыщения, мг/г; β – постоянная Дубинина – Радушкевича, соответствующая средней свободной энергии адсорбции; ε – потенциал Поляни, связанный с равновесными условиями, значение которого коррелирует с энергией адсорбции E относится к физической (E < 8 кДж) или химической (E > 8 кДж) адсорбции
|
|
|
|
Флори – Хаггинса |
Модель основана на адсорбции газов пористыми адсорбентами и механизме заполнения пор где θ = (1 – Ce/Co) – степень покрытия монослоя; kFH – константа равновесия для модели Флори – Хаггинса, которая коррелирует со свободной энергией Гиббса ∆G° может описывать спонтанный и зависящий от температуры характер адсорбции, если она отрицательна |
|
|
|
Фаулера – Гуггенхайма |
Модель основана на адсорбции газов пористыми адсорбентами и механизме заполнения пор где W – энергия взаимодействия между адсорбированными молекулами, кДж/моль; формирование происходит при экзотермическом (W > 0), эндотермическом (W < 0) или отсутствии взаимодействия между адсорбированными молекулами (W = 0) |
|
|
|
Хилла – де Бура |
Модель основана на адсорбции газов пористыми адсорбентами и механизме заполнения пор где k1 (л/мг) и k2 (кДж/моль) – константы, связанные с энергией взаимодействия адсорбированных молекул; при k2 > 0 процесс экзотермичен, что свидетельствует о преобладании сил притяжения; при k2 < 0 преобладают силы межмолекулярного отталкивания (эндотермический); при отсутствии взаимодействия между адсорбированными молекулами k2 = 0 |
|
|
|
Йованович
|
Модель оценивает адсорбцию на неоднородной поверхности, где в процессе адсорбции образуется мультислой, где Qe – количество адсорбата в адсорбенте при равновесии, мг/г; Qmax – максимальное поглощение адсорбата; kJ – постоянная Йовановича. При высокой концентрации адсорбата уравнение превращается в изотерму Ленгмюра |
|
|
|
Харкина – Джура |
Модель оценивает адсорбцию на гетерогенной поверхности, где в процессе адсорбции образуется мультислой, где BHJ – удельная поверхность адсорбента; AHJ – константа Харкина – Джура |
|
|
|
Халси |
Модель оценивает многослойную адсорбционную систему вдали от поверхности. Аналогично модели Фрейндлиха, модель Халси применима к многослойной адсорбции и гетерогенным поверхностям с неравномерно распределенной теплотой адсорбции где kH и n – постоянные Халси |
|
|
Примечание: slope – угловой коэффициент; intercept – линейная часть уравнения аппроксимации.
Анализ изотерм адсорбции имеет большое значение для определения характера взаимодействия поверхности адсорбента с молекулами адсорбата. Взаимодействие между ионом металла и материалом адсорбента, а также адсорбционная способность материала могут быть определены с помощью изотермических моделей. Десять моделей изотерм адсорбции были использованы для сопоставления с экспериментальной адсорбцией ртути на рисовой шелухе. Параметры рисовой шелухи, полученные на основе десяти исследованных моделей, представлены в табл.4. Экспериментальные значения реконструированы на основе графиков ряда параметров (по уравнениям табл.3). Затем для демонстрации совместимости корреляционных кривых между экспериментальными данными и линеаризованными моделями изотерм используются коэффициенты линейной корреляции R2.
Таблица 4
Параметры изотермы для адсорбции Hg (II) на рисовой шелухе
|
Модели изотерм |
Параметр |
Значение |
|
Ленгмюра |
Qmax |
68,140 |
|
|
RL |
1,1 |
|
kL |
–0,0016 |
|
|
R2 |
0,934 |
|
|
Фрейндлиха |
Ln kF |
5,308 |
|
|
kF |
0,788 |
|
1/nF |
–0,238 |
|
|
nF |
–4,200 |
|
|
R2 |
0,984 |
|
|
Темкина |
B |
–19,954 |
|
|
BT |
–1,229 |
|
AT |
2,02E-56 |
|
|
R2 |
0,989 |
|
|
Дубинина – Радушкевича |
β |
0,276 |
|
|
E |
1,345 |
|
R2 |
0,892 |
|
|
Флори – Хаггинса |
nFH |
–4,131 |
|
|
log kFH |
–10,702 |
|
kFH |
1,98575E-11 |
|
|
ΔG° |
–604,486 |
|
|
θ |
0,815 |
|
|
R2 |
0,984 |
|
|
Фаулера – Гуггенхайма |
W |
–11,622 |
|
|
−ln kFG |
11,590 |
|
kFG |
9,2573E-06 |
|
|
α(slope) |
–0,772 |
|
|
θ |
0,815 |
|
|
R2 |
0,992 |
|
|
Хилла – де Бура |
k1 |
1,47763E-13 |
|
|
−ln k1 |
29,543 |
|
k2 |
–1187,105 |
|
|
α(slope) |
–39,427 |
|
|
θ |
0,815 |
|
|
R2 |
0,969 |
|
|
Йовановича |
k1 |
–0,006 |
|
|
ln Qmax |
4,676 |
|
Qmax |
107,299 |
|
|
R2 |
0,999 |
|
|
Харкина – Джура |
AH |
6369,008 |
|
|
BH/AH |
–0,00011 |
|
R2 |
0,970 |
|
|
Халси |
1/nH |
–0,238 |
|
|
nH |
–4,200 |
|
ln kH |
5,308 |
|
|
kH |
201,925 |
|
|
R2 |
0,9836 |
Коэффициент Ленгмюра RL определяет, является ли адсорбция благоприятной. В данном случае значения попадают в диапазон RL > 1, что свидетельствует о неблагоприятном протекании процесса адсорбции, при этом максимальная адсорбционная емкость Qm составляет 68,140 мг/г. Кроме того, степень взаимодействия адсорбата и адсорбента kL указывает на слабый контакт между молекулой адсорбата и поверхностью адсорбента из-за своего малого значения kL = –0,0016 [54]. При этом значение коэффициента корреляции Ленгмюра R2 = 0,934 указывает на то, что в процессе адсорбции на данном адсорбенте может образовываться монослойная структура. Тем не менее отрицательное значение kL показывает, что данные не соответствуют модели Ленгмюра.
Эффективность аппроксимации по Фрейндлиху приведена в табл.4. Угловой коэффициент, полученный в результате аппроксимации данных в виде градиента, равен n–1, а линейный член – lnkF. Анализ величины n для адсорбента рисовой шелухи показал отрицательное значение с корреляциями n < 1 и n–1 < 1, что свидетельствует о том, что адсорбция происходит химическим путем. Кроме того, высокое значение R2 = 0,984 говорит о том, что адсорбционный профиль рисовой шелухи в процессе адсорбции имеет многослойную структуру. Адсорбционная емкость kF, имеет значение 0,788 мг/г.
Подход Темкина основан на том, что адсорбция линейно уменьшает теплоту адсорбции всех молекул [55]. Определенные значения параметров (ВТ и АТ) приведены в табл. 4. Величины ВТ и АТ имеют небольшие значения (2,02∙10–56 и –1,229 соответственно), что означает меньшее сродство между молекулами адсорбента и адсорбата вследствие их физических взаимодействий. Коэффициент корреляции Темкина (R2 = 0,989) свидетельствует о том, что имеет место многослойная адсорбция с однородным распределением между адсорбатом и поверхностью адсорбента. Однако из-за малого значения параметра эта модель не может быть использована.
Значение R2 Дубинина – Радушкевича (0,892) является наименьшим в данном исследовании. Это значение свидетельствует о наличии микропор в поверхностях адсорбентов с многослойной структурой. Значение величины Е в данной модели составило < 8 КДж/моль, что свидетельствует о том, что адсорбция является физическим процессом [55, 56].
Термодинамическая целесообразность и самопроизвольность процесса адсорбции может быть предсказана с помощью изотермы Флори – Хаггинса, которая описывает степень покрытия адсорбатом поверхности адсорбента [54, 57]. Полученные в данном исследовании значения nFH (табл.4) свидетельствуют о том, что адсорбат занимает более одного активного центра адсорбента, образуя многослойную структуру [54], что подтверждается и значением R2 = 0,984, указывающим на то, что ни одна молекула не была связана ни с одним адсорбционным участком на рисовой шелухе [57]. В результате модель Флори – Хаггинса не может предсказать адсорбцию Hg(II) на рисовой шелухе из-за малых значений параметров и поэтому не принимается во внимание. Отрицательное значение ΔG свидетельствует о том, что адсорбция Hg(II) на рисовой шелухе происходит термодинамически самопроизвольно и подтверждает жизнеспособность процесса.
Модель изотерм Фаулера – Гуггенхайма учитывает латеральное взаимодействие при адсорбции адсорбата на адсорбенте [54, 58]. Значение R2 = 0,992 для этой модели свидетельствует о хорошем соответствии. Напротив, параметры W и kFG имеют относительно небольшие значения. Отрицательное значение W указывает на то, что между адсорбированными молекулами происходит взаимодействие отталкивания. В то же время очень низкое значение kFG указывает на слабое взаимодействие между адсорбатом и адсорбентом, обусловленное силами Ван-дер-Ваальса. Следовательно, данная модель не подходит.
Модель Хилла – де Бура описывает подвижную адсорбцию и латеральное взаимодействие адсорбированных молекул [59]. С помощью уравнения (3) были определены параметры адсорбции по модели Хилла – де Бура. Как видно из табл.3, коэффициент регрессии R2 имел значение 0,969, что свидетельствует о многослойной структуре в процессе адсорбции. При этом отрицательное значение k2 означает отталкивание. При наличии отталкивания между адсорбированными видами кажущееся сродство уменьшается с увеличением нагрузки [59]. Умеренное значение k1 свидетельствует о плохом взаимодействии адсорбента и адсорбата, поскольку активный объект не эффективен для осуществления процесса адсорбции. Следовательно, модель является неприемлемой.
Адсорбционные параметры модели Харкина – Джура были получены с помощью уравнения (4). Значение R2, равное 0,970, является результатом многослойного процесса адсорбции на поверхности адсорбента с неоднородным распределением пор.
Значение коэффициента корреляции Халси свидетельствует о хорошей адсорбционной системе (R2 = 0,984), что указывает на гетерогенную природу адсорбента с многослойной структурой. Эти результаты согласуются с моделью Харкина – Джура.
Модель изотермы Йовановича характеризуется малым количеством механических контактов между десорбирующимися и адсорбирующимися молекулами [54, 58, 59]. Параметры модели Йовановича имеют наиболее удовлетворительное значение (табл.4), а коэффициент корреляции R2 (0,999) близок к единице. Кроме того, для этой модели характерна высокая максимальная емкость (107,299 мг/г), это свидетельствует о том, что эксперимент заключается в адсорбции с подвижным и локализованным монослоем и в отсутствии латерального контакта.
Анализ значения R2 показывает, что адсорбционная система рисовой шелухи совместима с различными моделями, в том числе и с моделью Дубинина – Радушкевича. Модели Ленгмюра, Фрейндлиха, Темкина, Флори – Хаггинса, Хилла – де Бура, Харкина – Джура, Фаулера – Гуггенхайма и Халси показали хорошее соответствие, но наилучшие результаты дала модель Йовановича. Это свидетельствует о том, что в процессе адсорбции формируется монослойная структура без каких-либо латеральных интерференций между адсорбатом и адсорбентом. Кроме того, считается, что на адсорбенте рисовой шелухи происходит многослойная адсорбция из-за неоднородного распределения пор, что приводит к их заполнению. Таким образом, связь между адсорбатом и адсорбентом характеризуется слабым химическим и физическим взаимодействиями (рис.5). Отбор и расположение основаны на понимании коэффициента корреляции R2. Модели в порядке убывания: Йовановича, Фаулера – Гуггенхайма, Темкина, Флори – Хаггинса, Фрейндлиха, Халси, Харкина – Джура, Хилла – де Бура, Ленгмюра, Дубинина – Радушкевича. Хотя модель хорошо согласуется с экспериментальными результатами, анализ, основанный на табл.4, физико-химической характеристике и кинетической адсорбции, показывает, что профиль адсорбции следует физико-химической адсорбции с многослойной адсорбцией. Кроме того, процесс адсорбции протекает эндотермически и спонтанно за счет формирования многослойной поверхности с системой заполнения пор и взаимоотталкивающими межмолекулярными взаимодействиями.
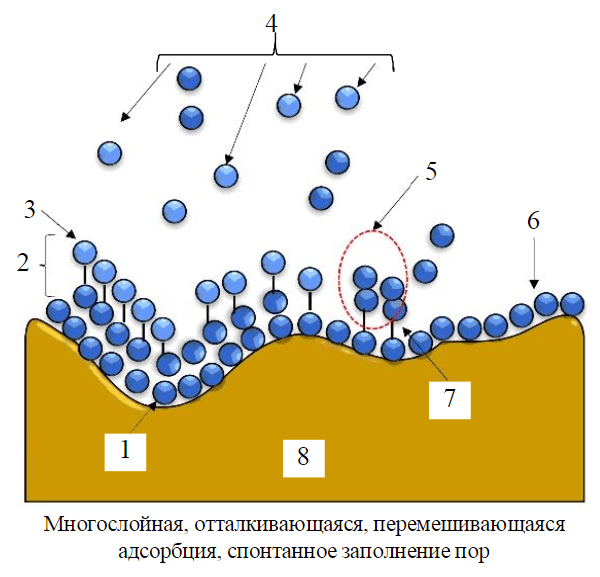
Рис.5. Прогнозная модель адсорбционной системы рисовой шелухи 1 – слабое физическое взаимодействие; 2 – многослойная адсорбция; 3 – физическая и химическая адсорбция; 4 – свободный адсорбат; 5 – взаимодействие между свободными и адсорбированными молекулами; 6 – однослойная адсорбция; 7 – слабое химическое взаимодействие; 8 – поверхность адсорбента
Предлагаемый механизм адсорбции
В связи с полученными характеристиками и в сочетании с результатами адсорбции мы предлагаем следующий механизм адсорбции. Если морфология действительно важна в процессе адсорбции, то наличие функциональных групп на поверхности рисовой шелухи имеет не меньшее значение. Между Hg2+ и оксигенированными функциональными группами существует нелинейная связь, обусловленная их взаимодействием с доступными парами электронов на кислороде и наличием в материалах ароматических структур (связей π-типа). В результате они обладают полярными свойствами с частично отрицательным зарядом и сильной тенденцией притягивать положительно заряженные ионы ртути. Таким образом, адсорбционные материалы рисовой шелухи преимущественно подвергаются адсорбции Hg2+ за счет трех процессов: электростатического взаимодействия между отрицательно заряженной плотностью на поверхности рисовой шелухи и катионом металла Hg2+; образования комплексов (–COO)2Hg и (–O)2Hg за счет взаимодействия между Hg2+ и сопряженными основаниями карбоксильных и фенольных групп (–COO– и –O–); взаимодействия между Hg2+ и π (или ионный обмен), Hg–Cπ-электронами из графеновой структуры (C=C) и C=O, присутствующими в материалах. Эти результаты согласуются с данными предыдущих исследований [31, 32, 36, 60]. Однако реакция комплексообразования между –OH-группами и Hg2+ является наиболее преобладающей [36]. Следовательно, механизм, происходящий в процессе адсорбции, – связывание.
Данное исследование является предварительным для пилотного и крупномасштабного процесса. Некоторые вопросы требуют более детального анализа, в том числе анализ образования Hg в структуре пор, включая конечную структуру пор. Необходимо также получить дополнительную информацию о площади поверхности (по методу БЭТ) и путем дифракции рентгеновских лучей) и взаимодействии молекул (по методу ИК-Фурье-спектров) и сравнить ее с данными литературных источников [61-63].
Выводы
В ходе исследования успешно удален Hg(II) реальных уровней концентрации в окружающей среде с использованием рисовой шелухи. Результаты показали, что способность рисовой шелухи адсорбировать ртуть повышается при увеличении времени контакта, дозировки адсорбента и начальной концентрации.
Кинетика адсорбции соответствовала модели псевдовторого порядка, а модель Йовановича точно описывала изотерму адсорбции с максимальной адсорбционной емкостью 107,299 мг Hg/г рисовой шелухи, что свидетельствует о сочетании физических и химических взаимодействий.
Исследование также показало, что адсорбирующие материалы с низкой площадью поверхности и высоким содержанием кислородсодержащих функциональных групп эффективны для удаления Hg(II), поскольку функциональные группы на поверхности материала притягивают Hg(II) посредством различных взаимодействий. Установлено, что рисовая шелуха обладает высокой эффективностью при удалении Hg(II) из водных растворов.
Данное исследование демонстрирует эффективность использования рисовой шелухи для удаления Hg(II) из воды. Дополнительные преимущества использования рисовой шелухи:
- широко доступна, особенно в странах, производящих рис, поскольку является побочным продуктом производства риса и не требует вложений;
- относится к категории сельскохозяйственных отходов, что позволяет используя ее в качестве адсорбирующего материала, решать актуальные проблемы утилизации и переработки отходов;
- применение для очистки сточных вод предполагает простую процедуру, требующую небольшого количества технологических операций;
- имеет отличную структуру пор, благодаря чему обладает хорошей адсорбционной способностью; дальнейшая разработка и обработка такой рисовой шелухи может повысить ее селективность;
- данный метод также может применяться для адсорбции ионов тяжелых металлов;
- использование для адсорбции тяжелых металлов может привести к значительным результатам в реализации Целей устойчивого развития (ООН).
Литература
- Meutia A.A., Lumowa R., Sakakibara M. Indonesian Artisanal and Small-Scale Gold Mining – A Narrative Literature Review // International Journal of Environmental Research and Public Health. 2022. Vol. 19. Iss. 7. № 3955. DOI: 10.3390/ijerph19073955
- Teknologi Pengolahan Emas Pada Pertambangan Emas Skala Kecil di Indonesia. Buku 4 / Ed. by B.D.Krisnayanti, A.S.Probiyantono. Jakarta: UNDP Indonesia, 2020. 17 p. URL: www.goldismia.org/sites/default/files/2020-12/View%20Buku%204%20%281%29.pdf (дата обращения 25.10.2023).
- Manzila A.N., Moyo T., Petersen J. A Study on the Applicability of Agitated Cyanide Leaching and Thiosulphate Leaching for Gold Extraction in Artisanal and Small-Scale Gold Mining // Minerals. 2022. Vol. 12. Iss. 10. № 1291. DOI: 10.3390/min12101291
- Green C.S., Lewis P.J., Wozniak J.R. et al. A comparison of factors affecting the small-scale distribution of mercury from artisanal small-scale gold mining in a Zimbabwean stream system // The Science of The Total Environment. 2019. Vol. 647. P. 400-410. DOI: 10.1016/j.scitotenv.2018.07.418
- Bashir A., Malik L.A., Ahad S. et al. Removal of heavy metal ions from aqueous system by ion-exchange and biosorption methods // Environmental Chemistry Letters. 2019. Vol. 17. Iss. 2. P. 729-754. DOI: 10.1007/s10311-018-00828-y
- Karwowska B., Sperczyńska E. Organic Matter and Heavy Metal Ions Removal from Surface Water in Processes of Oxidation with Ozone, UV Irradiation, Coagulation and Adsorption // Water. 2022. Vol. 14. Iss. 22. № 3763. DOI: 10.3390/w14223763
- Hua Kang, Xu Xueliu, Luo Zhiping et al. Effective Removal of Mercury Ions in Aqueous Solutions: A Review // Current Nanoscience. 2020. Vol. 16. Iss. 3. P. 363-375. DOI: 10.2174/1573413715666190112110659
- Ying Li, Yangxian Liu, Wei Yang et al. Adsorption of elemental mercury in flue gas using biomass porous carbons modified by microwave/hydrogen peroxide // Fuel. 2021. Vol. 291. № 120152. DOI: 10.1016/j.fuel.2021.120152
- Saleh T.A., Tuzen M., Sarı A. Polyamide magnetic palygorskite for the simultaneous removal of Hg(II) and methyl mercury; with factorial design analysis // Journal of Environmental Management. 2018. Vol. 211. № 323-333. DOI: 10.1016/j.jenvman.2018.01.050
- Xiaodong Yang, Yongshan Wan, Yulin Zheng et al. Surface functional groups of carbon-based adsorbents and their roles in the removal of heavy metals from aqueous solutions: A critical review // Chemical Engineering Journal. 2019. Vol. 366. P. 608-621. DOI: 10.1016/j.cej.2019.02.119
- Sanka P.M. Application of rice and corn husk biochar for removal of heavy metal ions from industrial wastewater: Dissertation. NM-AIST. Aruska, Tanzania, 2020. 51 p. URL: www.dspace.nm-aist.ac.tz/handle/20.500.12479/968 (дата обращения 25.10.2023).
- Kwikima M.M., Chebude Y., Meshesha B.T. Kinetics, adsorption isotherms, thermodynamics, and desorption studies of cadmium removal from aqueous solutions using bamboo sawdust/rice husk biochar // Biomass Conversion and Biorefinery. 2023. Vol. 13. Iss. 11. P. 9367-9379. DOI: 10.1007/s13399-022-03472-3
- Lala M.A., Ntamu T.E., Adesina O.A. et al. Adsorption of hexavalent chromium from aqueous solution using cationic modified rice husk: Parametric optimization via Taguchi design approach // Scientific African. 2023. Vol. 20. № e01633. DOI: 10.1016/j.sciaf.2023.e01633
- Peng Zhao, Zhanbin Huang, Ping Wang, An Wang. Comparative study on high-efficiency Pb(II) removal from aqueous solutions using coal and rice husk based humic acids // Journal of Molecular Liquids. 2023. Vol. 369. № 120875. DOI: 10.1016/j.molliq.2022.120875
- Putri S.E., Hasri, Side S. et al. Synthesis of Metasilicate Gel from Rice Husk and Its Application as Medium of Growth Single Crystal Calcium Tartrate Tetrahydrate (CaC4H4O6.4H2O) // Joint Conference on Green Engineering Technology & Applied Computing, 4-5 February 2019, Bangkok, Thailand. IOP Conference Series: Materials Science and Engineering, 2019. Vol. 551. № 012112. DOI: 10.1088/1757-899X/551/1/012112
- Raychaudhuri A., Behera M. Ceramic membrane modified with rice husk ash for application in microbial fuel cells // Electrochimica Acta. 2020. Vol. 363. № 137261. DOI: 10.1016/j.electacta.2020.137261
- Ababaii M.A., Gilani N., Pasikhani J.V. Modification of Rice Husk with Ultrasound-Assisted Inorganic Treatment and Its Application for Catalytic Hydrogen Production // BioEnergy Research. 2023. 11 p. DOI: 10.1007/s12155-023-10643-1
- Nandiyanto A.B.D., Ragadhita R., Girsang G.C.S. et al. Effect of palm fronds and rice husk composition ratio on the mechanical properties of composite-based brake pad // Moroccan Journal of Chemistry. 2022. Vol. 10. № 4. P. 663-677. DOI: 10.48317/IMIST.PRSM/morjchem-v10i4.34291
- Shukla N., Sahoo D., Remya N. Biochar from microwave pyrolysis of rice husk for tertiary wastewater treatment and soil nourishment // Journal of Cleaner Production. 2019. Vol. 235. P. 1073-1079. DOI: 10.1016/j.jclepro.2019.07.042
- Yisong Wang, He Jia, Peng Chen et al. Synthesis of La and Ce modified X zeolite from rice husk ash for carbon dioxide capture // Journal of Materials Research and Technology. 2020. Vol. 9. Iss. 3. P. 4368-4378. DOI: 10.1016/j.jmrt.2020.02.061
- Lazzari L.K., Zimmermann M.V.G., Perondi D. et al. Production of Carbon Foams from Rice Husk // Materials Research. 2019. Vol. 22. Suppl. 1. № e20190427. DOI: 10.1590/1980-5373-MR-2019-0427
- Daulay A., Andriayani, Marpongahtun, Gea S. Synthesis and application of silicon nanoparticles prepared from rice husk for lithium-ion batteries // Case Studies in Chemical and Environmental Engineering. 2022. Vol. 6. № 100256. DOI: 10.1016/j.cscee.2022.100256
- Hiroyuki Muramatsu, Yoong Ahm Kim, Kap-Seung Yang et al. Rice Husk-Derived Graphene with Nano-Sized Domains and Clean Edges // Small. 2014. Vol. 10. Iss. 14. P. 2766-2770. DOI: 10.1002/smll.201400017
- Adam F., Appaturi J.N., Thankappan R., Nawi M.A.M. Silica–tin nanotubes prepared from rice husk ash by sol–gel method: Characterization and its photocatalytic activity // Applied Surface Science. 2010. Vol. 257. Iss. 3. P. 811-816. DOI: 10.1016/j.apsusc.2010.07.070
- Khan K., Ullah M.F., Shahzada K. et al. Effective use of micro-silica extracted from rice husk ash for the production of high-performance and sustainable cement mortar // Construction and Building Materials. 2020. Vol. 258. № 119589. DOI: 10.1016/j.conbuildmat.2020.119589
- Rajanna S.K., Kumar D., Vinjamur M., Mukhopadhyay M. Silica Aerogel Microparticles from Rice Husk Ash for Drug Delivery // Industrial & Engineering Chemistry Research. 2015. Vol. 54. Iss. 3. P. 949-956. DOI: 10.1021/ie503867p
- Olugbemide A.D., Likozar B. Assessment of Liquid and Solid Digestates from Anaerobic Digestion of Rice Husk as Potential Biofertilizer and Nutrient Source for Microalgae Cultivation // Processes. 2022. Vol. 10. Iss. 5. № 1007. DOI: 10.3390/pr10051007
- Tien-Duc Pham, Thi-Mai-Anh Le, Thi-My-Quynh Pham et al. Synthesis and Characterization of Novel Hybridized CeO2@SiO2 Nanoparticles Based on Rice Husk and Their Application in Antibiotic Removal // Langmuir. 2021. Vol. 37. Iss. 9. P. 2963-2973. DOI: 10.1021/acs.langmuir.0c03632
- Khu Le Van, Thuy Luong Thi Thu. Preparation of Pore-Size Controllable Activated Carbon from Rice Husk Using Dual Activating Agent and Its Application in Supercapacitor // Journal of Chemistry. 2019. Vol. 2019. № 4329609. DOI: 10.1155/2019/4329609
- Kamari S., Ghorbani F. Extraction of highly pure silica from rice husk as an agricultural by-product and its application in the production of magnetic mesoporous silica MCM–41 // Biomass Conversion and Biorefinery. 2021. Vol. 11. Iss. 6. P. 3001-3009. DOI: 10.1007/s13399-020-00637-w
- Giraldo S., Robles I., Ramirez A. et al. Mercury removal from wastewater using agroindustrial waste adsorbents // SN Applied Sciences. 2020. Vol. 2. Iss. 6. № 1029. DOI: 10.1007/s42452-020-2736-x
- Al-Yaari M., Saleh T.A. Mercury Removal from Water Using a Novel Composite of Polyacrylate-Modified Carbon // ACS omega. 2022. Vol. 7. Iss. 17. P. 14820-14831. DOI: 10.1021/acsomega.2c00274
- Nandiyanto A.B.D., Oktiani R., Ragadhita R. How to read and interpret FTIR spectroscope of organic material // Indonesian Journal of Science and Technology. 2019. Vol. 4. № 1. P. 97-118. DOI: 10.17509/ijost.v4i1.15806
- Tariq M., Durrani A.I., Farooq U., Tariq M. Efficacy of spent black tea for the removal of nitrobenzene from aqueous media // Journal of Environmental Management. 2018. Vol. 223. P. 771-778. DOI: 10.1016/j.jenvman.2018.06.080
- Rengga W.D.P., Sediawan W.B., Imani N.A.C. et al. Adsorption Studies of Rice Husk-Based Silica/Carbon Composite // EKSAKTA: Journal of Sciences and Data Analysis. 2020. Vol. 1. Iss. 2. P. 98-104. DOI: 10.20885/EKSAKTA.vol1.iss2.art1
- Xiaoli Guo, Menghong Li, Aijv Liu et al. Adsorption Mechanisms and Characteristics of Hg2+ Removal by Different Fractions of Biochar // Water. 2020. Vol. 12. Iss. 8. № 2105. DOI: 10.3390/w12082105
- Tokay B., Akpınar I. A comparative study of heavy metals removal using agricultural waste biosorbents // Bioresource Technology Reports. 2021. Vol. 15. № 100719. DOI: 10.1016/j.biteb.2021.100719
- Gutierrez I.R. Evaluación de los cambios en los parámetros fisicoquímicos del suelo procedente de San Joaquín, Querétaro; después del tratamiento electrocinético para la remoción de mercurio: Tesis doctoral. Mexico: Centro de Investigación y Desarrollo Tecnológico en Electroquímica, 2015. URL: www.lareferencia.info/vufind/Record/MX_e7e02b542beacd21972161cd720c5b76 (дата обращения 25.10.2023).
- Songnan Li. Combustion synthesis of porous MgO and its adsorption properties // International Journal of Industrial Chemistry. 2019. Vol. 10. Iss. 1. P. 89-96. DOI: 10.1007/s40090-019-0174-7
- Jabar J.M., Odusote Y.A., Alabi K.A., Ahmed I.B. Kinetics and mechanisms of congo-red dye removal from aqueous solution using activated Moringa oleifera seed coat as adsorbent // Applied Water Science. 2020. Vol. 10. Iss. 6. № 136. DOI: 10.1007/s13201-020-01221-3
- Boulaiche W., Hamdi B., Trari M. Removal of heavy metals by chitin: equilibrium, kinetic and thermodynamic studies // Applied Water Science. 2019. Vol. 9. Iss. 2. № 39. DOI: 10.1007/s13201-019-0926-8
- Metz P.C. Total Scattering Analysis of Disordered Nanosheet Materials: A Thesis Submitted To The Faculty Of Alfred University In Partial Fulfillment Of The Requirements For The Degree Of Doctor Of Philosophy In Ceramic Engineering. New York: Alfred University, 2017. 157 p. URL: www.s3-eu-west-1.amazonaws.com/pfigshare-u-files/8231207/42017_Metz_Thesis_Final.pdf (дата обращения 25.10.2023).
- Yurdakal S., Garlisi C., Özcan L. et al. Chapter 4 – (Photo)catalyst Characterization Techniques: Adsorption Isotherms and BET, SEM, FTIR, UV–Vis, Photoluminescence, and Electrochemical Characterizations // Heterogeneous Photocatalysis. Elsevier, 2019. P. 87-152. DOI: 10.1016/B978-0-444-64015-4.00004-3
- Thommes M., Kaneko K., Neimark A.V. et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report) // Pure Applied Chemistry. 2015. Vol. 87. № 9-10. P. 1051-1069. DOI: 10.15.15/pac-2014-1117
- Kumar K.V., Gadipelli S., Wood B. et al. Characterization of the adsorption site energies and heterogeneous surfaces of porous materials // Journal of Materials Chemistry A. 2019. Vol. 7. Iss. 17. P. 10104-10137. DOI: 10.1039/C9TA00287A
- Kolar P., Jin H. Baseline characterization data for raw rice husk // Data in brief. 2019. Vol. 25. № 104219. DOI: 10.1016/j.dib.2019.104219
- Ahmaruzzaman M., Gupta V.K. Rice Husk and Its Ash as Low-Cost Adsorbents in Water and Wastewater Treatment // Industrial & Engineering Chemistry Research. 2011. Vol. 50. Iss. 24. P. 13589-13613. DOI: 10.1021/ie201477c
- Al-Yaari M., Saleh T.A., Saber O. Removal of mercury from polluted water by a novel composite of polymer carbon nanofiber: kinetic, isotherm, and thermodynamic studies // RSC Advances. 2021. Vol. 11. Iss. 1. P. 380-389. DOI: 10.1039/D0RA08882J
- Zili Tang, Hui Wu, Qingbo Wen, Liming Hu. Effect of Adsorbent Dosage to Adsorbate Concentration Ratio on the Adsorption of Cd(II) on Coal Gangue // Proceedings of the 8th International Congress on Environmental Geotechnics, 28 October – 1 November 2018, Hangzhou, China. Springer, 2019. Vol. 1. P. 428-435. DOI: 10.1007/978-981-13-2221-1_45
- Akpomie K.G., Eluke L.O., Ajiwe V.I.E., Alisa C.O. Attenuation Kinetics and Desorption Performance of artocarpus altilis Seed Husk for Co (II), Pb (II) and Zn (II) Ions // Iranian Journal of Chemistry and Chemical Engineering. 2018. Vol. 37. Iss. 3 (89). P. 171-186. DOI: 10.30492/IJCCE.2018.30205
- Syafiuddin A., Fulazzaky M.A. Decolorization kinetics and mass transfer mechanisms of Remazol Brilliant Blue R dye mediated by different fungi // Biotechnology Reports. 2021. Vol. 29. № e00573. DOI: 10.1016/j.btre.2020.e00573
- Jain N., Dwivedi M.K., Waskle A. Adsorption of Methylene Blue Dye from Industrial Effluents Using Coal Fly Ash // International Journal of Advanced Engineering Research and Science. 2016. Vol. 3. Iss. 4. P. 9-16.
- Dada A.O., Adekola F.A., Odebunmi E.O. et al. Two–three parameters isotherm modeling, kinetics with statistical validity, desorption and thermodynamic studies of adsorption of C(II) ions onto zerovalent iron nanoparticles // Scientific Reports. 2021. Vol. 11. № 1. № 16454. DOI: 10.1038/s41598-021-95090-8
- Ragadhita R., Nandiyanto A.B.D. How to Calculate Adsorption Isotherms of Particles Using Two-Parameter Monolayer Adsorption Models and Equations // Indonesian Journal of Science and Technology. 2021. Vol. 6. № 1. P. 205-234. DOI: 10.17509/ijost.v6i1.32354
- Alabbad E.A. Effect of Direct yellow 50 removal from an aqueous solution using nano bentonite; adsorption isotherm, kinetic analysis and thermodynamic behaviour // Arabian Journal of Chemistry. 2023. Vol. 16. Iss. 2. № 104517. DOI: 10.1016/j.arabjc.2022.104517
- Nandiyanto A.B.D. Isotherm Adsorption of Carbon Microparticles Prepared from Pumpkin (Cucurbita maxima) Seeds Using Two-Parameter Monolayer Adsorption Models and Equations // Moroccan Journal of Chemistry. 2020. Vol. 8. № 3. P. 745-761. DOI: 10.48317/IMIST.PRSM/morjchem-v8i3.21636
- Shikuku V.O., Mishra T. Adsorption isotherm modeling for methylene blue removal onto magnetic kaolinite clay: a comparison of two-parameter isotherms // Applied Water Science. 2021. Vol. 11. Iss. 6. № 103. DOI: 10.1007/s13201-021-01440-2
- Dada A.O., Ojedira J.O., Okunola A.A. et al. Modeling of Biosorption of Pb(II) and Zn(II) Ions onto PAMRH: Langmuir, Freundlich, Temkin, Dubinin – Raduskevich, Jovanovic, Flory – Huggins, Fowler – Guggenheim and Kiselev Comparative Isotherm Studies // International Journal of Mechanical Engineering and Technology. 2019. Vol. 10. Iss. 2. P. 1048-1058.
- Yousef N.S., Farouq R., Hazzaa R. Adsorption kinetics and isotherms for the removal of nickel ions from aqueous solutions by an ion-exchange resin: application of two and three parameter isotherm models // Desalination and Water Treatment. 2016. Vol. 57. Iss. 46. P. 21925-21938.
- Yao Huang, Siyu Xia, Jingjing Lyu, Jingchun Tang. Highly efficient removal of aqueous Hg2+ and CH3Hg+ by selective modification of biochar with 3-mercaptopropyltrimethoxysilane // Chemical Engineering Journal. 2019. Vol. 360. P. 1646-1655. DOI: 10.1016/j.cej.2018.10.231
- Irwansyah F.S., Amal A.I., Diyanthi E.W. et al. How to Read and Determine the Specific Surface area of Inorganic Materials Using the Brunauer – Emmett – Teller (BET) Method // ASEAN Journal of Science and Engineering. 10 p. URL: www.ejournal.upi.edu/index.php/AJSE/article/view/60748 (Online First) (дата обращения 25.10.2023).
- Sukamto S., Rahmat A. Evaluation of FTIR, Macro and Micronutrients of Compost from Black Soldier Fly Residual: in Context of Its Use as Fertilizer // ASEAN Journal of Science and Engineering. 2023. Vol. 3. № 1. P. 21-30. DOI: 10.17509/ajse.v3i1.42798
- Fatimah S., Ragadhita R., Husaeni D.F.A, Nandiyanto A.B.D. How to Calculate Crystallite Size From X-Ray Diffraction (XRD) Using Scherrer Method // ASEAN Journal of Science and Engineering. 2022. Vol. 2. № 1. P. 65-76. DOI: 10.17509/ajse.v2i1.37647
