Влияние осаждения ярозита на баланс железа при кучном биологическом выщелачивании на медном руднике Монива
- 1 — канд. техн. наук Ключевая лаборатория экологических процессов и инженерии Китайской академии наук, Институт проектирования технологических процессов, Китайская академия наук ▪ Orcid
- 2 — д-р техн. наук Ключевая лаборатория экологических процессов и инженерии Китайской академии наук, Институт проектирования технологических процессов, Китайская академия наук ▪ Orcid
- 3 — д-р техн. наук Ключевая лаборатория экологических процессов и инженерии Китайской академии наук, Институт проектирования технологических процессов, Китайская академия наук ▪ Orcid
- 4 — старший научный сотрудник Ключевая лаборатория экологических процессов и инженерии Китайской академии наук, Институт проектирования технологических процессов, Китайская академия наук ▪ Orcid
- 5 — управляющий директор «Myanmar Yangtse Cooper Ltd» Wanbao Mining Ltd ▪ Orcid
- 6 — генеральный директор «Myanmar Wanbao Mining Ltd» Wanbao Mining Ltd ▪ Orcid
- 7 — head of Engineering Department Wanbao Mining Ltd ▪ Orcid
- 8 — старший научный сотрудник Государственная ключевая лаборатория биохимической инженерии, Институт проектирования технологических процессов, Китайская академия наук ▪ Orcid
Аннотация
Трехвалентное железо является важным окислителем при биологическом выщелачивании сульфидных руд. Однако рециркуляция выщелачивающих растворов приводит к избыточному накоплению железа, что мешает кинетике выщелачивания и последующему извлечению металла. Авторами статьи был разработан метод контроля осаждения железа в виде ярозита для уменьшения избытка железа при кучном биологическом выщелачивании на медном руднике Монива. Осаждение ярозита было сначала смоделировано, а затем подтверждено с помощью испытаний в колонках периодического действия. По результатам моделирования, минимальные значения pH для осаждения ярозита калия, гидрониум- и натроярозита при 25 °С составляют 1,4, 1,6 и 2,7 соответственно; минимальные концентрации ионов калия, сульфатов, железа и натрия при 25 °С и pH 1,23 составляют 1 моль/м3, 0,54, 1,1 и 3,2 кмоль/м3 соответственно. Колоночные эксперименты показывают, что осаждение ярозита калия является первостепенным по сравнению с осаждением натроярозита. Кроме того, понижение кислотности (с 12 до 8 г/л), повышение температуры (с 30 до 60 °С) и повышение концентрации ионов калия (с 0 до 5 г/л) увеличивают эффективность осаждения ярозита в 10, 5 и 6 раз соответственно. Наилучшие показатели осаждения ярозита достигаются при увеличении pH промывочного раствора до 1,6. Ожидается, что данный подход сократит эксплуатационные затраты на кучное биологическое выщелачивание за счет минимизации расхода химикатов на нейтрализацию, отсутствия необходимости в строительстве прудов-отстойников и повышения извлечения меди.
Введение. Медный рудник Монива (Мьянма) – второй по величине источник меди в Юго-Восточной Азии; основным медьсодержащим минералом является растворимый в кислоте и поддающийся биологическому выщелачиванию халькоцит (Cu2S) [18, 20, 32]. Содержание пирита (FeS2) в руде относительно высокое, в среднем около 13 % [7, 15]. При окислении пирита образуются серная кислота и растворимое железо. За счет рециркуляции раствора это приводит к тому, что со временем концентрация кислоты и железа в выщелачивающем растворе увеличивается [5]. Данное увеличение концентрации железа в растворе снижает эффективность и стабильность извлечения меди путем электролиза [13, 23], препятствуя достижению плановых показателей [9]. В частности, увеличение концентрации трехвалентного железа в насыщенном выщелачивающем растворе (НВР) влияет на селективность экстракции [27, 30, 31]. Кроме того, избыток железа снижает выход по току, увеличивает потребление энергии и меняет морфологию поверхности катодной меди при электролизе. Избыток железа обычно удаляют путем слива медьсодержащего электролита в отходы и замены его серной кислотой [29]. Щелочные вещества (например, Ca(OH)2 и NaOH) обычно используются для нейтрализации удаленного кислого раствора, богатого железом, а трехвалентное железо осаждается в виде гидроксида железа (III), который прессуется и фильтруется до получения сухого кека или хранится в прудах-отстойниках [16]. На медном руднике Цзыцзиньшань (Zijinshan) избыток кислого раствора железа (III) нейтрализуется известью, стоимость которой составляет более 1000 долларов США на тонну меди [17, 19]. Обезвоживание гидроксида железа (III) затруднено, поэтому для хранения осадков требуются большие площади. Высокая ионная сила раствора НВР увеличивает расход нейтрализующих химикатов и приводит к образованию труднофильтруемых коллоидных веществ [19].
Осаждение ярозита (с общей формулой AFe3(SO4)2(OH)6, где A представляет собой одновалентный катион, такой как K+, Na+, NH+4 или H3O+), широко используется в гидрометаллургической промышленности для удаления железа, сульфатов и щелочных металлов. К преимуществам осаждения ярозита можно отнести хорошую фильтруемость и осаждаемость осадков с небольшими потерями ценных двухвалентных металлов [2, 10, 11]. В системах кучного выщелачивания широко распространено образование вторичных минералов железа, таких как ярозит [3, 8]. Ярозит выпадает в осадок в рудном штабеле, что приводит к снижению концентрации трехвалентного железа в выщелачивающем растворе [6, 28]. Удаление избыточного железа с помощью осаждения ярозита вместо гидроксида может снизить стоимость химикатов, используемых для нейтрализации кислоты [12]. Для этого важно контролировать осаждение ярозита во время кучного биологического выщелачивания. Однако условия, способствующие осаждению ярозита во время кучного биологического выщелачивания, полностью не изучены. В этой статье исследованы ключевые факторы, влияющие на кинетику осаждения ярозита при кучном биологическом выщелачивании сульфидной медной руды на медном руднике Монива. Основная цель этой работы – облегчить процесс удаления избытка железа путем осаждения ярозита. Для моделирования условий кучного биологического выщелачивания проводились колоночные эксперименты.
Материалы и методы. Пробы руды и раствора. Колоночные эксперименты проводились на низкосортной сульфидной руде из медного рудника Монива. Размер частиц руды P80 (прохождение 80 %) 10 мм. Содержание основных элементов в пробах руды было проанализировано с использованием ранее описанных методов [25] (табл.1). Среднее содержание пирита составляло 14,6 %.
Таблица 1
Содержание основных компонентов в пробах руды
| Проба руды | Элементарный состав, % по массе | |||
| Cu | CNsCu* | Fe | S | |
| I | 0,24 | 0,23 | 6,87 | – |
| II | 0,54 | 0,52 | 7,71 | 9,24 |
| III | 0,48 | 0,43 | 7,84 | 9,41 |
| IV | 0,44 | 0,42 | 5,02 | – |
Рафинаты, раствор после извлечения меди и промежуточный выщелачивающий раствор (ПВР) собирались из системы производства меди, химический состав рафинатов приведен в табл.2. Химический состав промежуточного выщелачивающего раствора: ОВП (по сравнению с Ag/AgCl) 526 мВ; pH 1,23. Элементарный состав, г/л: Fe 31,35; Cu 2,42; Ca 0,51; Mg 4,15; K 0,0039; Na 0,087; Al 12,78; Mn 1,73; SO2-4 157,44; Cl- 2,26. Окислительно-восстановительные потенциалы (ОВП) образцов рафинатов составляли 493-553 мВ (по сравнению с Ag/AgCl), а значения pH варьировались от 0,99 до 1,67. Наибольшая концентрация железа в образцах рафинатов составила 40 г/л, концентрация сульфатов в ПВР достигла 157 г/л. Расчетная ионная сила ПВР составила примерно 8,5 моль/кг. Однако концентрации калия и натрия были очень низкими, что неблагоприятно для осаждения ярозита калия и натроярозита. Термодинамика осаждения ярозита моделировалась на основе свойств ПВР с использованием программного обеспечения Medusa (Королевский технологический институт, Швеция) [33].
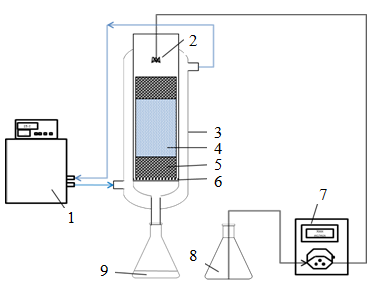
Таблица 2
Химический состав рафинатов
| Образцец рафината | ОВП (по сравнению с Ag/AgCl), мВ | pH | Элементарный состав, г/л | ||||
| Cu | Fe | Fe2+ | Fe3+ | Кислота | |||
| I | 553 | 1,23 | 0,95 | 32,08 | 1,21 | 30,87 | 10,28 |
| II | 497 | 0,99 | 0,79 | 18,27 | 1,26 | 17,01 | 18,53 |
| III | 493 | 1,38 | 1,26 | 40,32 | 4,45 | 35,87 | 12,35 |
| IV | 534 | 1,67 | 1,34 | 36,99 | 1,50 | 35,49 | 11,32 |
Колоночные эксперименты по осаждению ярозита. Эксперименты по колонному выщелачиванию проводились для моделирования осаждения ярозита при кучном биологическом выщелачивании. Схема эксперимента представлена на рис.1. Использовались стеклянные колонки высотой 20 и диаметром 5 см. Температура колонок контролировалась с помощью системы изотермической циркуляционной водяной бани. Каждая колонка заполнялась 600 г руды, которая смачивалась рафинатом со скоростью потока 0,2 мл/мин. Эксперименты по осаждению ярозита проводились в различных рабочих условиях с использованием различных одновалентных катионов Na+, K+, температурой реакции 30-60 0С, кислотностью раствора 8-16 г/л и концентрацией K+ 0-5 г/л, (табл.3). Ирригационные растворы с одновалентными катионами (Na+ или K+) были приготовлены путем добавления в рафинат сульфата натрия, сульфата калия или хлорида калия. Кислотность ирригационного раствора регулировали за счет добавления карбоната кальция или серной кислоты.
Таблица 3
Условия колоночных экспериментов
| Колонка | Проба руды | Проба раствора рафината | Ирригационный раствор | Температура, 0С | |||
| Na+, г/л | K+, г/л | pH | Кислотность, г/л | ||||
| 1 | I | I | 2 | – | 1,23 | 10,3 | 35 |
| 2 | I | I | – | 2 | 1,23 | 10,3 | 35 |
| 3 | I | I | – | – | 1,23 | 10,3 | 35 |
| 4 | II | II | – | – | 0,99 | 18,5 | 30 |
| 5 | II | II | – | – | 0,99 | 18,5 | 45 |
| 6 | II | II | – | – | 0,99 | 18,5 | 60 |
| 7 | III | III | – | 2 | 1,43 | 8 | 27 |
| 8 | III | III | – | 2 | 1,38 | 12 | 27 |
| 9 | III | III | – | 2 | 1,32 | 16 | 27 |
| 10 | IV | IV | – | 0 | 1,67 | 11,3 | 27 |
| 11 | IV | IV | – | 1 | 1,67 | 11,3 | 27 |
| 12 | IV | IV | – | 5 | 1,67 | 11,3 | 27 |
В ходе экспериментов образцы растворов ежедневно отбирались для анализа из контейнеров с насыщенным выщелачивающим раствором. Окислительно-восстановительный потенциал раствора измеряли с помощью платинового кольцевого электрода с комбинированным хлоридсеребряным (Ag/AgCl) электродом сравнения (3 моль/л KCl); pH определяли с помощью pH-метра (SevenGo Pro, Mettler Toledo, Швейцария). Концентрацию кислоты и Fe2+ определяли путем титрования раствором гидроксида натрия (NaOH) и дихромата калия (K2Cr2O7) соответственно. Концентрации растворимых ионов общего Fe (TFe), Cu2+, K+ и Na+ измеряли с помощью атомно-абсорбционного спектрофотометра (ААС). Растворимые ионы серы измеряли с помощью анализатора углерода и серы (HSC, Keguo, Китай). После завершения выщелачивания остатки руды промывали раствором с содержанием серной кислоты 5 г/л, выгружали из колонки и сушили в печи при 50 0С. Сухой остаток дробили и измельчали до размера менее 74 мкм и анализировали на содержание Cu, Fe, S, S2-, K и Na, как описано ранее [25]. Выход выщелачивания меди рассчитывался исходя из объема и концентрации в исходном растворе и в выщелачивателе: P = Cвыщ Vвыщ – Cисх Vисх, где P – выход; Cвыщ – концентрация в выщелачивателе; Vвыщ – объем выщелачивателя; Cисх – концентрация в исходном растворе; Vисх – объем исходного раствора.
Общий выход меди, железа и кислоты при биологическом выщелачивании измерялся как суточный объем их выхода. Если выход имел отрицательное значение, то результат приравнивался к чистому потреблению меди, железа и кислоты.
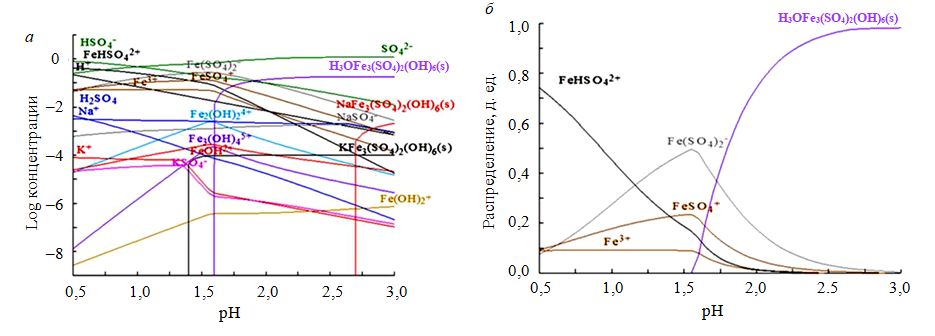
Результаты и обсуждение. Термодинамическое моделирование осаждения ярозита. Термодинамика осаждения ярозита была смоделирована на основе свойств ПВР. Поскольку pH ПВР был менее 2, осаждение гидроксида железа не принималось во внимание [4]. Возможные химические реакции трехвалентного железа в системе выщелачивания представлены в табл.4. Результаты расчетов равновесия реакции показаны на рис.2, а, отражающем влияние pH на осаждение ярозита. Минимальный pH, при котором происходит осаждение ярозита, заметно отличается для разных одновалентных катионов. При температуре 25 0С ярозит калия осаждается при pH ≥ 1,4, тогда как осаждение гидрониумярозита происходит только при значениях pH > 1,6; минимальный pH для осаждения натроярозита составляет 2,7. Следовательно, осаждение ярозита калия ожидается при более низком pH, а осаждение гидрониумярозита, а затем и натроярозита будет увеличиваться с ростом pH. Полученные результаты согласуются с результатами прошлых исследований [1, 2]. Более того, первоочередность осаждения ярозита калия ожидаема еще потому, что свободная энергия Гиббса образования вещества следует порядку K+> Na+> H3O+> [14].
Принимая во внимание описанные выше значения pH, необходимые для осаждения ярозита калия, гидрониум- и натроярозита в растворе ПВР при 25 0С, проведенное термодинамическое моделирование показало, что ярозит не может образовываться из раствора ПВР при 25 0С, учитывая низкий pH = 1,23. Из-за низкой концентрации калия и натрия в ПВР гидрониумярозит, вероятно, станет доминирующей формой ярозита с pH выше 1,6 (рис.2, б). Образование гидрониумярозита снизит концентрацию железа и приведет к образованию кислоты.
Таблица 4
Химические реакции в системе Fe3+–M–SO2-4–H2O (M = K+, Na+, NH+4, H3O+) [22]
| Химические реакции | Log K |
| Fe3+ + 2H2O <=> 2H+ + Fe(OH)+2 | −5,67 |
| Fe3+ + 3H2O <=> 3H+ + Fe(OH)3 | −12,56 |
| Fe3+ + 4H2O <=> 4H+ + Fe(OH)2+4 | −21,6 |
| Fe3+ + 2SO2-4 <=> Fe(SO4)-2 | 5,38 |
| 2Fe3+ + 2H2O <=> 2H+ + Fe(OH)4+2 | 2,95 |
| 3Fe3+ 4H2O <=> 4H+ + Fe3(OH)3+4 | −6,3 |
| H+ + Fe3+ + SO2-4 <=> FeHSO2+4 | 4,468 |
| Fe3+ H2O <=> H+ + FeOH2+ | −2,19 |
| Fe3+ + SO2-4 <=> FeSO+4 | 4,04 |
| 2H+ + SO2-4 <=> H2SO4 | 0,0 |
| H+ + SO2-4 <=> HSO-4 | 1,98 |
| K+ + H2O <=> H+ + KOH | −14,46 |
| K+ + SO2- <=> KSO-4 | 0,85 |
| Na+ + H2O <=> H+ + NaOH | −14,18 |
| Na+ + SO2-4 <=> NaSO-4 | 0,7 |
| H2O <=> H+ + OH- | −14,0 |
| 3Fe3+ + 2SO2-4 + 7H2O <=> 5H+ + H3OFe3(SO4)2(OH)6(s) | 5,39 |
| K+ + 3Fe3+ + 2SO2-4 + 6H2O<=> 6H+ + KFe3(SO4)2(OH)6(s) | 9,21 |
| Na+ + 3Fe3+ + 2SO2-4 + 6H2O <=> 6H+ + NaFe3(SO4)2(OH)6(s) | 5,28 |
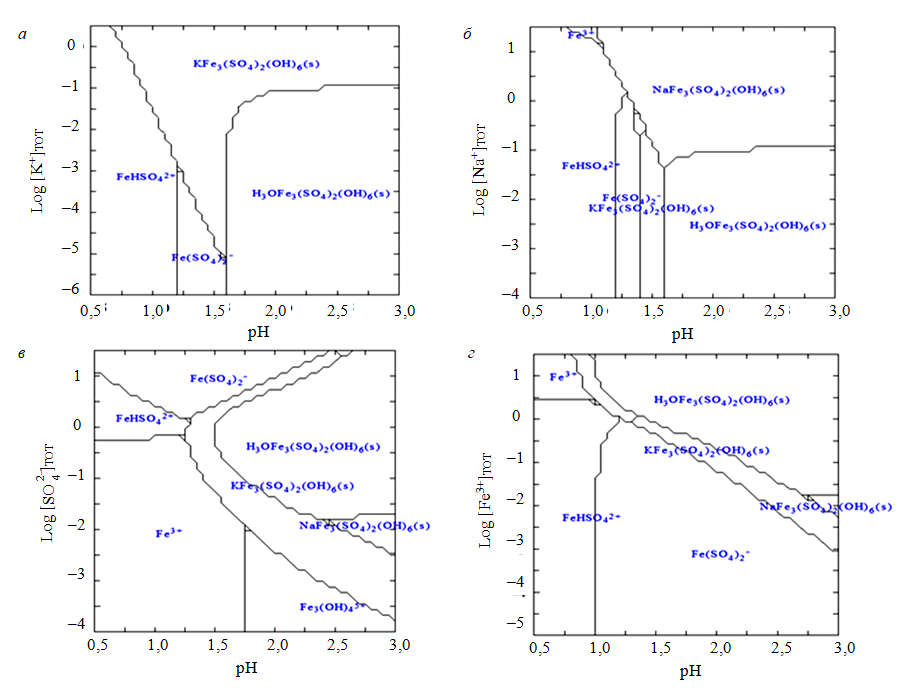
Графики преобладающих областей системы Fe3+–M–SO2-4–H2O в зависимости от pH и концентраций K+, Na+, Fe3+ и SO2-4 показаны на рис.3. Как видно из рис.3, а, ярозит калия может образовываться в ПВР, если концентрация K+ увеличивается до 1 моль/м3 (ммоль/л). Минимальные значения pH для осаждения ярозита калия и натроярозита уменьшаются по мере увеличения концентраций K+ и Na+ соответственно (рис.3, а, б). В условиях кислотности ПВР натроярозит может образовываться, если концентрация Na+ увеличивается до 3,2 кмоль/м3 (моль/л). Если pH ПВР более 1,6, необходимо всего 44 моль/м3 Na+ чтобы вызвать осаждение натроярозита. Увеличение концентрации может снизить минимальный pH, необходимый для образования ярозита калия, гидрониум- и натроярозита (рис.3, в). Однако, когда концентрация превышает 0,54 кмоль/м3, минимальные значения pH для образования ярозита калия и гидрониумярозита увеличиваются с ростом концентрации. Следовательно уменьшение концентрации в ПВР с 1,6 до 0,54 кмоль/м3 будет способствовать образованию ярозита калия и гидрониумярозита. Минимальные значения pH, необходимые для образования ярозита калия, гидрониум- и натроярозита, могут быть уменьшены путем увеличения концентрации Fe3+ (рис.3, г). Ярозит калия и гидрониумярозит могут образоваться, если концентрации Fe3+ в ПВР увеличиваются до 1,1 и 2,1 кмоль/м3 соответственно. Однако для производственных систем это может быть нецелесообразным без разработки высокоселективного экстрагента.
Термодинамическое моделирование показывает, что состав ПВР можно регулировать способствуя осаждению ярозита. Повышение концентрации K+ является важным фактором, способствующим образованию ярозита в условиях высокой кислотности, что благоприятно сказывается на растворении халькоцита. Содействие осаждению гидрониум- и натроярозита потребует увеличения pH ПВР и нейтрализации свободной кислоты. Данное термодинамическое моделирование проводилось при 25 0C, но реальные штабеля руды для биологического выщелачивания могут иметь температурный градиент [26]. Следовательно, в дальнейших исследованиях при термодинамическом моделировании следует учитывать влияние температуры. Кроме того, поскольку на некоторых рудниках из-за использования взрывчатых веществ или в качестве добавки к питательной среде для биологического выщелачивания может присутствовать аммоний, следует оценить присутствие аммония в выщелачивающих растворах и возможность образования аммониоярозита.
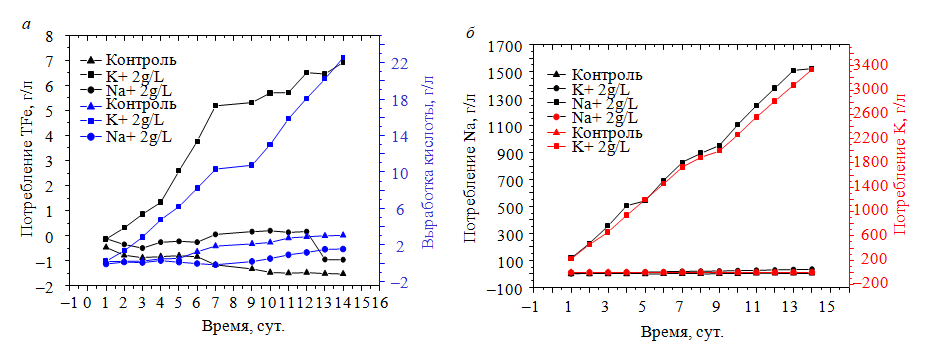
Влияние одновалентных катионов. Влияние одновалентных катионов K+, Na+ на образование ярозита было изучено в ходе колоночных экспериментов с использованием образца I и рафината I при pH 1,23 и 35 0С. В раствор рафината добавляли 2 г/л K+ (в виде сульфата калия) или Na+ (в виде сульфата натрия) перед его использованием для орошения колонок. Третью колонку, без добавления K+ или Na+, использовали в качестве контрольной. Согласно потреблению железа и выработке кислоты, скорость осаждения ярозита калия была выше, чем у натроярозита (рис.4, а). Расход ионов K и Na был почти линейным (рис.4, б), это указывает на то, что со временем скорость осаждения ярозита калия и натроярозита существенно не снижалась. Однако более высокий расход ионов K по сравнению с ионами Na еще раз подтвердил, что эффективность осаждения ярозита калия выше, чем у натроярозита. Химическая реакция осаждения натроярозита имеет следующий вид [21]:
Согласно реакции натроярозита, 1 г натрия может осадить в виде ярозита примерно 7 г железа и 8 г сульфата. Для 1 г калия соответствующие значения составляют 4 г железа и 5 г сульфата.
Осадок из колонки с рафинатом, обогащенным K+, был более желтым, чем осадки из колонки с добавлением Na+ и контрольной колонки. На основании анализа осадков (табл.5) можно сказать, что содержание меди в осадках из колонок с рафинатами, обогащенными одновалентными катионами, было ниже, а общее содержание железа и восстановленной серы – выше, чем в контрольной колонке. Это указывает на то, что добавление K+ и Na+ способствует осаждению ярозита, не только удаляя из раствора избыточное железо и сульфаты, но также ускоряя выщелачивание меди из халькоцита и уменьшая окисление пирита.
Таблица 5
Химический состав осадков и выщелачивание меди
| Условия испытания | Вес осадка, кг | Элементарный состав, % | Выщелачивание меди, % | |||
| Всего Cu | Всего Fe | Всего серы | Восстановленная сера | |||
| Контроль | 0,589 | 0,14 | 4,74 | 11,70 | 8,89 | 40,0 |
| Na+, 2 г/л | 0,623 | 0,12 | 5,17 | 10,53 | 9,14 | 47,9 |
| K+, 2 г/л | 0,690 | 0,13 | 5,90 | 12,33 | 10,28 | 46,1 |
Влияние температуры реакции. Влияние температуры на образование ярозита было исследовано с помощью колоночных экспериментов с использованием пробы руды II и рафината II (pH 0,99) при температуре 30, 45 и 60 0C. В рафинат не добавляли никаких одновалентных катионов. Общее потребление растворимого железа TFe и выработка кислоты во время колонного выщелачивания заметно увеличились с повышением температуры (рис.5, а). Осадки, образовавшиеся при 45 и 60 °С, были более желтыми, чем те, которые образовались при 30 °С. Желтые осадки были идентифицированы как ярозит калия с помощью рентгенодифракционного анализа (XRD) [25]. Результаты подтверждают, что повышение температуры может способствовать осаждению ярозита.
Влияние кислотности растворов. Влияние кислотности на осаждение ярозита было исследовано с помощью колоночных экспериментов с использованием образца руды III и рафината III при 27 0С. Кислотность ирригационных растворов была доведена до 8, 12 и 16 г/л путем добавления карбоната кальция и серной кислоты. В ирригационный раствор было добавлено 2 г/л K+ (в виде хлорида калия). Кислотность ирригационного раствора в процессе выщелачивания представлена на рис.5, г. Результаты показывают, что снижение кислотности ирригационного раствора усиливает осаждение ярозита, на что указывают повышенные потребление общего растворимого железа и выработка кислоты (рис.5, б), что согласуется с более ранними исследованиями [24]. Более того, концентрация ионов калия в выщелачивающем растворе в условиях низкой кислотности была заметно ниже, чем при высокой (рис.5, г), а расход K+ повышался с понижением кислотности (табл.6). Вес всех осадков был выше первоначального веса исходной руды вследствие накопления ярозита в колонках. Максимальный вес наблюдался в колонке, работавшей при более низкой кислотности (табл.7), что соответствует самому высокому потреблению общего растворимого железа (рис.5, б). Содержание железа, натрия и калия в осадке было намного выше, чем в сырой руде, что снова указывает на осаждение и накопление ярозита в колонках с течением времени (табл.7). Содержание натрия в осадке было самым высоким для колонки, работавшей при самой низкой кислотности (8 г/л), что указывает на благоприятное влияние низкой кислотности на осаждение натроярозита; содержание калия в осадке было самым высоким для колонки, работавшей при умеренной кислотности (12 г/л).
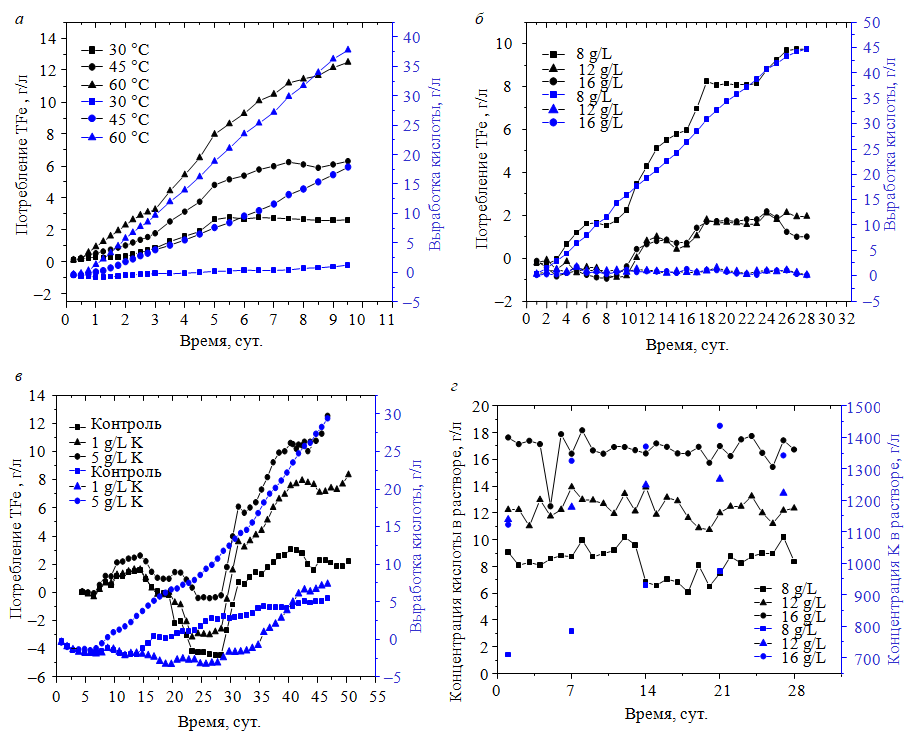
Таблица 6
Потребление ионов калия в растворе после 28-дневного колонного выщелачивания руды III рафинатом III, приведенным к разным значениям кислотности
| Кислотность, г/л | Средняя концентрация K в выщелачивателе, мг/л | Суммарный объем выщелачивающего раствора, л | Потребление ионов K, г |
| 8 | 844 | 8195 | 9,47 |
| 12 | 1211 | 8085 | 6,37 |
| 16 | 1320 | 7445 | 5,06 |
Таблица 7
Химический состав исходной руды и осадков после 28-дневного колонного выщелачивания руды III рафинатом III, приведенным к разным значениям кислотности
| Пробы | Вес руды, г | Элементарный состав | |||
| Cu, % | Fe, % | Na, мг/кг | K, мг/кг | ||
| Исходная руда | 600 | 0,48 | 7,84 | 793 | 1586 |
| Осадок после выщелачивания, г/л | |||||
| при кислотности 8 | 709 | 0,09 | 12,84 | 1083 | 6875 |
| при кислотности 12 | 668 | 0,10 | 13,47 | 887 | 8875 |
| при кислотности 16 | 686 | 0,08 | 11,66 | 923 | 3690 |
Влияние концентрации ионов калия. Влияние концентрации K+ на образование ярозита было исследовано с помощью колоночных экспериментов с использованием пробы IV и рафината IV при 27 0С. В ирригационный раствор добавляли 0,1 или 5 г/л K+ (в виде сульфата калия). Увеличение концентрации ионов калия привело к росту потребления общего растворимого железа и выработки кислоты (рис.5, в). Вес осадка после выщелачивания с размером частиц менее 74 мкм увеличивался с ростом концентрации ионов калия в рафинате. Содержание железа, калия и общей серы во фракции осадка с размером частиц менее 74 мкм также увеличивалось с ростом концентрации ионов калия в рафинате, как показано в табл.8. Это указывает на то, что осаждение ярозита увеличивается с повышением концентрации ионов калия в рафинате.
Таблица 8
Химический состав осадка с размером частиц +74 мкм и –74 мкм после колонного выщелачивания пробы руды IV рафинатом IV с добавлением 0 (контроль), 1 или 5 г/л K+
| Количество K+ добавленного к рафинату, г/л | Размер зерен, мкм | Элементарный состав | ||||
| Cu, % | Fe, % | K, мг/кг | S, % | S2-, % | ||
| 0 | +74 | 0,05 | 5,38 | 0,1 | 8,19 | 7,88 |
| –74 | 0,05 | 4,12 | 0,03 | 6,05 | 5,24 | |
| 1 | +74 | 0,05 | 5,72 | < 0,01 | 8,37 | 7,68 |
| –74 | 0,05 | 11,19 | 1,57 | 9,05 | 5,76 | |
| 5 | +74 | 0,06 | 7,27 | 0,45 | 9,02 | 7,55 |
| –74 | 0,05 | 11,19 | 3,16 | 10,55 | 5,28 | |
Применение кучного биологического выщелачивания на медном руднике Монива. Результаты этого исследования показывают, что возможность удаления железа из ПВР посредством образования ярозита ограничивается низкой концентрацией одновалентных катионов. Однако добавление одновалентных катионов (Na и K) вместе с нейтрализацией свободной кислоты способствует образованию ярозита калия, гидрониум- и натроярозита для удаления из раствора избыточного железа. По предположению авторов, добавление ионов калия является более предпочтительным, поскольку образование ярозита калия происходит при более низких значениях pH, чем образование гидрониум- и натроярозита. Когда кислотность нейтрализующего раствора высока, потери ионов меди можно не учитывать. Однако при 25 0С и pH 1,5 для образования ярозита калия в ПВР необходима концентрация Fe 49 г/л.
Устойчивость ярозита зависит от кислотности раствора, однако кислотность выщелачивающего раствора варьируется. Поэтому предлагается использовать отработанный штабель руды для облегчения удаления железа путем осаждения ярозита. После осаждения ярозита штабель можно «запечатать», чтобы гарантировать стабильность выпавшего в осадок ярозита. Мелкие частицы ярозита могут прилипать к поверхности крупных частиц руды и откладываться в поровых пространствах, уменьшая пористость кучи и перекрывая доступ кислорода. В результате предполагается снижение активности микробного окисления двухвалентного железа, что приведет к снижению окислительно-восстановительного потенциала выщелачивающего раствора. Ожидается, что использование предлагаемого подхода поможет достигнуть баланса между железом и кислотой при кучном биологическом выщелачивании на медном руднике Монива, уменьшив избыток кислоты и высвобождение железа. Более того, ожидается, что такой подход к оптимизации баланса железа и кислоты снизит эксплуатационные затраты на кучное биологическое выщелачивание за счет снижения стоимости химикатов, необходимых для нейтрализации, отсутствия необходимости в строительстве прудов-отстойников и увеличения извлечения меди.
Выводы. Рециркуляция выщелачивающих растворов в ходе кучного биологического выщелачивания приводит к накоплению избыточного железа, что мешает кинетике выщелачивания и последующему извлечению металлов. Образование ярозита было предложено в качестве альтернативного подхода к удалению избыточного железа из выщелачивающих растворов, но факторы, влияющие на образование ярозита при кучном биологическом выщелачивании, еще полностью не изучены. В данной работе исследованы ключевые факторы, влияющие на кинетику осаждения ярозита при кучном биологическом выщелачивании сульфидной медной руды на медном руднике Монива. Термодинамическое моделирование показывает, что кислотность раствора является ключевым фактором, влияющим на осаждение ярозита, а минимальные значения pH для осаждения ярозита калия, гидрониум- и натроярозита при 25 0С составляют 1,4, 1,6 и 2,7 соответственно. Следовательно, образование ярозита в растворе ПВР при 25 0С и pH 1,23 невозможно. Помимо этого, термодинамическое моделирование показывает, что увеличение концентрации одновалентных катионов, железа и сульфатов способствует осаждению ярозита, особенно в условиях высокой кислотности. Колоночные эксперименты демонстрируют, что уменьшение кислотности с 12 до 8 г/л, повышение температуры с 30 до 60 0С и добавление калия в рафинат повышают осаждение ярозита. Колоночные эксперименты также показывают, что в условиях исследования осаждение ярозита калия первостепенно по сравнению с осаждением натроярозита. Результаты показывают, что осаждение ярозита может быть осуществлено путем увеличения концентрации Na+ и K+ и нейтрализации свободной кислоты в рафинате.
Полученные результаты предполагают, что если способствовать осаждению ярозита в отработанном штабеле руды, то из раствора будут удалены не только избыток железа и сульфата, но также будет наблюдаться снижение окисления пирита, выделения кислоты и железа.
Данная работа дает новый взгляд на оптимизацию баланса железа и кислотности в операциях кучного биологического выщелачивания, в частности, на медном руднике Монива. Дальнейшая работа должна исследовать фактические профили температуры в биохранилищах и использовать термодинамическое моделирование для исследования влияния температуры на осаждение ярозита. Кроме того, следует оценить присутствие аммония в выщелачивающих растворах и возможность образования аммониоярозита.
Литература
- Kaksonen A.H., Morris C., Rea S. et al. Biohydrometallurgical iron oxidation and precipitation: Part I – Effect of pH on process performance. Hydrometallurgy. 2014. Vol. 147-148, p. 255-263. DOI: 10.1016/j.hydromet.2014.04.016
- Kaksonen A.H., Morris C., Rea S. et al. Biohydrometallurgical iron oxidation and precipitation. Part II: Jarosite precipitate characterisation and acid recovery by conversion to hematite. Hydrometallurgy. 2014. Vol. 147-148, p. 264-272. DOI: 10.1016/j.hydromet.2014.04.015
- Davis-Belmar C.S., Cautivo D., Demergasso C., Rautenbach G. Bioleaching of copper secondary sulfide ore in the presence of chloride by means of inoculation with chloride-tolerant microbial culture. Hydrometallurgy. 2014. Vol. 150, p. 308-312. DOI: 10.1016/j.hydromet.2014.09.013
- Brown J.B. Jarosite-geoethite stabilities at 25 C, 1 ATM. Mineralium Deposita. 1971. Vol. 6. Iss. 3, p. 245-252. DOI:10.1007/BF00208032
- Jia Y., Sun H., Chen D. et al. Characterization of microbial community in industrial bioleaching heap of copper sulfide ore at Monywa mine, Myanmar. Hydrometallurgy. 2016. Vol.164, p. 355-361. DOI: 10.1016/j.hydromet.2016.07.007
- Cogram P. Jarosite Reference Module in Earth Systems and Environmental Sciences. Elsevier Inc., 2018.
- Zaw K., Swe Y., Myint T., Knight J. Copper deposits of Myanmar. Memoirs. 2017. Vol. 48, p. 573-588. DOI:10.1144/M48.26
- Daoud J., Karamanev D. Formation of jarosite during Fe2+ oxidation by Acidithiobacillus ferrooxidans. Minerals Engineering. 2006. Vol. 19. Iss. 9, p. 960-967. DOI: 10.1016/j.mineng.2005.10.024
- Demopoulos G.P., Gefvert D.L. Iron (III) Removal from Base-Metal Electrolyte-Solutions by Solvent-Extraction. Hydrometallurgy. 1984. Vol. 12. Iss. 3, p. 299-315. DOI: 10.1016/0304-386x(84)90003-3
- Reyes I.A., Patiño F., Flores M.U. et al. Dissolution rates of jarosite-type compounds in H2SO4 medium: A kinetic analysis and its importance on the recovery of metal values from hydrometallurgical wastes. Hydrometallurgy. 2017. Vol. 167, p. 16-29. DOI: 10.1016/j.hydromet.2016.10.025
- Dutrizac J.E., Hardy D.J., Chen T.T. The behaviour of cadmium during jarosite precipitation. Hydrometallurgy. 1996. Vol. 41. Iss. 2-3, p. 269-285. DOI: 10.1016/0304-386X(95)00062-L
- Dutrizac J.E. The behaviour of the rare earths during the precipitation of sodium, potassium and lead jarosites. Hydrometallurgy. 2004. Vol. 73. Iss. 1-2, p. 11-30. DOI: 10.1016/j.hydromet.2003.07.009
- Schlesinger M.E., King M.J., Sole K.C., Davenport W.G. Electrolytic Refining. Extractive Metallurgy of Copper. 5th edition. Oxford: Elsevier, 2011, p. 251-280.
- Gaboreau S., Philippe V. Prediction of Gibbs free energies of formation of minerals of the alunite supergroup. Geochimica Et Cosmochimica Acta. 2004. Vol. 68. Iss. 16, p. 3307-3316. DOI: 10.1016/j.gca.2003.10.040
- Mitchell A., Myint W., Lynn K. et al. Geology of the High Sulfidation Copper Deposits, Monywa Mine, Myanmar.
- Resource Geology. 2010. Vol. 61. Iss. 1, p. 29. DOI:10.1111/j.1751-3928.2010.00145.x
- Havlík T. Leaching of Copper Sulphides // Hydrometallurgy. Woodhead Publishing, 2008, p. 341-443.
- Jia Y., Ruan R., Zhong S. et al. Heap bioleaching of a net-acid generating copper sulfide: comparison of high and low acidity leaching systems. Heap Leach Solutions. 2015, p. 357-368.
- Schlesinger M.E., King M.J., Sole K.C., Davenport W.G. Hydrometallurgical Copper Extraction: Introduction and Leaching. Extractive Metallurgy of Copper: 5th edition. Oxford: Elsevier, 2011, p. 281-322.
- Ruan R., Liu X., Zou G. et al. Industrial practice of a distinct bioleaching system operated at low pH, high ferric concentration, elevated temperature and low redox potential for secondary copper sulfide. Hydrometallurgy. 2011. Vol. 108. Iss. 1, p. 130-135. DOI: 10.1016/j.hydromet.2011.03.008
- Zaw K., Swe W., Barber A. et al. Introduction to the geology of Myanmar. Memoirs. 2017. Vol. 48, p.17. DOI:10.1144/M48.1
- Das G.K., Acharya S., Anand S., Das R.P. Jarosites: A Review. Mineral Processing and Extractive Metallurgy Review. 1996. Vol. 16. Iss. 3, p. 185-210. DOI: 10.1080/08827509708914135
- Jensen A.B., Webb C. Ferrous sulphate oxidation using thiobacillus ferrooxidans: a review. Process Biochemistry. 1995. Vol. 30. Iss. 3, p. 225-236. DOI: 10.1016/0032-9592(95)85003-1
- Ghorbani Y., Becker M., Mainza A. et al. Large particle effects in chemical/biochemical heap leach processes – A review. Minerals Engineering. 2011. Vol. 24. Iss. 11, p. 1172-1184. DOI: 10.1016/j.mineng.2011.04.002
- Leahy M.J., Schwarz M.P. Modelling jarosite precipitation in isothermal chalcopyrite bioleaching columns. Hydrometallurgy. 2009. Vol. 98. Iss. 1, p. 181-191. DOI: 10.1016/j.hydromet.2009.04.017
- Y.Jia, H.-y.Sun, Q.-y.Tan et al. Linking leach chemistry and microbiology of low-grade copper ore bioleaching at different temperatures. International Journal of Minerals, Metallurgy, and Materials. 2018. Vol. 25. Iss. 3, p. 271-279. DOI: 10.1007/s12613-018-1570-2
- Halinen A.-K., Beecroft N.J., Määttä K. et al. Microbial community dynamics during a demonstration-scale bioheap leaching operation. Hydrometallurgy. 2012. Vol. 125-126, p. 34-41. DOI: 10.1016/j.hydromet.2012.05.001
- Quijada-Maldonado E., Romero J., Osorio I. Selective removal of iron (III) from synthetic copper (II) pregnant leach solutions using [bmim][Tf2N] as diluent and TFA as extracting agent. Hydrometallurgy. 2016. Vol. 159, p. 54-59. DOI: 10.1016/j.hydromet.2015.11.003
- Gao K., Jiang M., Guo C. et al. Reductive dissolution of jarosite by a sulfate reducing bacterial community: Secondary mineralization and microflora development. Science of the Total Environment. 2019. Vol. 690, p. 1100-1109. DOI: 10.1016/j.scitotenv.2019.06.483
- Izadi A., Mohebbi A., Amiri M., Izadi N. Removal of iron ions from industrial copper raffinate and electrowinning electrolyte solutions by chemical precipitation and ion exchange. Minerals Engineering. 2017. Vol. 113, p. 23-35. DOI: 10.1016/j.mineng.2017.07.018
- Ruiz M.C., Risso J., Seguel J., Padilla R. Solvent extraction of copper from sulfate-chloride solutions using mixed and modified hydroxyoxime extractants. Minerals Engineering. 2020. Vol. 146, p.106-109. DOI: 10.1016/j.mineng.2019.106109
- Shaw D.R., Dreisinger D.B., Lancaster T. et al. The commercialization of the FENIX iron control system for purifying copper electrowinning electrolytes. JOM. 2004. Vol. 56. Iss. 7, p. 38-41. DOI: 10.1007/s11837-004-0090-x
- Sun Y., Chen J., Li X., Myint W. The high sulfidation epithermal copper deposits at Monywa, Central West Myanmar: Poster. SEG-CODES Conference, September 27-30, 2015, Hobart, Australia. SEG, 2015, p. 2.
- Dong C.-S., Shen Q., Zhang Y.-H. et al. The surface sulphidization and wetting of lead oxide fine particles. Minerals Engineering. 2019. Vol. 134, p. 241-249. DOI: 10.1016/j.mineng.2019.02.014
